免疫檢查點抑制劑療效預測分析及結合中醫證型的Nomogram 圖構建
李 妍 彭心怡 孔燕妮 郭 勇
近年來,實體腫瘤治療領域有57 種免疫檢查點抑制劑進入了17 種腫瘤治療的審批流程,其中有7種分別針對程序性死亡受體1(Programmed Death 1/Ligand 1,PD1/PDL1)的單克隆抗體藥物被美國FDA批準[1-2]。臨床研究注冊數據(Clinicaltrials.gov)顯示,在過去2 年里,進入臨床試驗的免疫檢查點治療項目數逐年增加,但速率正在減緩[3],年齡、既往接受化療的線數、體力、腫瘤分期、病理分級均可能影響免疫治療療效[4-5]。目前臨床試驗的亞組數據或免疫治療相關數據不夠充分,尚缺乏真實世界樣本進一步證實臨床病理特征聯合臨床參數在常見實體腫瘤免疫檢查點抑制劑療效預測中的作用。本研究將基于單中心真實世界臨床患者應用免疫檢查點抑制劑過程中的臨床參數、免疫代謝相關指標以及中醫證型的參數做進一步數據分析,構建COX 比例風險回歸模型及列線(Nomogram)圖,預測免疫檢查點抑制劑療效構建結合中醫證型參數的個體化模型。
1 資料與方法
1.1 研究對象 2019 年2 月—2021 年2 月于浙江中醫藥大學附屬第一醫院腫瘤內科接受免疫檢查點抑制劑治療的常見實體惡性腫瘤患者53 例。
1.2 納入及排除標準 納入標準:(1)病理診斷明確為惡性腫瘤,中醫辨證分型參照《GB/T 16751.2-1997 中醫臨床診療術語證候部分國家標準(GB)[6]》《中醫診斷學》[7];(2)美國癌癥聯合會(American Joint Committee on Cancer,AJCC 第7 版分期制定的TNM分期[8])為Ⅳ期的患者;(3)在入組時間內初次接受免疫檢查點抑制劑單用或聯合治療;(4)有完整的代謝、免疫、中醫證型隨訪數據。排除標準:(1)隨訪數據不完整;(2)30 天內接受免疫檢查點抑制劑治療;(3)有其他重要臟器器質性病變,如心、肺、腎損害。
1.3 方 法 提取每例患者的年齡、性別、T 分期、N分期和M 分期[8]、客觀緩解時間、既往接受治療情況、聯合治療情況、免疫檢查點抑制劑用藥、瘤種、中醫證型、外周血免疫相關指標(調節性T 細胞Treg、CD3+CD4+、CD3+CD8+、自然殺傷細胞NK cells)、前白蛋白(prealbumin,PAB)、淀粉樣蛋白a(serum amyloid A protein,SAA)、乳酸脫氫酶、鐵蛋白、中性粒細胞與淋巴細胞比率(neutrophil/lymphocyte ratio,NLR)、血小板與淋巴細胞比率(platelet/lymphocyte ratio,PLR)等臨床及實驗室指標進行相關因素分析。
1.4 統計學方法 應用SPSS 24.0 軟件及R 語言對數據進行統計學分析,采用Kaplan-Meier 曲線分析計算風險評分對腫瘤患者免疫檢查點抑制劑應用客觀化解時間獲益的單變量因素,并使用Log-rank 檢驗對Kaplan-Meier 曲線進行評估,檢驗水準α=0.05(雙尾)。使用COX 風險比例模型分析多變量因素,并協助構建Nomogram 圖[9]。使用R 語言3.2.4 構建Nomogram 圖并計算C 指數。
2 結果
2.1 一般情況 在初次免疫檢查點抑制劑應用期間出現進展的21 例患者中:男16 例(76%),女5 例(24%);年齡:≤50 歲1 例(4.8%),50~70 歲10 例(47.6%),≥70 歲10 例(47.6%);疾病緩解時間:≤90天8 例(38.1%),90~200 天10 例(47.6%),≥200 天3 例(14.4%);聯合治療情況:單用免疫治療2 例(9.6%),聯合化療12 例(57.1%),聯合靶向治療7 例(33.3%),聯合化療及靶向治療0 例;治療線數:一線應用免疫藥物6 例(28.6%),二線應用6 例(28.6%),三線應用1 例(4.8%),三線及以上應用8 例(38.1%);治療期間中醫證型主要為陰虛證6 例(28.6%),脾虛證13 例(61.9%),血瘀證2 例(9.5%);瘤種分布情況:肺癌8 例(38.1%),腸癌3 例(14.3%),胰腺癌3 例(14.3%),消化系統神經內分泌癌1 例(4.8%),肝癌1 例(4.8%),胃癌5 例(23.8%)。
在初次免疫檢查點抑制劑應用期間未出現進展的32 例患者中:男20 例(62.5%),女12 例(37.5%);年齡:<50 歲4 例(12.5%),50~70 歲21 例(65.6%),≥70 歲7 例(21.9%);疾病緩解時間:<90 天15 例(46.9%),90~200 天9 例(28.1%),≥200 天8 例(25.0%);聯合治療情況:單用免疫治療6 例(18.8%),聯合化療9 例(28.1%),聯合靶向治療13例(40.6%),聯合化療及靶向治療4 例(12.5%);治療線數:一線應用免疫藥物9 例(28.1%),二線應用3例(9.4%),三線應用9 例(28.1%),三線以上應用11例(34.4%);治療期間中醫證型主要為陰虛證11 例(34.4%),脾虛證19 例(59.4%),血瘀證2 例(6.2%);瘤種分布情況:肺癌11 例(34.3%),腸癌5 例(15.6%),胰腺癌4 例(12.5%),消化系統神經內分泌癌2 例(6.3%),肝癌1 例(3.1%),胃癌6 例(18.8%),其他瘤種3 例(9.4%)。
2.2 免疫檢查點抑制劑應用過程中臨床參數的單因素分析 53 例腫瘤患者中,對所有14 項臨床參數進行單因素COX 回歸分析,發現PAB(P=0.003),SAA(P=0.046)與惡性腫瘤患者免疫檢查點抑制劑客觀緩解時間相關。見表1。
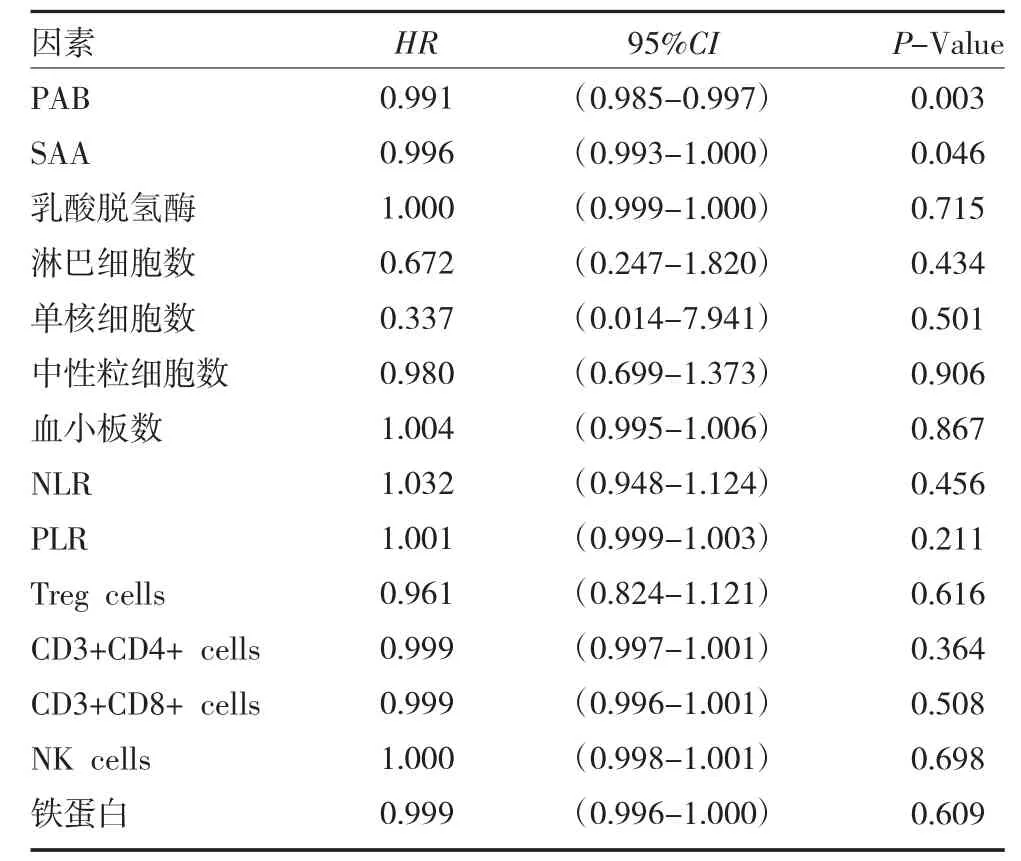
表1 53 例腫瘤患者免疫檢查點抑制劑應用臨床參數的單因素分析
2.3 多因素分析以評估免疫檢查點抑制劑應用中客觀緩解出現進展的獨立危險因素 根據單因素COX回歸分析結果,取P 值<0.1 的PAB、SAA 進一步行多因素回歸構建生存風險模型(R 語言rms 程序包),并得到生存風險回歸模型(風險評分RISK-Score=PAB×0.01498-SAA×0.00318),計算所有患者客觀緩解時間獲益風險評分見表2。

表2 多因素分析評估客觀緩解出現進展的獨立危險因素
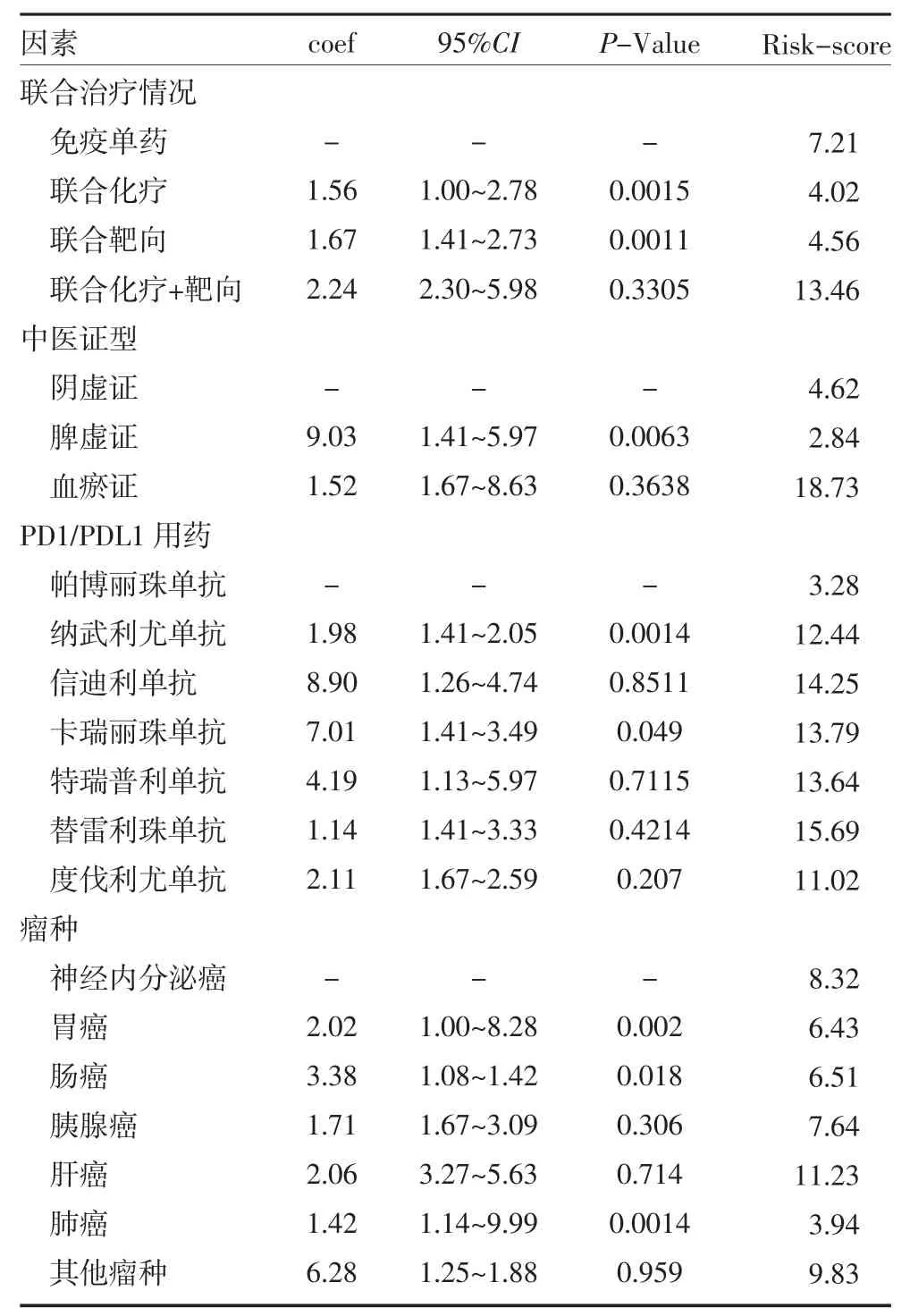
表2 多因素分析評估客觀緩解出現進展的獨立危險因素(續)
2.4 基于COX 多因素回歸分析的Kaplan-Meier 生存分析 使用R 語言survival 及survminer 程序包對COX 多因素回歸分析得到的RISK 風險分值進行Kaplan-Meier 生存預測,根據風險評分預測公式計算每個患者的風險評分,然后以中位數為cut-off 值,將所有患者分為高低危組(見圖1),在53 例惡性腫瘤應用免疫檢查點抑制劑患者中,高危組患者預后顯著差于低危組,log-rank.P=0.001153。
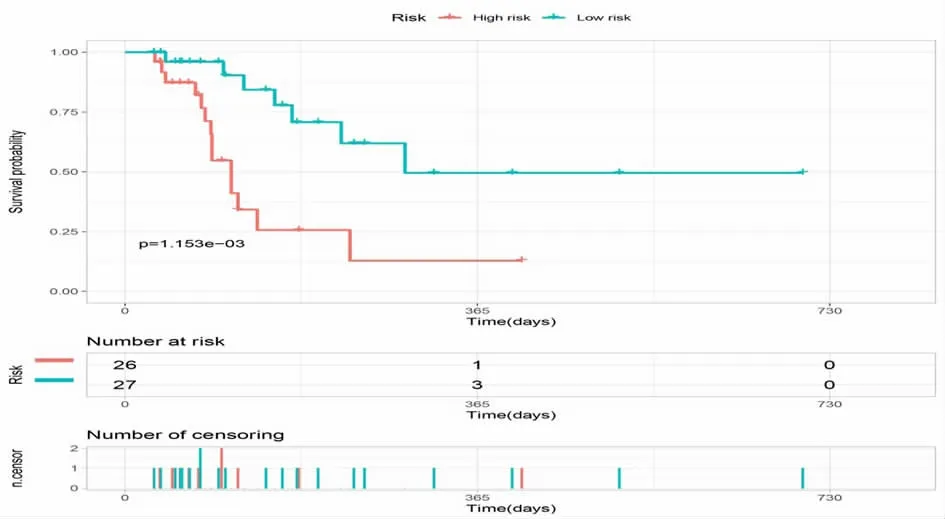
圖1 對風險評分RISKSCORE 進行高低危分組后的Kaplan-Meier 生存曲線
2.5 Nomogram 圖的構建 基于COX 分析得到的與免疫檢查點抑制劑用藥客觀緩解時間有獲益相關的P<0.05 的獨立風險因素:年齡、T 分期、N 分期、治療線數、聯合治療情況、中醫證型、風險評分納入進一步的模型構建,構建Nomogram 圖,由于本研究入組的均為Ⅳ患者,故僅將年齡、聯合治療情況、中醫證型、風險評分等因素列入COX 回歸分析并構建Nomogram 圖從而預測免疫檢查點抑制劑客觀緩解時間(見圖2),采用Bootstrap 法對Nomogram 圖進行內部驗證,自抽樣次數B=1000,驗證結果顯示,C 指數為0.7309(95%CI 為0.6391~0.8228),有良好的預測價值。
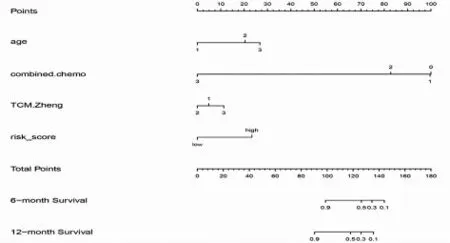
圖2 結合中醫證型的Nomogram 模型對腫瘤患者免疫檢查點抑制劑客觀緩解時間6 個月~1 年的預測
3 討論
由于腫瘤內在機制的異質性及患者宿主個體差異,很多患者對免疫檢查點治療的響應性并不如預期高,腫瘤本身、腫瘤微環境以及宿主因素的復雜性均可能影響免疫治療應答[10-13]。臨床研究設計可能也只能納入有限且檢測標準不一致的分子標志物,如腫瘤突變負荷(tumor mutational burden,TMB)、PD1/PDL1 表達、錯配修復缺陷(different mismatch repair,dMMR)狀態等[14]。因而,采用明確的分子標志物聯合臨床參數協助預測免疫檢查點抑制劑的療效將有一定臨床意義。國內腫瘤治療的中醫藥參與度極高,有研究證實中醫藥對腫瘤的獲益體現在不同方面,如保護放化療后正常組織和細胞損傷、增強化放療效力、減輕瘤周組織炎癥狀態、提高患者體力狀態、改善患者生活質量及延長晚期患者生存時間[15]。結合中醫證候及代謝營養免疫狀態等臨床參數所建立的預測模型,有望成為潛在的免疫檢查點抑制劑療效預測的個體化工具。
臨床通常根據患者現有的分子表達如PD1/PDL1、TMB、dMMR 狀態來判斷免疫檢查點抑制劑的可能獲益,而在宿主因素及腫瘤微環境因素上常常依據疾病分期及常規實驗室檢查作出經驗性判斷,尚未見可靠的評分系統來預測療效。本研究針對真實世界中正在接受免疫檢查點抑制治療的常見惡性實體腫瘤患者,所有的臨床數據都是前瞻性收集并儲存于本中心臨床資料數據庫,包括結合中醫證型的臨床病理學數據,常規檢查中易獲取的隨訪期間外周血代謝、營養及免疫參數以及客觀緩解時間的結局數據,通過R 語言進行COX 生存單因素及多因素分析可能影響免疫檢查點抑制劑客觀緩解時間的臨床參數特征,進一步構建有中醫特征及臨床可及參數的個體化Nomogram 預測模型。我們對14 項臨床參數進行單因素COX 回歸分析發現PAB(P=0.003)與SAA(P=0.046)與客觀緩解時間獲益有關;進一步行多因素COX 回歸分析結果表明,年齡(P<0.01),T 分期(P<0.01),N 分期(P<0.01),治療線數(P<0.01),聯合治療情況(P<0.01),中醫證型(P<0.01),不同免疫檢查點抑制劑(P<0.01)及瘤種(P<0.01)是患者獲得客觀緩解時間獲益的獨立預后影響因素。采用相關因素構建Nomogram 圖提示脾虛證的風險評分較陰虛證低,血瘀證的風險評分最高,聯合治療的風險評分也低于單藥,內部驗證的C 指數為0.7309(95%CI 為0.6391~0.8228),表現出良好的預測價值。
既往研究顯示,對免疫檢查點抑制劑治療有反應患者的基線中位單核細胞計數和中性粒細胞計數均低于無反應患者(P<0.05),提示外周血單核細胞和中性粒細胞計數對晚期非小細胞肺癌患者免疫治療反應具有一定預測價值[16]。相較于以往的研究,未研究通過外周血的髓系細胞數、代謝狀態、免疫細胞數、營養狀態來評估免疫檢查點抑制劑的預測價值,且結合中醫證型的特征納入Nomogram 建模有一定創新。由于本次研究的病例數來自單中心,數量較少,因而僅僅探索性運用回歸模型及Nomogram 圖進行數據療效預測,在今后的工作中可以繼續積累數據,完善模型評估及內外部驗證,為免疫檢查點抑制劑的應用提供可靠的預測工作。

