壓熱-酶解法制備黑豆抗性淀粉及其理化性質
王成祥,饒歡,張美娜,李婉珍,宋平,宋家鈺
1. 同福集團股份有限公司(蕪湖 241000);2. 安徽工程大學微生物發酵工程技術研究中心(蕪湖 241000)
抗性淀粉(Resistant Starch,RS)是指在小腸中不能被酶解的淀粉,但在人的腸胃道結腸中可以與揮發性脂肪酸起發酵反應。它最早是由英國著名生理學家Englyst于1982年在定量測定膳食纖維中發現[1],有部分淀粉不能被淀粉酶水解,因而將其命名為抗性淀粉。抗性淀粉具有類似膳食纖維的生理功能,有較低的血糖生成指數、降低血清膽固醇、促進無機鹽吸收等基本功效,使其具有較高的開發利用價值,倍受國內外研究學者的關注[2-4]。
目前,抗性淀粉的制備方法主要有熱處理法[5]、脫支處理法[6]、微波處理法[7]、超聲處理法[8]、螺桿擠壓法[9]、晶種誘導法[10]等。單一的處理手法使得抗性淀粉的整體結晶度和得率均較低,應用效果受到一定程度的制約,開發高效的制備方法和工藝具有重要的理論和應用價值。采用壓熱-酶解法制備黑豆抗性淀粉,考察加酶量、酶解時間、壓熱時間、壓熱溫度對抗性淀粉得率的影響。
1 材料與方法
1.1 材料與主要試劑
蓋亞農場有機黑豆,抗性淀粉約占1.76%;耐高溫α-淀粉酶(>2100 U/g)、胰酶(含胰淀粉酶25 U/mg)、糖化酶(100000 U/g):Aladdin;普魯蘭酶(>1000 npun/g):SIGMA;其他試劑均為分析純:國藥集團化學試劑有限公司。
1.2 主要儀器與設備
PHSJ-4A型pH計,上海精密科學儀器有限公司;AL104型精密電子天平,梅特勒-托利多儀器;L550臺式低速離心機,湖南湘儀實驗室儀器開發有限公司;JH723可見分光光度計,上海菁華科技儀器有限公司;JB-2010數顯恒溫磁力攪拌器,金壇市杰瑞爾電器有限公司。
1.3 試驗方法
1.3.1 壓熱-酶解法制備抗性淀粉
1.3.1.1 制備工藝
將黑豆用粉碎機粉碎過0.150 mm孔徑篩,置于干燥箱中干燥,準確稱取2.0000 g干燥后的黑豆粉,置于50 mL容量瓶中,加入25 mL蒸餾水,搖勻;加入過量耐高溫α-淀粉酶(3 U/g干淀粉),于95 ℃預糊化30 min;取出冷卻,用緩沖液調pH至6.0,放入高壓滅菌鍋中高溫加熱(120 ℃,30 min);冷卻至室溫,添加普魯蘭酶在60 ℃恒溫水浴鍋中脫支;反應結束后放入高壓滅菌鍋中100 ℃滅酶10 min;冷卻后,將容量瓶中物體轉移至50 mL離心管中,按4000 r/min離心15 min,除去上清液;將沉淀放入4 ℃冰箱冷藏24 h,取出,離心去除上清液(3500 r/min,10 min);放置室溫后,置于60 ℃恒溫干燥箱中烘干至恒重,粉碎過0.150 mm孔徑篩,即得黑豆抗性淀粉。
1.3.1.2 單因素試驗設計
1.3.1.2.1 普魯蘭酶添加量對抗性淀粉得率的影響
準確稱取2.0000 g過0.150 mm孔徑篩的黑豆粉,按照1.3.1.1方法制備抗性淀粉,其中普魯蘭酶的添加量分別為2,4,6,8和10 npun/g干淀粉。
1.3.1.2.2 壓熱溫度對抗性淀粉得率的影響
準確稱取2.0000 g過0.150 mm篩的黑豆粉,制備抗性淀粉,其中壓熱溫度分別為80,90,100,110和120℃。
1.3.1.2.3 壓熱時間對抗性淀粉得率的影響
準確稱取2.0000 g過0.150 mm篩的黑豆粉,制備抗性淀粉,其中壓熱時間分別為20,25,30,35和40 min。
1.3.1.2.4 普魯蘭酶酶解時間對抗性淀粉得率的影響
準確稱取2.0000 g過0.150 mm篩的黑豆粉,制備抗性淀粉,其中普魯蘭酶的酶解時間分別為4,8,12,16和20 h。
1.3.1.3 抗性淀粉含量的測定
原料中抗性淀粉含量根據參考文獻[11]進行測定。
1.3.2 黑豆抗性淀粉的理化性質研究
1.3.2.1 掃描電鏡分析
樣品粉碎過0.150 mm孔徑篩后在60 ℃干燥箱中烘干至恒重,取樣將樣品用雙面導電膠固定在金屬載物臺上,真空條件下噴金,之后將載物臺置于掃描電子顯微鏡中觀察,并選擇適當的倍數拍攝具有代表性的樣品顆粒形貌。
1.3.2.2 X-射線衍射分析
起始角2=4°,終止角2=40°,步長0.02°,掃描速度4°/min,靶型選Cu,管電流為40 mA,管壓為40 kV。
1.3.2.3 差示掃描量熱儀分析
樣品粉碎過篩,加入適量的去離子水調至樣品質量分數為30%的乳液,取10 mg左右乳質樣品于樣品盤中并立即壓緊密封;在20 ℃下放置24 h平衡水分;以惰性材料三氧化二鋁為參比,淀粉與水的質量比為 1∶2,從40 ℃升溫至190 ℃,升溫速率為10 ℃/min,通氮氣速率30 mL/min。空白樣品池作參比,銦作校準品,繪制熱譜圖并進行數據分析。
2 結果與分析
2.1 壓熱-酶解法制備RS工藝條件優化
2.1.1 普魯蘭酶添加量對抗性淀粉得率的影響
由圖1可知,添加一定量普魯蘭酶后黑豆的RS得率迅速提高,且隨著普魯蘭酶添加量的增加均呈逐漸上升趨勢;在普魯蘭酶添加量為4 npun/g干淀粉時,黑豆RS得率達到最高值,為7.41%,而后隨著普魯蘭酶添加量的進一步增加,黑豆RS得率下降,但黑豆RS含量也仍是比未添加普魯蘭酶時高。
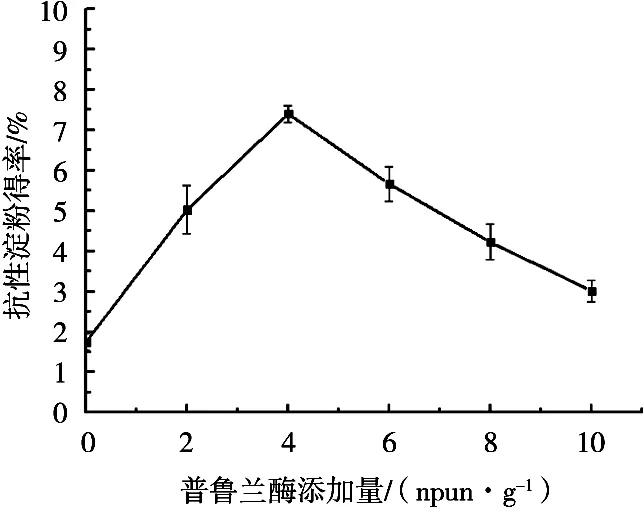
圖1 普魯蘭酶添加量對RS得率的影響
2.1.2 壓熱溫度對抗性淀粉得率的影響
由圖2可知,隨著壓熱溫度的升高,黑豆RS呈先增加后降低的趨勢;當壓熱溫度達到90 ℃時,黑豆RS得率達到最大值,為10.90%,此后隨著壓熱溫度的持續升高黑豆RS得率下降。
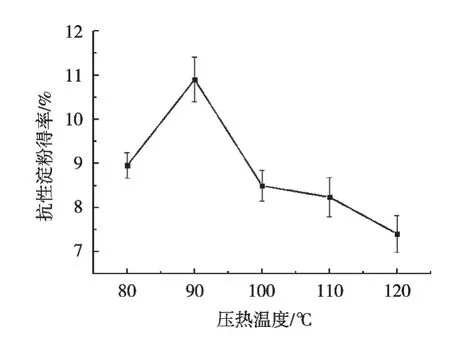
圖2 壓熱溫度對RS得率的影響
2.1.3 壓熱時間對抗性淀粉得率的影響
由圖3可知,隨著壓熱時間的增加,黑豆RS得率呈先上升后降低的趨勢,且在壓熱時間為30 min時RS得率達到最大,最大得率為11.06%。

圖3 壓熱時間對RS得率的影響
2.1.4 普魯蘭酶酶解時間對抗性淀粉得率的影響
由圖4可知,隨著反應時間的增加,黑豆RS得率先增加后減少,且當酶解時間為8 h時,黑豆RS得率達到最大值,最大得率為11.65%。
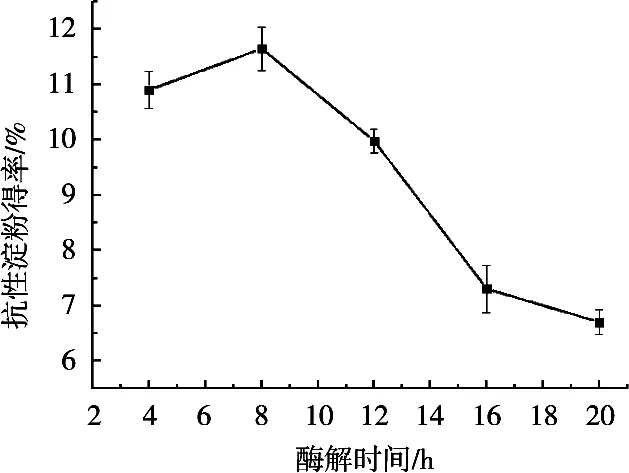
圖4 普魯蘭酶酶解時間對RS得率的影響
2.2 黑豆抗性淀粉理化性質分析
2.2.1 SEM結果與分析
由圖5可以看出,黑豆粉顆粒形狀較圓滑,大小均勻,表面平滑,帶有微小孔隙;壓熱酶解后的黑豆粉顆粒呈不規則的多面體結構,且顆粒體積變小,表面粗糙并伴有層疊褶皺。

圖5 黑豆原料與壓熱酶解后的黑豆樣品的掃描電鏡圖
2.2.2 XRD結果與分析
由圖6可知,原黑豆抗性淀粉X-衍射圖譜與壓熱酶解后的明顯不同。原黑豆在15.02°,17°,17.98°和23.02°處出現衍射峰,屬A型晶體;壓熱酶解后的黑豆在14.5°,17°,22°和24°處出現明顯衍射峰,屬于B型與V型混合晶體。B型晶體和V型晶體具有較強的抗酶解性,表明壓熱酶解法處理后黑豆抗酶解性增大。
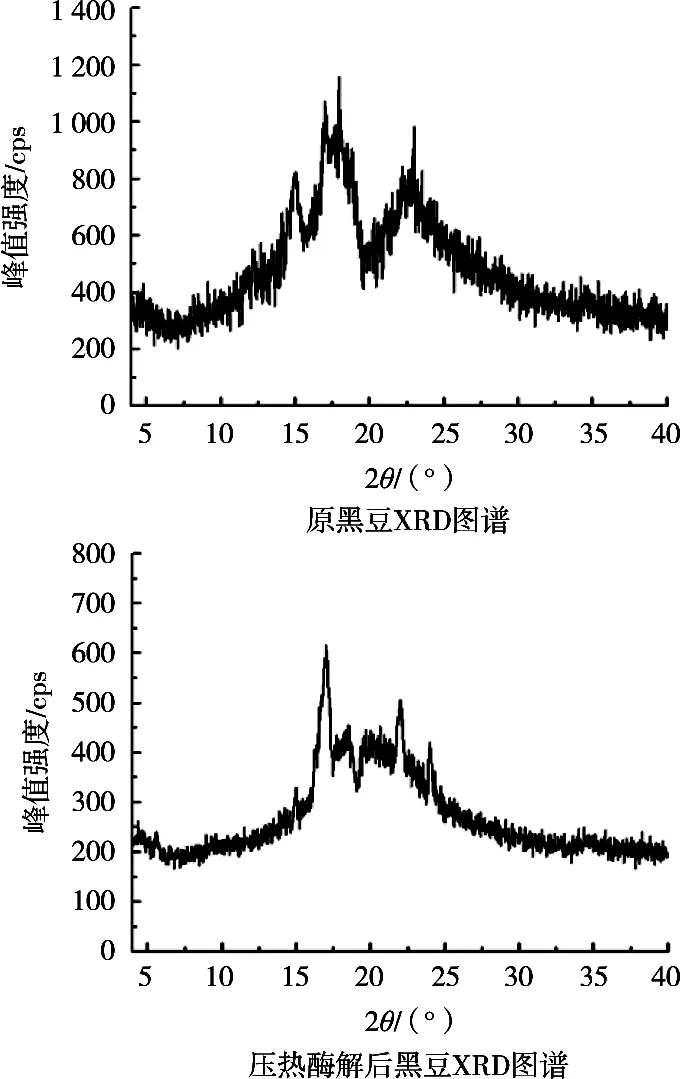
圖6 純化的原黑豆與壓熱酶解后的黑豆X-衍射圖譜
2.2.3 DSC結果與分析
淀粉顆粒在發生相變化和糊化時伴隨著吸熱現象,利用DSC熱分析技術在程序控溫下測定樣品的糊化溫度和相變溫度,可反映出淀粉的微晶結構及結晶程度。由圖7可以看出,壓熱酶解后的黑豆糊化峰變寬,發生相變的初始溫度T0、終止溫度Tf、糊化溫度范圍Tr、糊化焓均有不同程度的提高,表明糊化黑豆所需的初始能量增大,糊化所需溫度增高、能量增大,破壞淀粉結晶區與非結晶區雙螺旋結構所需能量增大。
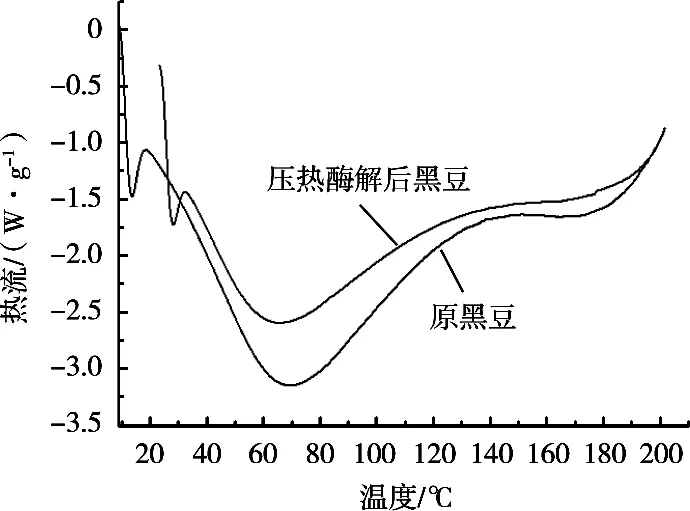
圖7 原黑豆粉與壓熱酶解后黑豆粉的DSC掃描圖
3 結論
以黑豆為原料,采用壓熱酶解法制備抗性淀粉,制備黑豆抗性淀粉的最佳工藝條件為普魯蘭酶添加量4 npun/g干淀粉,壓熱溫度90 ℃,壓熱時間30 min,酶解時間8 h。掃描電鏡、X-衍射、差示掃描量熱儀分析結果表明,經壓熱酶解處理后,黑豆的表觀結構、晶體結構和熱穩定性均發生明顯改變,形貌由表面光滑變成表面粗糙并伴有層疊褶皺,晶體結構由A型轉變成B+V型,熱穩定性和抗酶解性均有不同程度提高。

