環狀RNAcirc-ccnb1通過抑制細胞周期蛋白核轉位對食管鱗癌增殖和遷移的影響*
楊瑜 劉耀河 秦寧 譚柳 宋銳 侯歌 袁金金 張艷 劉宗文
(1.鄭州大學第二附屬醫院放射治療科,河南 鄭州 450014;2.鄭州大學基礎醫學院藥理學教研室,河南 鄭州 450014)
食管癌是目前臨床最為常見的惡性腫瘤之一,預后效果差,5年生存率通常低于20%[1]。腫瘤細胞多通過單克隆或多克隆進行復制,有絲分裂是腫瘤細胞增殖所需要的關鍵步驟[2]。Ccnb1是細胞有絲分裂的調節因子[2],在許多癌癥中都有較高水平的表達[3]。Ccnb1與腫瘤的侵襲能力有密切關聯[4],即在核內Ccnb1表達水平較高的細胞,其侵襲能力較強。目前有研究表明,在多種腫瘤疾病中,環狀RNA cir-ccnb1可以通過抑制ccnb1的功能影響腫瘤的發展,但在食管癌中報道鮮少。本研究通過免疫組化實驗,檢測ccnb1在食管癌組織中的表達量,并通過增殖、劃痕實驗,探討cir-ccnb1對 ccnb1的功能以及對食管癌細胞增殖、遷移的影響。
1 材料與方法
1.1 組織、細胞來源
1.1.1 組織來源 收集鄭州大學第二附屬醫院2014~2015年收治的60例患者手術切除的食管鱗癌標本以及癌旁正常食管粘膜組織標本。入組條件:①術前有接受過放療或化療的,均排除。②術式不能選擇根治術的均排除。選取標本:男性42例,女性18例;65歲以上(含65歲)32例,65歲以下28例。Ⅰ、Ⅱ期32例,Ⅲ、Ⅳ期28例;淋巴結轉移31例,無轉移29例。
1.1.2 細胞系 正常食管上皮細胞(Het1-A)和食管鱗癌細胞(EC109)均由鄭州大學基礎醫學院饋贈。
1.2 免疫組化與蛋白免疫印跡
1.2.1 免疫組化 新鮮標本進行多聚甲醛固定,過夜后石蠟包埋,切成3 μm厚度切片。石蠟切片進行脫蠟、水化,抗原修復后阻斷內源性過氧化物酶,封閉。37 ℃下濕盒中孵育,取出恢復至室溫。應用生物素標記山羊抗小鼠IgG孵育。滴加辣根過氧化酶標記鏈霉卵白素工作液。DAB進行顯色,鏡下觀察染色分化、返藍后進行脫水,中性樹脂封片,200倍鏡下觀察。隨機選取5個視野,計細胞數500個進行評分。評分標準:①不顯色0分,淺黃色1分,棕黃色2分,褐色3分。②陽性細胞<5%為0分,5%為1分,10%為2分,50%為3分,75%為4分。將①與②相加后,<6分為低表達,≥6分為高表達。評分由兩名病理專家采取雙盲法進行評價,若結論不一致則增加一名病理醫師進行評價[5]。
1.2.2 蛋白免疫印跡 檢測食管癌細胞中ccnb1的表達,分別取對數生長期的Het1-A和EC109,將細胞分別種于6孔板,每孔2×105個 /mL,當生長達到90%左右時,應用EDTA消化細胞,洗滌2次,裂解細胞后刮下細胞碎片,完成收集超聲裂解,離心提上清, BCA法測濃度,每孔25 μg加樣,恒壓90 V濃縮膠電泳再用120 V恒壓分離膠電泳。250 mA恒流轉膜,封閉非特異抗體,按抗體稀釋濃度1∶2000(ccnb1),1∶2500(β-actin)。室溫下孵2抗2 h,ECL顯色液進行顯色并暗示中曝光,實驗重復3次。應用軟件Image J1.48進行定量分析,計算目的條帶與內參條帶比值來評估蛋白表達水平。
1.3 過表達circ-ccnb1后對EC109生物學行為的影響
1.3.1 實驗分組 將EC109細胞分3組進行實驗: Blank組、Vector組及circ-ccnb1組,分別取對數生長期的EC109細胞種于6孔板,每組有3個復孔,每孔種植細胞為2×105個 /mL。24 h后對Vector和circ-ccnb1組分別應用lipofectmine3000轉染攜帶空載體和cir-ccnb1的質粒,饑餓轉染6 h,然后換為完全培養基。
1.3.2 核漿分離 按核漿分離試劑盒說明書進行核漿分離及核質裂解、收集細胞核蛋白等相關步驟操作,對提取的核蛋白分別進行定量以及煮樣,然后進行SDS-PAGE電泳測量蛋白的表達量,來衡量ccnb1蛋白的核轉位的量。以增殖細胞核抗原(PCNA)作為核內蛋白內參,抗體稀釋濃度1∶2000。
1.3.3 細胞增殖能力檢測 按照上述處理細胞方法將細胞分別種植于96孔板,每孔2×103個細胞,加入100 μL培養基培育72 h后,加入10 μL CCK8溶液于37 ℃溫度下避光孵育2 h,測算530 nm處吸光值(A),應用公式:細胞增殖率=實驗組A/空白對照組A×100%,計算出細胞增殖率。重復3次實驗。
1.3.4 細胞遷移率檢測 同樣按照上述處理細胞方法將細胞分別種植于6孔板,待細胞生長至以單層形式鋪滿孔底后,使用200 μL的槍頭進行劃痕,磷酸緩沖鹽溶液清洗后,每孔滴加2 mL 2%的胎牛血清培養液,拍照0、24 h的細胞遷移狀況,用Image J1.48計算細胞遷移率,計算方法:首先計算劃痕愈合率=(0 h劃痕寬度-24 h劃痕愈合寬度)/0 h劃痕寬度;然后計算遷移率=實驗組愈合率/空白對照組愈合率。重復實驗3次。

2 結果
2.1 免疫組化檢測食管癌及癌旁正常粘膜組織中ccnb1的表達 對食管鱗癌組織和癌旁正常粘膜組織進行免疫組化,見圖1。ccnb1蛋白的表達在食管鱗癌中高于正常粘膜組織,差異有統計學意義(P<0.05),見表1。
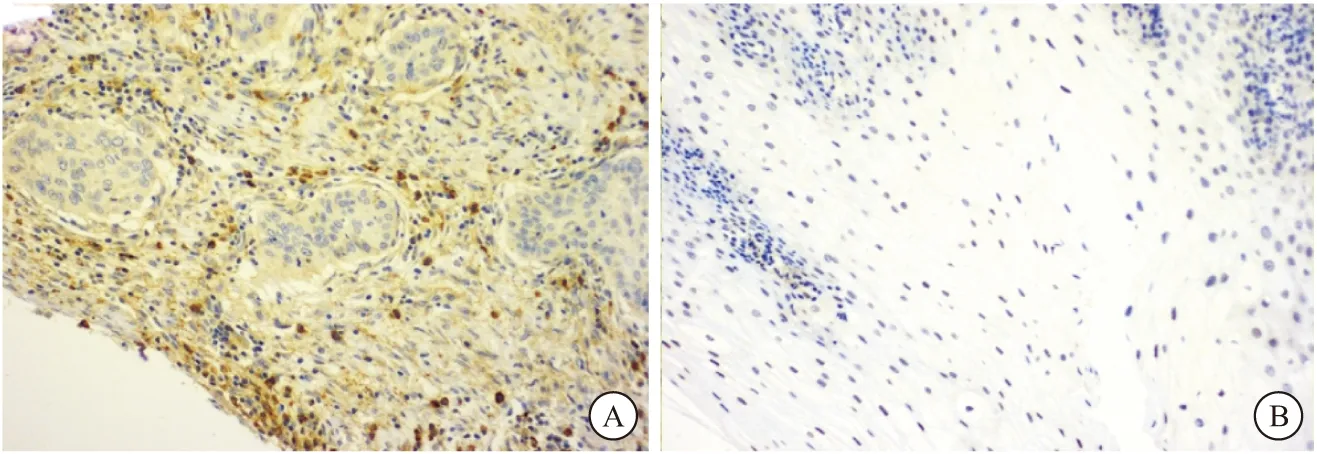
圖1 食管鱗癌組織和癌旁正常粘膜組織中ccnb1的表達情況(200 ×)
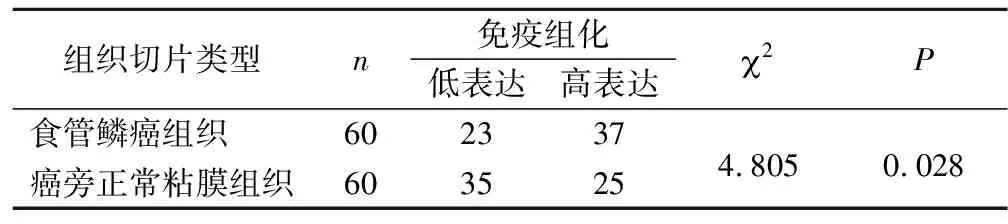
表1 ccnb1蛋白在食管鱗癌組織及癌旁正常粘膜組織中的表達情況
2.2 食管鱗癌中ccnb1表達與臨床病理的關系 對免疫組化的結果進行臨床病理分析,ccnb1蛋白的高表達與患者的性別、年齡無相關性(P>0.05),與食管癌的淋巴結轉移及病理分期有關(P<0.05),見表2。
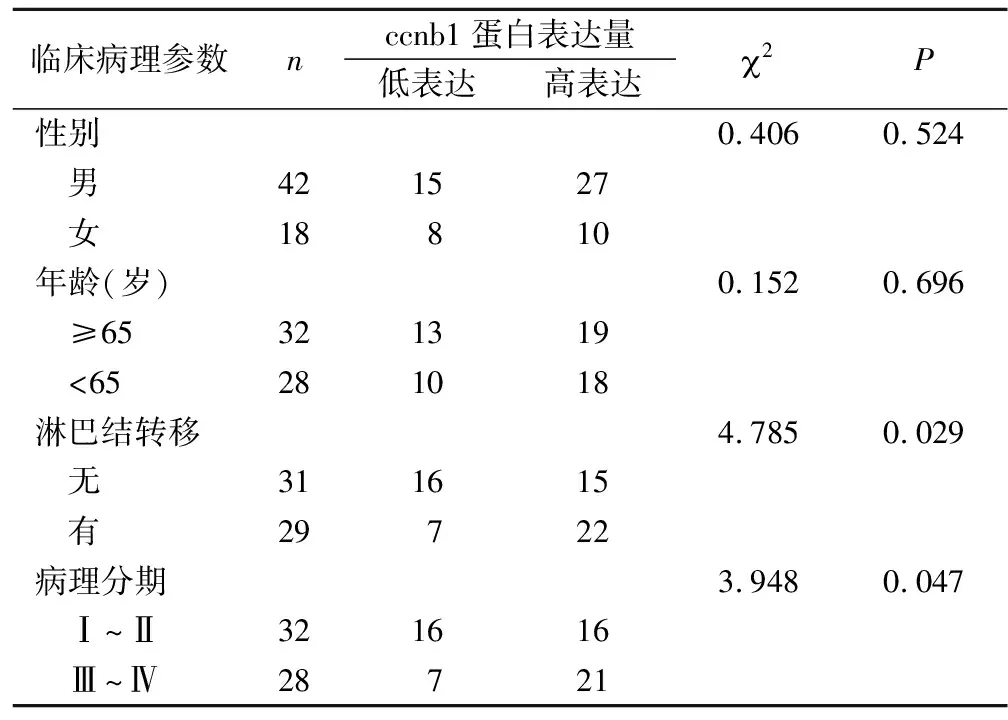
表2 食管鱗癌中ccnb1表達與臨床病理參數的關系
2.3 Het1-A與EC109中ccnb1表達水平的比較 Het1-A組中ccnb1的表達水平(0.67±0.14)低于EC109組(1.01±0.06),兩組差異有統計學意義(t=-3.912,P=0.017),見圖2。
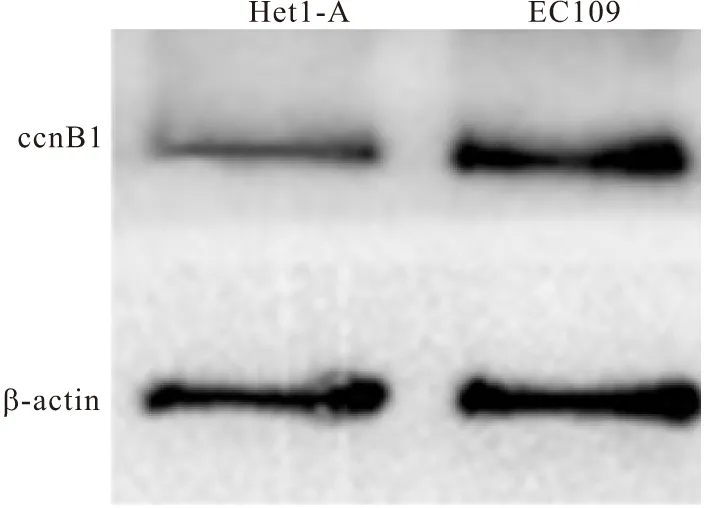
圖2 Het1-A與EC109中的ccnb1的表達水平
2.4 過表達circ-ccnb1后ccnb1在核內水平的變化 與Blank組和Vector組相比, circ-ccnb1組細胞核的ccnb1蛋白表達明顯降低(P<0.05)。與Vector組相比, circ-ccnb1組細胞的增殖率、遷移率降低(均P<0.05),見圖3、表3。
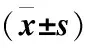
表3 Ccnb1核轉位水平、細胞增值率、細胞遷移率的比較
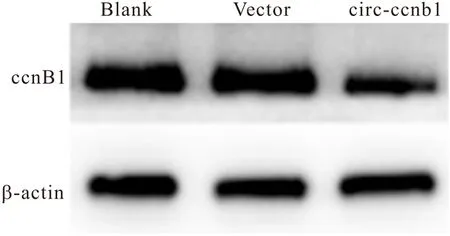
圖3 3組細胞的ccnb1核轉位水平
3 討論
環狀RNA是一大類單鏈RNA,屬于非編碼RNA,具有廣泛的表達模式[6-8]。已知許多環狀RNA在癌癥的發展中發揮作用[9]。Circ-RNA表達譜在哺乳動物間具有保守性[10]。通過對小鼠和人類細胞RNA測序數據的全基因組分析,揭示了環狀RNA的進化保守性,提示其在細胞生理學中的具體作用[11-12],由于其穩定性的提高,環狀RNA可能比線性RNA更有效[13]。考慮到環狀RNA的豐富度和進化保守性,其可能具有潛在的調節作用[14-15]。環狀RNA在細胞質中高度表達,且含有多個microRNA(miRNA)結合位點,有可能具有抑制miRNA活性的功能[16]。Du等[17]發現,circ-RNA不僅與蛋白質結合,還調控蛋白質的核轉位,影響細胞增殖。cir-ccnb1是來源于ccnb1基因的外顯子4和外顯子5,cir-ccnb1在癌組織中的含量顯著低于正常組織[7],這就有可能說明cir-ccnb1是抑制腫瘤發展的一個因素。
環狀RNA對腫瘤相關疾病有著廣泛的研究前景。有研究發現,某些circ-RNA可以通過與蛋白質結合來掩蓋其結合位點,抑或作為競爭物阻斷蛋白質的生物學功能[18]。目前對circRNA的研究主要集中在其作為有效分子海綿的功能上[19]。有研究發現,circRNA作為一種新的生物標志物具有巨大的潛力,并為早期診斷提供了新的思路[20]。對于其中circ-ccnb1相關的研究來說,Yang等[21]研究表明,環狀RNA 可以通過參與蛋白質翻譯過程進而影響腫瘤發展。值得注意的是,它還與多種信號通路轉導的因子具有相互作用,通過某幾個結合位點與之結合[22]。降低ccnb1誘導的有絲分裂活動是一種新機制,是研究出新的干預癌癥進展的關鍵[22]。本研究中免疫組化實驗發現,食管鱗癌組織中ccnb1的高表達與患者的淋巴結轉移及病理分期關系密切。據李麗等[23]報道,ccnb1在食管鱗癌發生、發展過程中呈高表達,這與本研究結果一致。通過研究食管鱗癌細胞上circ-ccnb1對ccnb1可產生作用,發現它可以抑制該蛋白的核轉位,阻止其功能的發揮,這就抑制了腫瘤細胞的有絲分裂,從而抑制了食管鱗癌細胞的增殖、遷移。
Fang等[22]通過動物實驗,探討了circ-ccnb1作為癌癥治療藥物的可能性,并且取得了良好的效果。這些研究是具有突破性意義的,為circ-ccnb1的研究提供了廣闊的臨床應用的前景。針對ccnb1的生物作用,應用circ-ccnb1很可能會成為治療癌癥的一種新藥物或新手段。同時由于circ-ccnb1對腫瘤的抑制作用,它的表達水平的高低也可能作為判斷患者預后的潛在指標。
4 結論
cir-ccnb1可以通過抑制ccnb1在食管鱗癌細胞中的核轉位抑制食管鱗癌的發展,即抑制其增殖和遷移,但尚不能證明年齡、性別存在差異性。

