牡丹響應高溫脅迫的轉錄組分析及PsHSP基因表達
郝力慧,董 彬,朱紹華,馬 進
(1. 浙江農林大學 浙江省園林植物種質創新與利用重點實驗室,浙江 杭州 311300;2. 浙江農林大學 南方園林植物種質創新與利用國家林業和草原局重點實驗室,浙江 杭州 311300;3. 浙江農林大學 風景園林與建筑學院,浙江 杭州 311300)
全球變暖導致植物在生長發育和環境適應性等方面面臨更加多樣化的挑戰[1]。高溫不僅影響植物表型變化,而且會引起植物體內細胞穩態失衡,生長和發育受到抑制,嚴重影響觀賞植物的品質和產量[2?3]。如芍藥Paeonia lactiflora在遭受高溫脅迫后,植株出現萎蔫、畸形、變色等熱害現象,甚至全株死亡[4]。在牡丹P. suffruticosa中也出現類似的表型現象[5]。另外,經過高溫處理后,牡丹和月季Rosa chinensis植株內的脯氨酸、丙二醛、可溶性糖以及相對細胞膜透性顯著升高,而凈光合速率、超氧化物歧化酶和可溶性蛋白質含量等顯著降低[6?8]。為了深入了解高溫脅迫對觀賞植物品質的影響,利用現代分子生物學以及轉錄組學等手段[9],挖掘關鍵基因并解析其調控耐熱的分子機制,是培育和開發耐熱優良品種的重要途徑。對非洲菊Gerbera jamesonii切花高溫處理后,轉錄組分析發現大部分單基因簇(unigene)可注釋到細胞過程、代謝過程和結合功能等基因本體(GO)過程中[10];全基因組及代謝途徑數據庫(KEGG)中代謝功能途徑中的單基因簇分布最多。在柳枝稷Panicum virgatum中發現[11]:長期高溫脅迫條件下大量的基因發生差異表達,其中與ATP酶調節因子、伴侶結合和蛋白質折疊相關的基因顯著上調,與蛋白質修飾、轉錄、磷和氮代謝途徑相關的基因在熱脅迫后顯著下調。熱激蛋白(heat shock protein, HSPs)是一類高溫脅迫誘導的主要功能蛋白,其分子量為10~200 kDa,包括HSP60、HSP70、HSP90、HSP100和小分子量熱激蛋白[12](small heat shock protein,sHSP)等 5類。HSPs充當蛋白質質量控制的分子伴侶,作為分子伴侶和折疊催化劑細胞網絡的中心成分,在熱應激中被誘導并參與熱應激過程中的信號轉導[13];sHSP存在多數植物葉肉細胞中,在外界熱誘導條件下的sHSP表達呈現上升的趨勢[14?16]。在女萎Clematis apiifolia[17]中,高溫處理后熱激蛋白熱脅迫后明顯上調,而且sHSPs是對熱脅迫反應最強烈的伴侶基因家族。HSPs不僅響應高溫變化,還對水分、鹽滲透和氧化脅迫等[12, 14]有響應。牡丹是芍藥科Paeoniaceae芍藥屬Paeonia多年生落葉灌木,中國傳統名花[18]。目前,關于牡丹基因的研究多集中于生長發育、花色基因挖掘以及抗氧化活性物質生物合成等方面[19?22],相關耐熱研究報道較少。牡丹對高溫較為敏感,夏季高溫嚴重制約牡丹的生長和發育,致使花期縮短,觀賞品質降低,因此,挖掘牡丹耐熱基因對牡丹熱脅迫分子機制探究,以及牡丹育種和推廣具有重要的意義。
1 材料與方法
1.1 植物材料
實驗材料牡丹‘羽紅’P. suffruticosa ‘Yuhong’保存在浙江農林大學智能實驗大棚。取長勢一致的1年生幼苗移栽至花盆緩苗,1株·盆?1,正常管理。后轉移至人工氣候箱中,在溫度25 ℃,光12 h/暗12 h,光強4 000 lx,濕度80%條件下預培養2周。處理組和對照組分別置于40和25 ℃人工氣候箱中處理24 h,選取相同位置的葉片,使用液氮速凍并保存于?80 ℃冰箱于后期備用,設置3個生物學重復。
1.2 葉片總 RNA 提取及 cDNA 文庫構建
使用Trizol試劑盒(天根,北京)提取牡丹葉片總RNA,按照說明書操作。用紫外分光光度計和質量分數1.5%瓊脂糖凝膠電泳檢查RNA質量,質量檢測合格后,經百邁客生物科技有限公司(北京)使用Illumina HiSeq2 500對6個獨立樣品進行雙端文庫構建以及RNA-Seq測序。
1.3 轉錄組測序及數據分析
將測序獲得的原始序列讀長(raw data)進行過濾組裝,得到高質量的有效序列讀長(clean reads),然后使用Trinity進行序列組裝[23?24]。所得單基因簇序列用基于BLAST算法的搜索和注釋,對照非冗余蛋白質(Nr)數據庫(www.ncbi.nlm.nih.gov/)、全基因組及代謝途徑(KEGG)數據庫(www.genome.jp/kegg/kaas/)、蛋白直系同源簇(COG)數據庫 (www.ncbi.nlm.nih.gov/COG/)以及瑞士蛋白質序列及注解(Swissprot)數據庫(www.expasy.ch/SPORT)等數據庫進行注釋。使用Blast2Go軟件(www.blast2go.com/)進行基因本體論(GO)功能分析。
1.4 基因表達量及差異基因分析
使用Bowtie軟件將測序所得的片段與非冗余基因序列庫進行對比,結合RSEM(RNA-Seq by Expectation-Maximization)預估表達量水平[24?25]。在此基礎上分析高溫脅迫處理前后6組樣本的差異表達基因,使用RPKM[每百萬序列讀長(Reads)中某基因每千長度序列讀長值]統計基因的表達量;單基因簇表達豐度用FPKM值表示,以差異倍數|log2A|≥2。其中,A表示差異倍數或變化倍數(flod change),且錯誤發現率(false discovery rate)≤0.01為標準篩選差異表達基因。
1.5 實時熒光定量 PCR
使用 Primer Premier 5.0軟件設計熒光定量 PCR 引物 (表 1),Prime Script RT reagent Kit With gDNA Eraser試劑盒(TaKaRa,北京)進行實時熒光定量PCR反應。反應體系:上下游引物(10 μmol·L?1)各0.4 μL,cDNA 1.0 μL,ddH2O 3.2 μL,SYBR Premix ExTaq5.0 μL。總反應程序:95 ℃ 預變性 30 s,95 ℃變性5 s,60 ℃ 復性30 s,共38個循環。以 2?ΔΔCt法[26?28]計算目的基因相對表達量,其中以牡丹泛素延伸蛋白基因(Ubiquitin)為內參基因[29],設3次生物學重復。
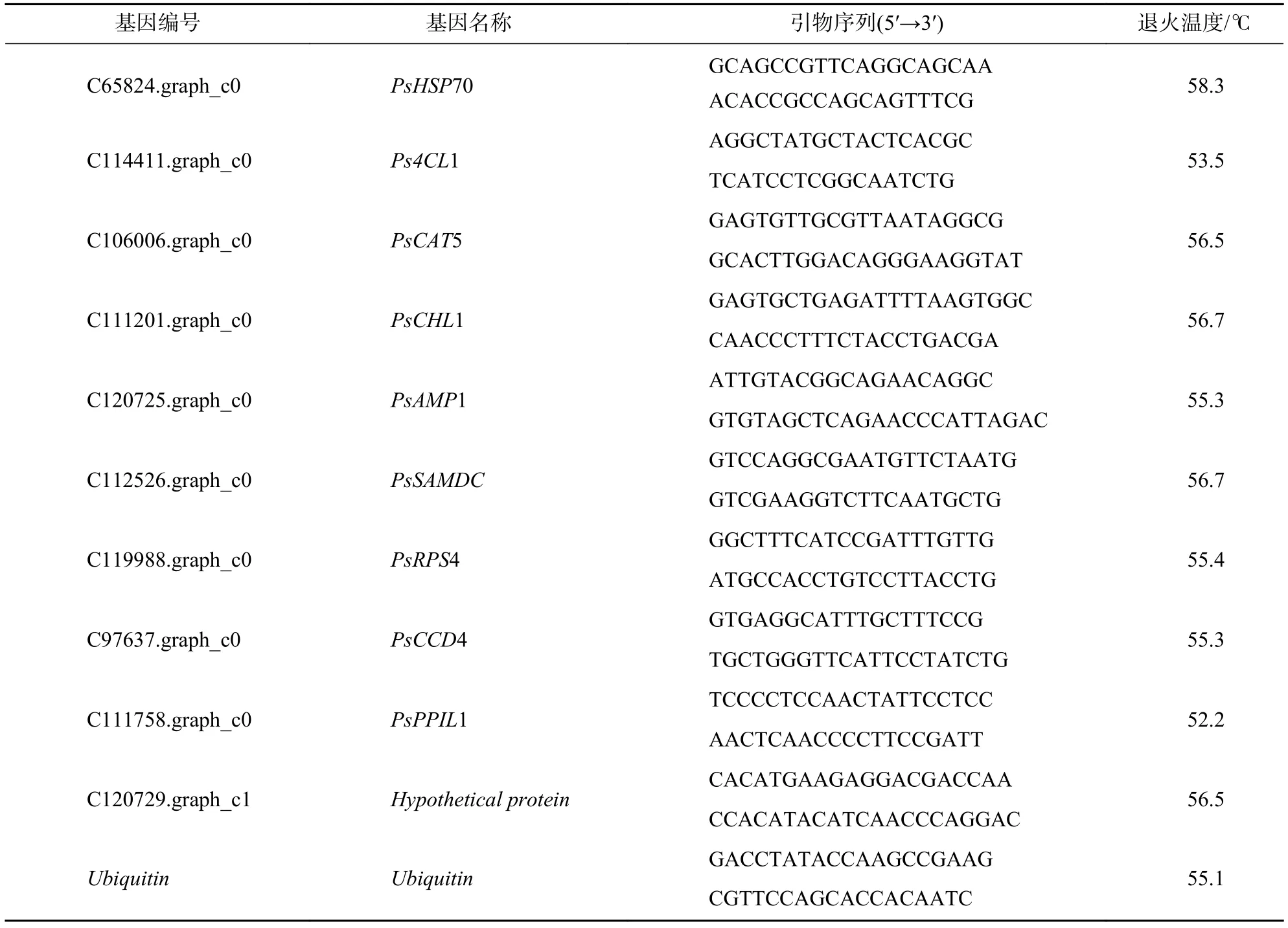
表1 實時熒光定量基因引物信息Table 1 Real-time fluorescence quantitative gene primer information
2 結果與分析
2.1 測序數據組裝結果
對照組(ck1、ck2和ck3)與高溫(40 ℃)處理組(TE1、TE2和TE3)樣本經過測序后,獲得45.97 Gb的有效序列讀長,且6個樣品Q30堿基百分比值均大于等于96.71%(表2)。轉錄本序列數量(transcript number)總計 151 939條,非冗余基因序列數量(unigene number)54 935條,有較高的組裝完整性。經拼接后片段重疊群N50長度為1 561 nt,平均長度為 1 042 nt,長度為 300~500 nt的單基因簇數量占組裝總量的 36.1%,有19 834條。長度500~1000 nt的數量次之,占總量的28.94%。大于2 000 nt的占總量的13.33%(圖1)。
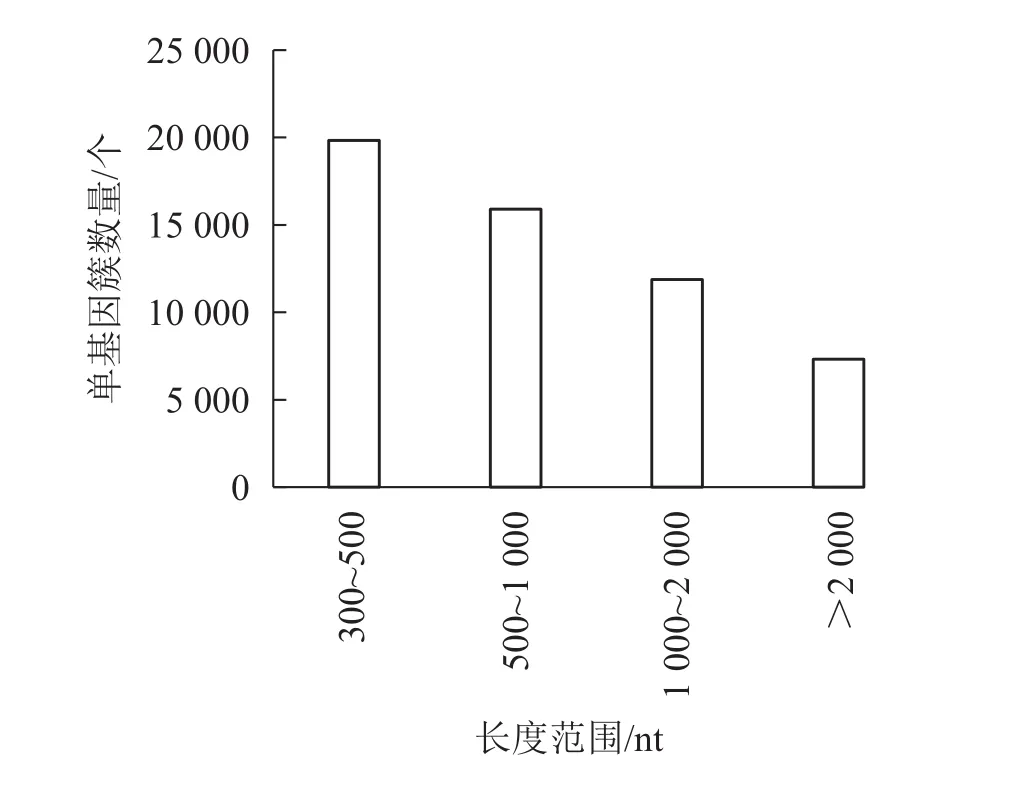
圖1 單基因長度分布Figure 1 Demo unigene length distribution
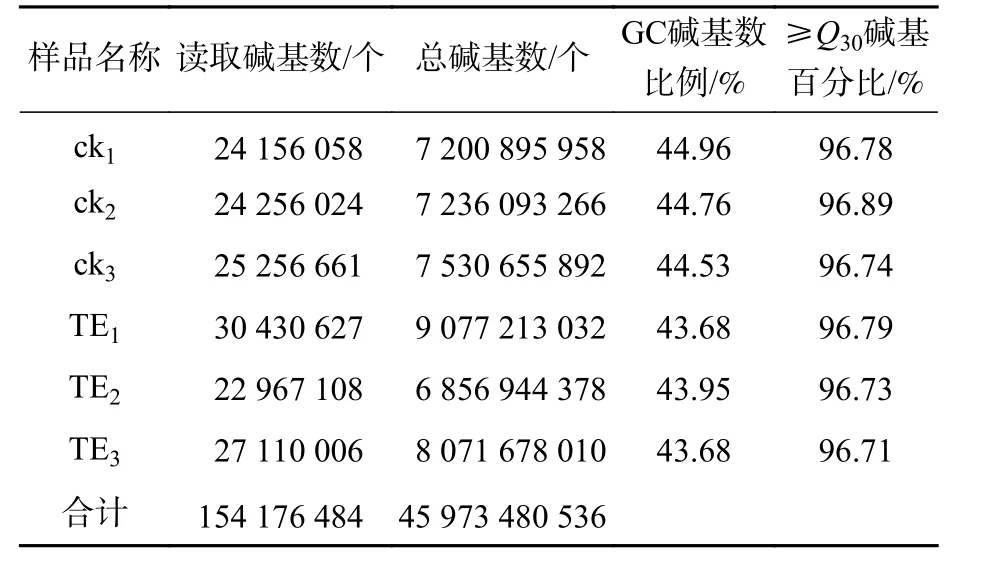
表2 樣品測序數據評估統計表Table 2 Statistical table of sample sequencing data evaluation
2.2 轉錄組單基因簇的數據庫功能注釋
將單基因簇基因序列分別在各數據庫注釋,其中以非冗余蛋白質數據庫(Nr)獲得注釋的比例最高,達到98.76%(表3)。

表3 單基因簇的注釋統計Table 3 Unigene annotation statistics
根據非冗余蛋白質數據庫中的物種注釋對比,做出對應注釋圖和E值分布圖,大部分序列(29.13%)E值為 0~10?150(圖 2A),25.78% 的序列相似度大于80.00%(圖2B);另外,22.43%的單基因簇基因可注釋到葡萄Vitisvinifera,6.56%的單基因簇序列可以注釋到歐洲栓皮櫟Quercus suber(圖2C)。
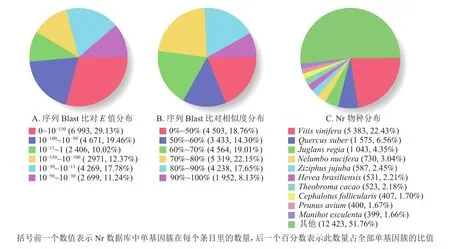
圖2 非冗余蛋白質注釋分布Figure 2 Nr annotation distribution
2.3 響應高溫脅迫的差異基因功能富集分析
以差異倍數≥2和錯誤發現率≤0.01為標準,共篩選獲得7 673個差異基因,其中4 220個基因上調表達,3 453個基因下調表達。利用Web基因本體論注釋軟件進行基因本體富集分析(表4),有6 443個差異基因富集于生物過程,主要集中于代謝過程(1 702個,占26.42%,GO:0008152)、細胞進程(1 489個,占23.11%,GO:0009987)和單一生物進程(1 148個,占17.82%,GO:0044699);有6 491個差異基因富集于細胞組分,主要集中于細胞(1 316個,占20.27%,GO:0005623)、細胞組分(1 302個,占 20.06%,GO:0044464)和細胞膜(1 232個,占 18.98%,GO:0016020);有 3 812個差異基因富集于分子功能,主要分布在催化活性(1 719個,占 39.95%,GO:0003824)、結合活性(1 523個,占35.09%,GO:0005488)和轉運活性(291個,占7.63%,GO:0005215)等過程。
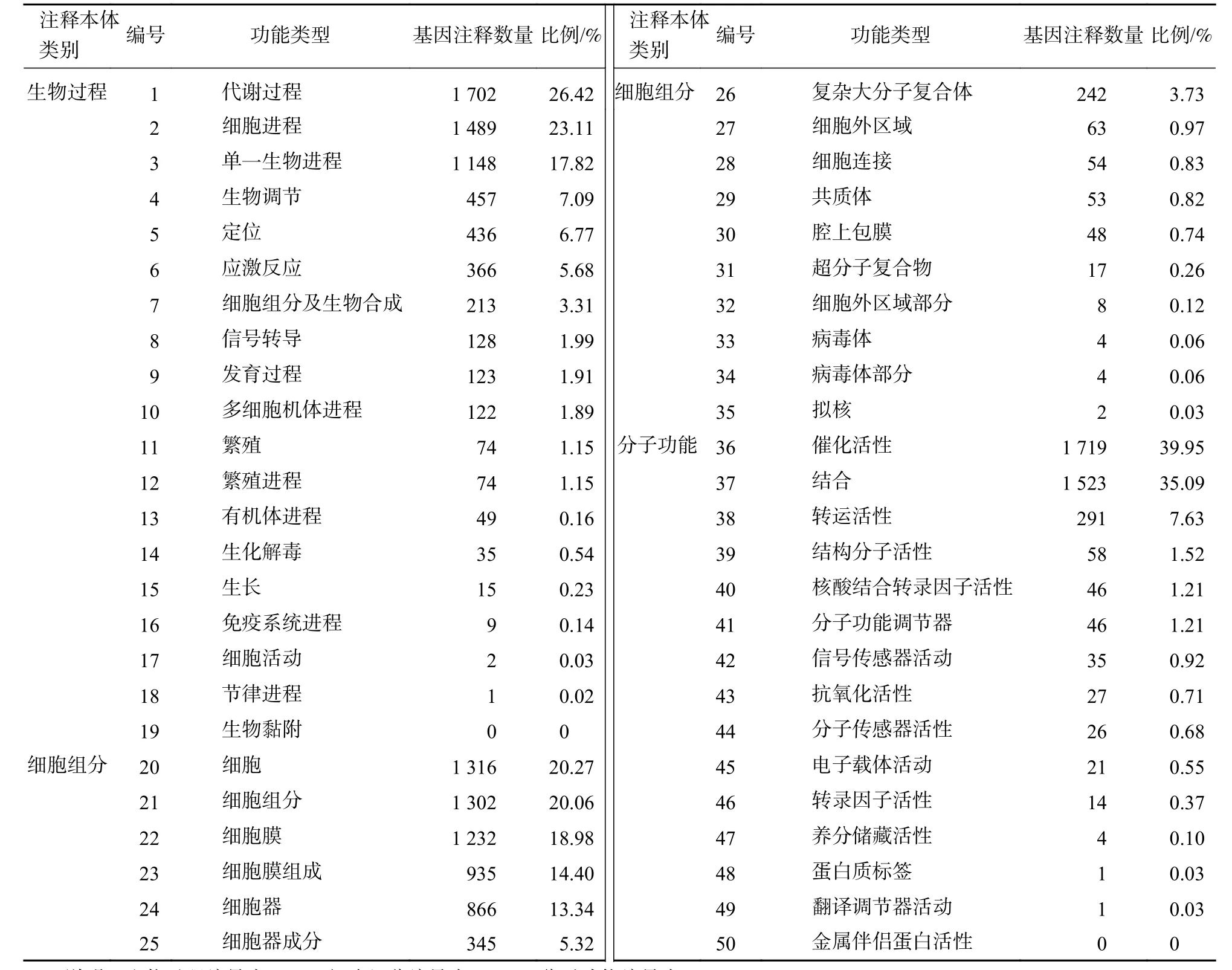
表4 差異表達基因本體注釋Table 4 Difference expression gene GO annotation statistics
將高溫組(TE1、TE2、TE3)與對照組(ck1、ck2、ck3)相比,進行全基因組及代謝途徑調控網絡富集分析,共有949個差異基因(different expression gene set,DEGs)可注釋到全基因組及代謝途徑通路中(表 5)。集中在碳代謝途徑 (carbon metabolism)和內質網蛋白質加工 (protein processing in endoplasmic reticulum)的差異基因數量較多(99個和59個),其次是苯丙烷類生物合成(phenylpropanoid biosynthesis)和糖酵解/糖異生途徑(glycolysis/gluconeogenesis)。表明在高溫刺激后,牡丹中的多種代謝途徑、生物合成途徑和內質網蛋白加工途徑等均發生變化,積極參與應激響應。
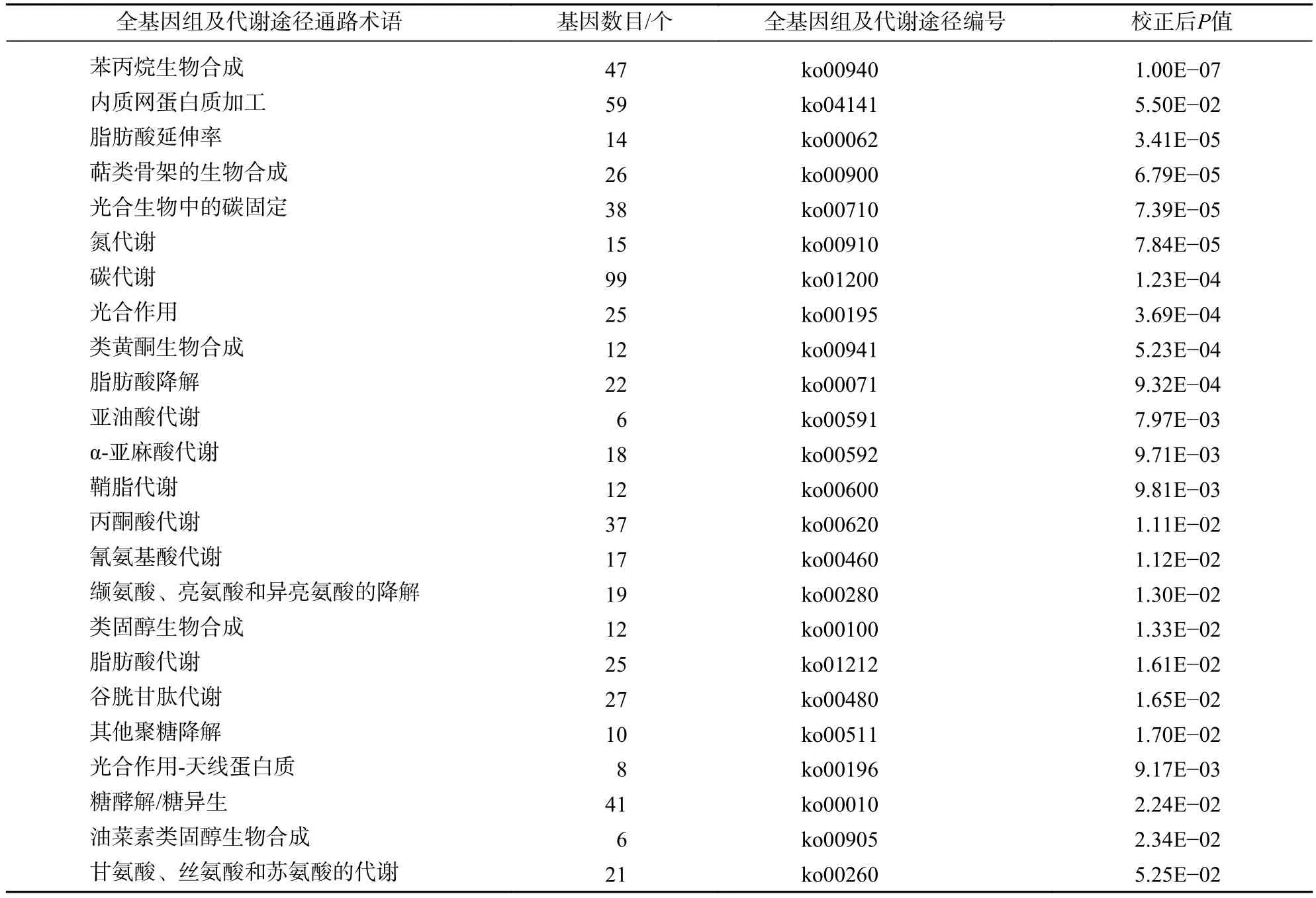
表5 高溫處理下差異表達基因的代謝通路分析Table 5 Analysis of metabolic pathways for gene expression of differences under high temperature treatment
2.4 實時熒光定量分析
為了進一步驗證轉錄組數據,隨機選取10個上調和下調的差異基因,分別是熱激蛋白70(PsHSP70,c65824.graph_c0)、核糖體蛋白S4(PsRPS4,c119988.graph_c0)、酸性黏多糖 (PsAMP1,c120725.graph_c0)、肽基脯氨酰順反異構酶(PsPPIL1,c111758.graph_c0)、4-香豆酸輔酶A連接酶(Ps4CL1,c114411.graph_c0)、陽離子氨基酸轉運蛋白5(PsCAT5,c106006.graph_c0)、葉綠素酶 (PsCHL1,c111201.graph_c0)、類胡蘿卜素裂解雙加氧酶(PsCCD4,c97637.graph_c0)、腺苷甲硫氨酸脫羧酶樣原酶 (PsSAMDC,C112526.graph_c0)以及假定蛋白(c120729.graph_c1),使用qRT-PCR的方法進行驗證分析(圖3),兩者在變化趨勢和差異倍數總體相符,表明測序結果相對可信。
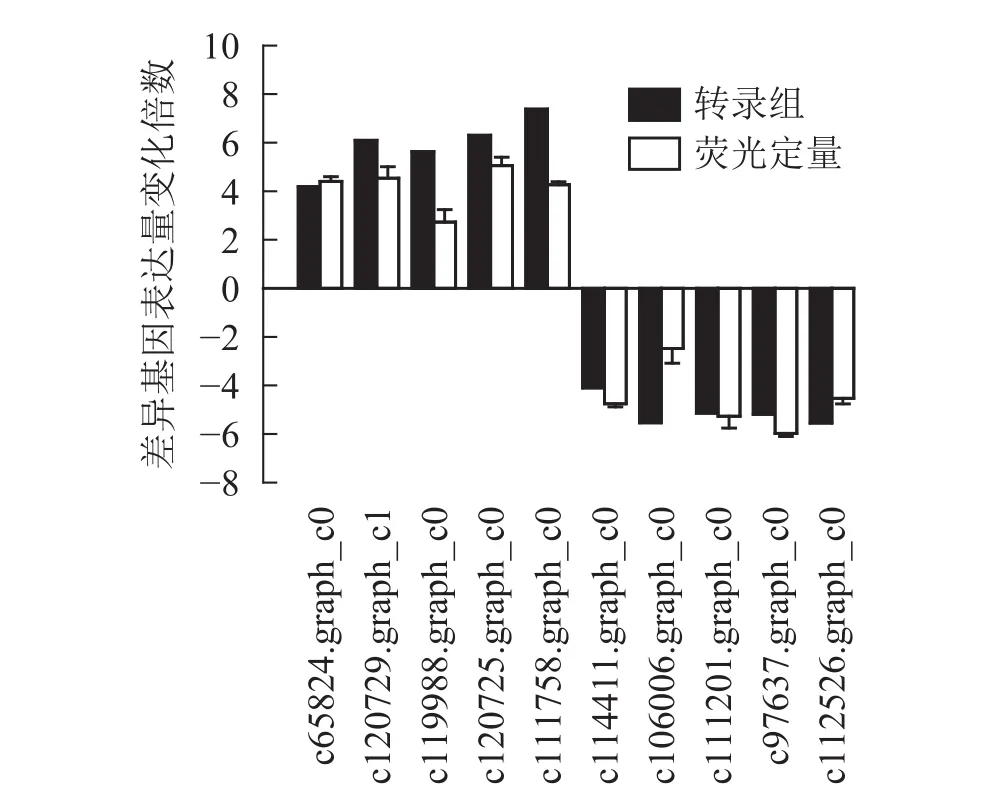
圖3 差異基因定量表達及轉錄組測序比較Figure 3 Real-time fluorescence quantitative results for differential genes
2.5 高溫脅迫下牡丹‘羽紅’熱激蛋白HSP基因挖掘及表達分析
分析測序發現:17個熱激蛋白基因在高溫脅迫后顯著上調表達(表6),這些熱激蛋白多定位在細胞核、線粒體、葉綠體和細胞質等部位。選取6個PsHSP(PsHSP1、PsHSP2、PsHSP4、PsHSP5、PsHSP7、PsHSP11)分別在25和40 ℃處理下進行時空表達分析(圖4)。在40 ℃高溫處理下,6個PsHSP表達呈上升趨勢,且全部于24 h達到最大值,之后便呈現下降趨勢;25 ℃條件下,6個PsHSP表達變化相對穩定。
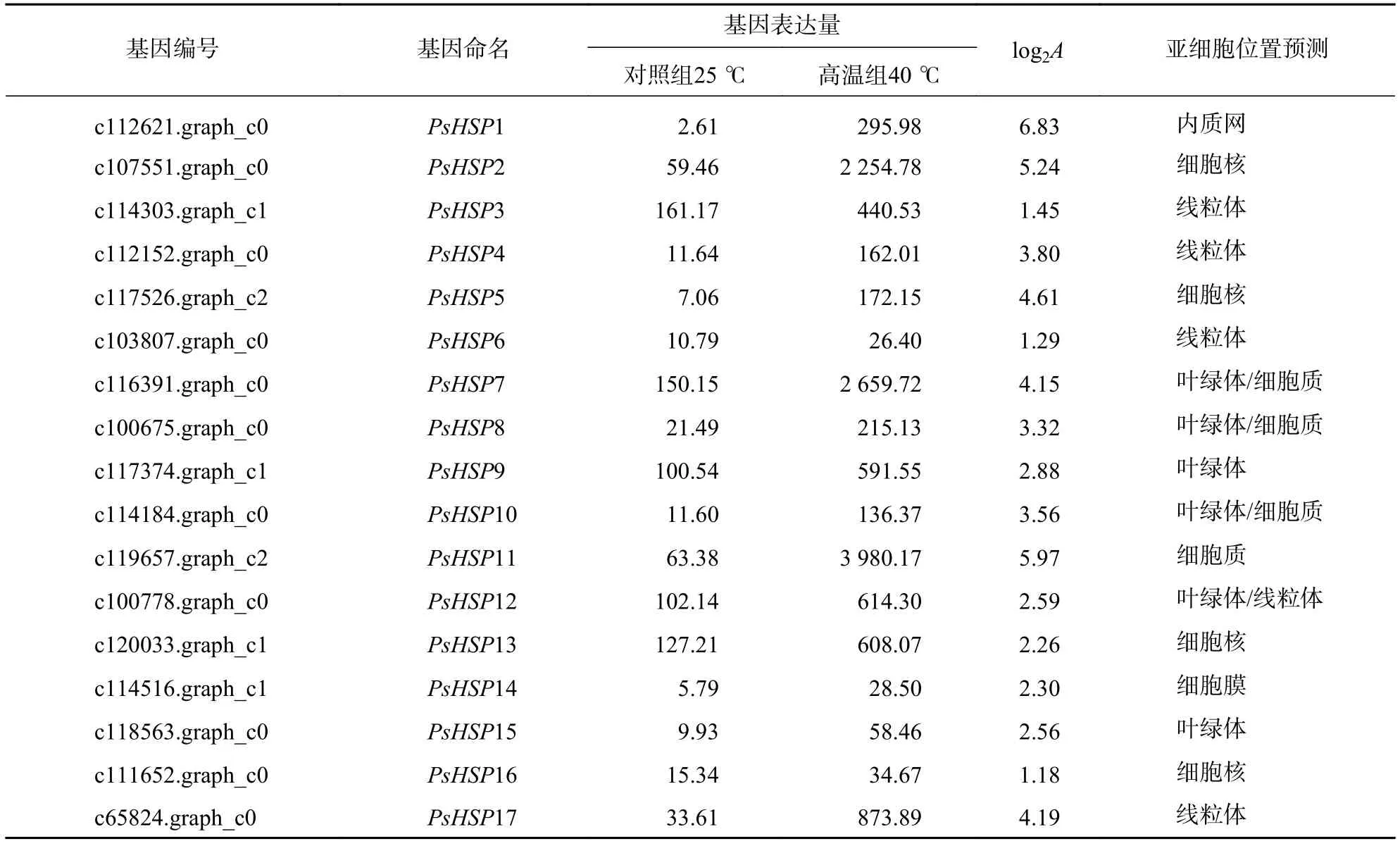
表6 牡丹葉片響應高溫的差異熱激蛋白基因Table 6 Peony leaves respond to high temperature heat shock DEGs
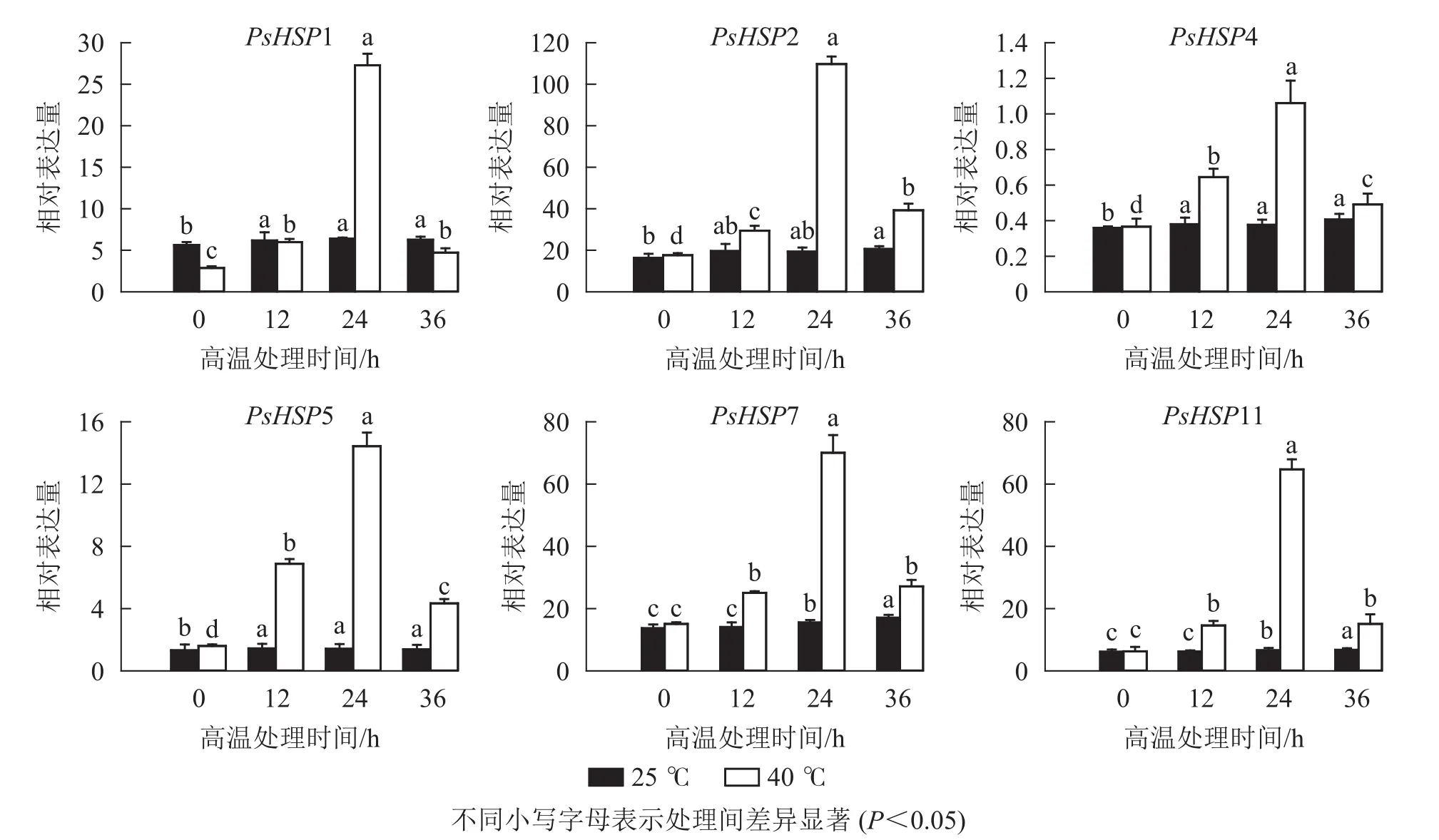
圖4 高溫處理后不同時間 HSP的 qRT-PCR 表達變化Figure 4 qRT-PCR detection of HSP in different time periods after high temperature treatment
3 討論
全球變暖使得世界上許多地區農業受到不同程度的熱害影響。近年來,植物耐熱性研究逐漸受到關注。短期或持續高溫脅迫引起植物形態和生理生化方面的改變,影響植物生長發育的同時也導致農林經濟產量下降[1, 30?31]。高溫是限制牡丹生長的重要因素且嚴重影響其觀賞性。通過RNA-Seq測序發現:牡丹‘羽紅’高溫脅迫后共有7 673個基因差異表達,這些差異基因在基因本體注釋主要集中在代謝過程、細胞過程和單一生物過程;全基因組及代謝途徑數據庫富集分析發現:大部分DEGs富集在碳代謝、內質網蛋白質的加工途徑;同時,苯丙烷生物合成、光合生物中的碳固定、糖酵解/糖異生和丙酮酸代謝等途徑均受到高溫脅迫的影響。
極端溫度可以造成植物體內蛋白質功能障礙導致生長發育受限,熱激蛋白HSPs參與植物細胞膜穩定及相關代謝過程[12, 30],在響應和調節高溫脅迫的過程中發揮重要作用[32?34]。芍藥PlHSP70基因過表達擬南芥Arabidopsis thaliana發現,PlHSP70對擬南芥高溫的耐受性有正向調節作用,高溫處理后轉基因株系的葉綠素熒光值明顯高于野生型植株,此外還具有更加完整的細胞膜、葉綠體和淀粉顆粒。百合Lilium brownie LlHSP70基因異源轉化擬南芥,LlHSP70可以增強轉基因植株的高溫耐性;煙草Nicotiana tabacum Class Ⅰ 類熱激蛋白TLHS1基因在煙草幼苗中的表達水平與耐熱性有較強的相關性,TLHS1轉至煙草幼苗經過高溫脅迫1~4 h后,子葉開張率比轉反義轉基因煙草幼苗高出1倍以上。本研究發現:高溫脅迫后,共有17個PsHSP基因在牡丹中上調表達,且PsHSP1、PsHSP2、PsHSP4、PsHSP5、PsHSP7和PsHSP11在高溫處理后表達上調3倍以上;同時PsHSPs時空表達也發現,PsHSP隨熱脅迫時間增加而表達量上升,24 h后達到最大值后便逐漸下降,說明PsHSP基因可能在短期內迅速響應高溫脅迫并參與牡丹的耐熱調控。綜上,通過轉錄組測序發現,高溫顯著影響牡丹的代謝和生物合成等過程,從而抑制牡丹的生長和發育。PsHSP基因可在短期內迅速響應高溫脅迫并參與牡丹的耐熱調控。本研究可為進一步探究牡丹耐高溫脅迫的分子機制提供依據。

