胃癌組織中miR-338-3p、PTP1B的表達觀察及患者預后影響因素分析
白如雪,許穎穎,劉芳,杜時雨
中日友好醫院內鏡中心,北京100029
胃癌是常見的惡性腫瘤之一,2018年全球新發胃癌病例148.4萬。手術雖是胃癌最重要的治療方法,但晚期胃癌仍缺乏有效治療手段,即使采取綜合治療策略也有較大幾率出現復發和轉移,5年累積生存率也不足30%[1]。因此,尋找能有效評估患者病情進展和預后生物學靶標具有重要意義。微小RNA是一類非編碼RNA,可調控腫瘤細胞增殖、分化、凋亡、侵襲等生物學行為[2]。近年大量研究報道,微小RNA-338-3p(miR-338-3p)在多種腫瘤組織中表達上調,在不同腫瘤類型中發揮促癌基因或抑癌基因作用[3-4]。蛋白質酪氨酸殘基的磷酸化是細胞信號傳導通路中重要環節,可調節腫瘤細胞增殖、分化、凋亡、侵襲等生物學行為,受蛋白酪氨酸磷酸酶(PTPs)和蛋白酪氨酸激酶(PTKs)調控[5]。蛋白酪氨酸磷酸酶1B(PTP1B)為PTPs家族一員,其與卵巢癌、乳腺癌、胰腺癌等多種腫瘤的發生和預后相關[6-8]。目前,關于miR-338-3p、PTP1B與胃癌的關系鮮有報道。2015年1月—2017年12月,我們觀察了胃癌組織中miR-338-3p、PTP1B的表達變化,并分析患者預后影響因素,以期為臨床有效評估患者病情進展和預后提供參考。
1 資料與方法
1.1 臨床資料 選取中日友好醫院接受手術治療的胃癌患者89例,男50例,女39例;年齡47~82(61.25±7.25)歲,其中≥60歲56例、<60歲33例。納入標準:①經術后病理檢查確診;②初次確診,術前未接受放化療等抗腫瘤治療者;③患者及家屬均知情研究;④病歷資料完整者;⑤可接受隨訪者。排除標準:①合并其他部位腫瘤者;②既往惡性腫瘤病史;③心、肝、腎功能嚴重受損者;④合并免疫系統疾病者。腫瘤直徑:≥5 cm 37例,<5 cm 52例;TNM分期[9]:Ⅰ~Ⅱ期36例,Ⅲ~Ⅳ期53例;腫瘤分化程度:未分化9例,低分化19例,中分化48例,高分化13例;浸潤深度:T1 18例,T2 21例,T3 33例,T4 17例;有淋巴結轉移42例,無淋巴結轉移47例。手術留取胃癌及癌旁(距離癌組織>5 cm)組織各89例份。本研究經倫理委員會批準。
1.2 胃組織中miR-338-3p、PTP1B檢測方法 取胃癌組織和癌旁組織標本,TRIzol總RNA抽提試劑盒(無錫百泰克生物技術有限公司)提取組織中總RNA,瓊脂糖凝膠電泳檢測完整性,Qiagen逆轉錄試劑盒(上海研卉生物科技有限公司)合成cDNA,加入引物0.6μL,miR-338-3p:5′-TGAGGGCAAGATGACAAA?GA-3,5′-GCCCTTGCACTTGATGGTAT-3;PTP1B:5′-TTCTGAGCTGGGCTTGTTGT-3′,5′-TGCAGCTA?AAATGCAAACCCAT-3′;miR-338-3p、PTP1B引物0.6μL(5′-TGCGGTTTGGCAATGGTAGAAC-3′,5′-CCAGTG-CAGGGTCCGAGGT-3)混勻。伯樂CFX96熒光定量PCR儀檢測,反應條件:95℃、20 s,95℃、10 s,60℃、20 s,70℃、10 s,循環40次,分別以U6和GAP?DH做內參校正,U6:5′-CTCGCTTCGGCAGCA?CATATACT-3′,5′-ACGCTTCACGAATTTGCGT?GTC-3;GAPDH:5′-CGAGCCACATCGCTCAGA?CA-3′,5′-GTGGTGAAGACGCCAGTGGA-3;反應結束后得到各管Ct,2-ΔΔCt法計算miR-338-3p、PTP1B相對表達量。
1.3 胃癌患者術后隨訪方法 術后通過門診復查和電話方式隨訪3年,隨訪截止2020年12月,統計3年累積生存率,定義為手術至隨訪截止或死亡。
1.4 統計學方法 采用SPSS26.0統計軟件。計數資料以例(%)表示,組間比較采用χ2檢驗;偏態分布或方差不齊的計量資料以M(QL,QU)表示,組間比較采用Z檢驗;相關性分析采用Spearman相關分析法;Kaplan-Meier法繪制生存曲線,組間生存率比較采用Log-rank檢驗;多因素Cox回歸分析法分析胃癌患者預后不良影響因素。P<0.05為差異有統計學意義。
2 結果
2.1 胃癌、癌旁組織中miR-338-3p、PTP1B相對表達量比較 胃癌組織中miR-338-3p、PTP1B相對表達量分別為0.870(0.470,1.485)、1.052±0.059,癌旁組織分別為3.590(2.435,4.570)、0.544±0.116,兩者比較,P均<0.05。
2.2 胃癌組織中miR-338-3p與PTP1B表達水平的相關性 胃癌組織中miR-338-3p與PTP1B表達水平呈負相關(rs=-0.626,P<0.05)。
2.3 miR-338-3p、PTP1B表達水平與胃癌臨床病理參數的關系 miR-338-3p、PTP1B表達與胃癌臨床病理參數的關系見表1,由表1可知,miR-338-3p、PTP1B表達與胃癌TNM分期、浸潤深度、淋巴結轉移相關(P均<0.05)。

表1 miR-338-3p、PTP1B表達水平與胃癌臨床病理參數的關系
2.4 miR-338-3p、PTP1B表達水平與胃癌患者預后的關系 以miR-338-3p中位數和PTP1B平均值為界將89例胃癌患者分為高、低表達組。miR-338-3p高表達組(43例,≥0.87)、miR-338-3p低表達組(46例,<0.87)3年累積生存率分別為76.74%(33/43)、47.83%(22/46),兩組比較,P<0.05;PTP1B高表達組(45例,≥1.05)、PTP1B低表達組(44例,<1.05)3年累積生存率分別為44.44%(20/45)、79.55%(35/44),兩組比較,P<0.05。
2.5 胃癌患者預后不良影響因素單因素和多因素Cox回歸分析結果 隨訪3~36(20.59±8.37)個月,死亡34例,存活55例。死亡組男性22例(64.71%)、年齡≥60歲27例(79.41%)、腫瘤直徑≥5 cm 16例(47.06%)、TNM分期Ⅲ~Ⅳ期28例(82.35%)、低未分化12例(35.29%)、浸潤深度T3~T4 24例(70.59%)、淋 巴 結 轉 移24例(70.59%)、miR-338-3p 0.392(0.141,0.633)、PTP1B 1.102±0.041,存活組分別為28例(50.91%)、29例(52.73%)、21例(38.18%)、25例(45.45%)、16例(29.09%)、18例(32.73%)、1.302(0.871,1.662)、1.022±0.053,兩組年齡≥60歲比例、TNM分期Ⅲ~Ⅳ期比例、浸潤深度T3~T4比例、淋巴結轉移比例及PTP1B表達水平、miR-338-3p表達水平比較,P均<0.05。以年齡(≥60歲=1,<60歲=0)、TNM分期(Ⅲ~Ⅳ期=1,Ⅰ~Ⅱ期=0)、浸潤深度(T3~T4=1,T1~T2=0)、淋巴結轉移(有=1,無=0)、miR-338-3p、PTP1B為自變量,預后為因變量(死亡=1,存活=0),經多因素Cox回歸分析,顯示TNM分期Ⅲ~Ⅳ期、淋巴結轉移、高PTP1B表達水平為胃癌患者預后不良獨立風險因素,高miR-338-3p表達水平為獨立保護因素(P均<0.05)。詳見表2。
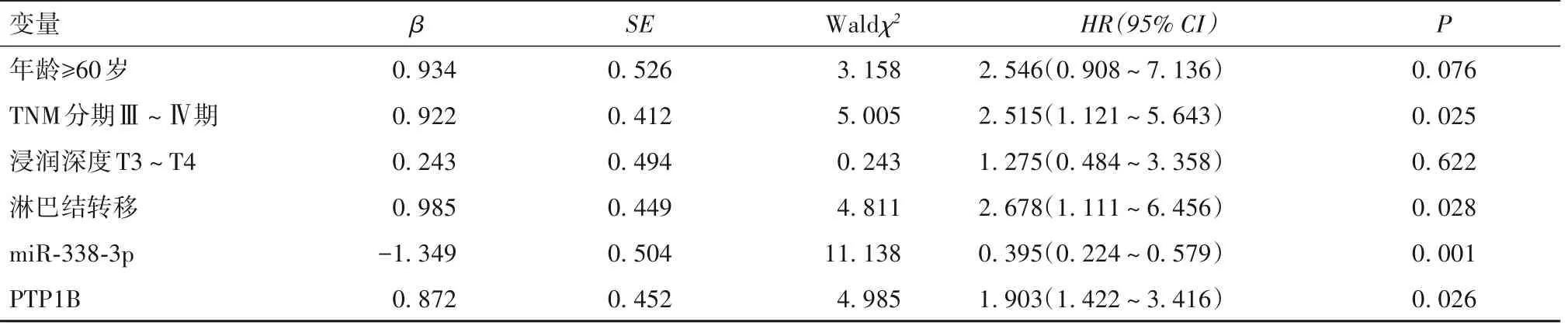
表2 胃癌患者預后不良影響因素的多因素Cox回歸分析結果
3 討論
胃癌是常見的消化道惡性腫瘤,也是全球第3大癌癥死亡原因,一般起源于胃黏膜細胞,與飲食習慣、Hp感染、遺傳、種族等因素有關,主要癥狀為腹痛,但早期常無癥狀,大多患者確診時已達中晚期(Ⅲ~Ⅳ期)[10]。早期胃癌的癌組織浸潤僅限于黏膜層和黏膜下層,治療相對容易,若癌癥浸潤胃壁、全層甚至出現轉移,則需要聯合治療,但由于惡性程度較高,通常預后較差[11]。近年來,隨著分子病理學進入臨床,臨床評估胃癌治療方案更加精細,通常在手術治療基礎上給予放化療、免疫治療、靶向治療等輔助治療,使得腫瘤治療效果升高,但目前以個體化精準化為特征的免疫或靶向治療仍然沒有達到令人滿意的效果,基于基因譜和蛋白表達譜分類的分子病理學是胃癌輔助治療的新基礎[12-13]。因此尚需深入研究胃癌的發生發展機制,以期改善個體化精準化治療效果。
miRNA是一種單鏈非蛋白質編碼RNA,由19~23個核苷酸組成,可結合靶mRNA的3′非翻譯區,調節60%的編碼基因,改變目標基因表達,引起目標mRNAs翻譯抑制和降解。盡管目前尚不明確大多數miRNAs功能作用,但諸多研究表明其參與了各種生理病理過程,包括細胞增殖、分化、凋亡等,且大多位于腫瘤相關的脆性位點或基因區域,與腫瘤發生發展密切相關[2]。miR-338位于人染色體17q25,染色體17q23~25為多種惡性腫瘤突變“熱點”,該染色體突變與腫瘤惡性生物學行為密切相關,提示miR-338可能參與了腫瘤惡性進程[14]。miR-338-3p為miR-338成熟的miRNA序列,其在多種惡性腫瘤中呈異常表達。QIAN等[15]發現,宮頸癌中miR-338-3p表達明顯上調,可通過上調缺氧誘導因子-1α促進宮頸癌細胞增殖和侵襲。孫超等[16]認為,腎癌中miR-338-3p表達明顯下調,可通過下T細胞生長因子4抑制腎癌細胞增殖和侵襲。上述研究提示,miR-338-3p在不同腫瘤類型中發揮不同作用。本研究顯示,胃癌組織中miR-338-3p表達水平明顯低于癌旁組織,與TNM分期、浸潤深度、淋巴結轉移相關,提示miR-338-3p在胃癌中可能作為一種抑癌基因參與胃癌發生,與胃癌TNM分期、浸潤深度、淋巴結轉移相關,符合近年研究報道[17]。進一步分析發現,miR-338-3p高表達組術后3年累積生存率高于低表達水平組,且是患者預后不良的獨立保護因素,說明miR-338-3p可能成為胃癌患者預后評估生物標志物。神經纖毛蛋白1可結合血管內皮生長因子配體,促進腫瘤新生血管生成和抑制腫瘤細胞凋亡,促進癌細胞生長、遷移、侵襲[18]。JIN等[19]通過生物信息學分析和雙熒光素酶報告實驗發現,神經纖毛蛋白1為miR-338-3p直接調控靶基因,轉染miR-338-3p可抑制神經纖毛蛋白1表達,抑制胃癌細胞增殖、遷移、侵襲,促進其凋亡。
細胞增殖、分化、遷移、凋亡等功能改變由信號傳導控制,其是由多條信號通路構成的復雜信號網絡,蛋白質磷酸化和去磷酸化作為一種分子開關,在細胞信號轉導進程中發揮重要作用[20]。酪氨酸為蛋白質磷酸化常見位點,PTKs和PTPs一起調控多種關鍵信號分子的酪氨酸磷酸化狀態,其中PTKs負責酪氨酸殘基的磷酸化,PTPs負責去磷酸化[5]。PTP1B為首個被分離、純化、克隆的PTP,最初研究發現其在機體代謝過程中發揮重要作用,隨著研究進展,越來越多研究表明,PTP1B還參與了腫瘤發生發展。如食管癌中PTP1B上調表皮生長因子受體表達增強癌細胞遷移和入侵能力,具有促癌基因作用[21]。JAK激酶/信號轉導和轉錄激活因子信號通路激活是惡性淋巴瘤生存和增殖基礎,惡性淋巴瘤中PTP1B基因失活突變與JAK激酶/信號轉導和轉錄激活因子信號通路降低或失活相關,說明PTP1B具有抑癌基因作用[22]。本研究顯示,胃癌組織中PTP1B表達水平高于癌旁組織,且與TNM分期、浸潤深度、淋巴結轉移相關,提示PTP1B在胃癌中可能作為一種促癌基因參與胃癌發生,與胃癌TNM分期、浸潤深度、淋巴結轉移相關。進一步分析發現,PTP1B高表達組術后3年累積生存率低于低表達水平組,且為患者預后不良獨立危險因素,說明PTP1B可能成為胃癌患者預后評估生物標志物。目前,尚不明確PTP1B在胃癌中促癌機制,但大量研究[23-24]顯示沉默PTP1B表達能顯著抑制胃癌生長、增殖、遷移、侵襲能力,推測與PTP1B去磷酸化后改變原有蛋白質構象,激活某些細胞信號轉導途徑,引起胃癌細胞惡性進程有關。
本研究還顯示,胃癌組織中miR-338-3p與PTP1B表達水平呈負相關,提示miR-338-3p與PTP1B可能共同影響胃癌病情進展和預后。SUN等[25]通過miRanda和TaegetScan生物信息學網站預測顯示,PTP1B的3′非翻譯區中有兩個miR-338-3p潛在結合位點,雙熒光素酶報告實驗證實在胃癌中miR-338-3p可負向調節PTP1B發揮抑制腫瘤生長和轉移作用。進一步驗證了本研究結果。本研究結果還顯示,TNM分期Ⅲ~Ⅳ期、淋巴結轉移為胃癌患者預后不良獨立風險因素,考慮與Ⅲ~Ⅳ期浸潤較深,已經擴散甚至轉移至其他器官,難以完全切除,因此術后轉移復發幾率高,預后差。
總之,胃癌組織中miR-338-3p表達水平降低,PTP1B表達水平升高,兩者均與胃癌TNM分期、浸潤深度、淋巴結轉移相關,高PTP1B表達水平是胃癌患者預后不良的獨立風險因素,高miR-338-3p表達水平是胃癌患者預后不良的獨立保護因素,兩指標可能作為患者術后預后的評估指標。

