脂蛋白a水平及心臟超聲心動圖鈣化評分與冠心病的相關性
董紅志,李曦銘*,叢洪良,朱延波,王慶彤
(1.天津市胸科醫院心內科,2.超聲科,3.檢驗科,天津 300222)
心血管疾病(cardiovascular disease,CVD)是危及人類生命健康的主要疾病之一,冠心病(coronary heart disease,CHD)則是CVD中最主要的致死疾病。早期準確篩查CHD高危人群并積極預防至關重要,但部分低密度脂蛋白(low density lipoprotein,LDL)控制良好患者仍可能發生心血管不良事件,即存在CVD殘余風險,而脂蛋白a[lipoproteina,Lp(a)]增高是CVD殘余風險的高危因素[1]。近年來,心臟超聲心動圖鈣化評分(echocardiographic calcium score,eCS)與CHD的相關性逐漸受到重視[2]。本研究觀察Lp(a)、eCS與CHD的相關性,以尋找更簡便、敏感、安全和經濟的早期篩查CHD方法。
1 資料與方法
1.1 研究對象 納入2019年6月—2020年5月229例于天津市胸科醫院接受治療、且冠狀動脈造影結果顯示至少1支冠狀動脈主要分支狹窄≥50%的CHD患者(CHD組),男128例,女101例,年齡46~87歲,平均(65.8±7.7)歲;根據病變累及范圍分為單支亞組(n=87)、雙支亞組(n=47)及三支亞組(n=95);以同期113名于本院體檢中心經冠狀動脈CT血管造影(CT angiography, CTA)排除CHD的志愿者作為對照組,男48名,女65名,年齡50~88歲,平均(63.7±8.0)歲。排除罹患主動脈瓣先天性畸形、風濕性心臟瓣膜病、感染性心內膜炎、系統性紅斑狼瘡、嚴重腎衰竭或甲狀旁腺功能亢進等可能影響鈣磷代謝的全身性疾病者。本研究通過院倫理委員會審查(編號:2019LW-008)。檢查前受試者均簽署知情同意書。
1.2 儀器與方法 采用Philips IE Elite/EPIC 7C彩色多普勒超聲診斷儀,S5-1探頭,頻率1.0~5.0 MHz。由2名具有5年以上工作經驗的超聲科醫師獨立評估主動脈根部、主動脈瓣、二尖瓣環、乳頭肌及室間隔鈣化情況。判斷標準:主動脈根部以發現主動脈竇以上2 cm鈣化為陽性,主動脈瓣以回聲增強、且瓣膜厚度≥1 mm為陽性,二尖瓣環、乳頭肌及室間隔以其回聲高于周圍相鄰組織為陽性;據此行eCS(0~5分),即每檢出一處上述部位鈣化記為1分(圖1~4)。意見分歧時,由另1名具有15年以上工作經驗的超聲科醫師再行獨立判斷并得出結果。
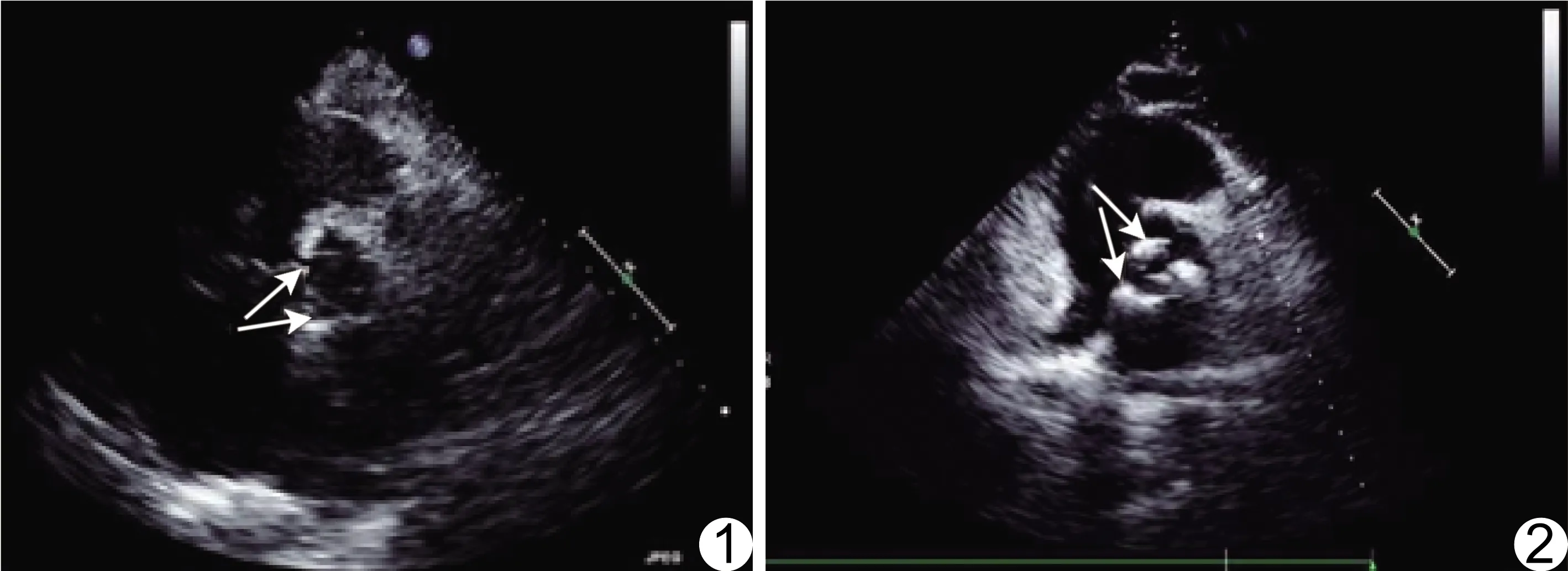
圖1 志愿者男,61歲 超聲心動圖未見主動脈瓣(箭)鈣化 圖2 患者女,64歲,CHD 超聲心動圖示主動脈瓣(箭)鈣化
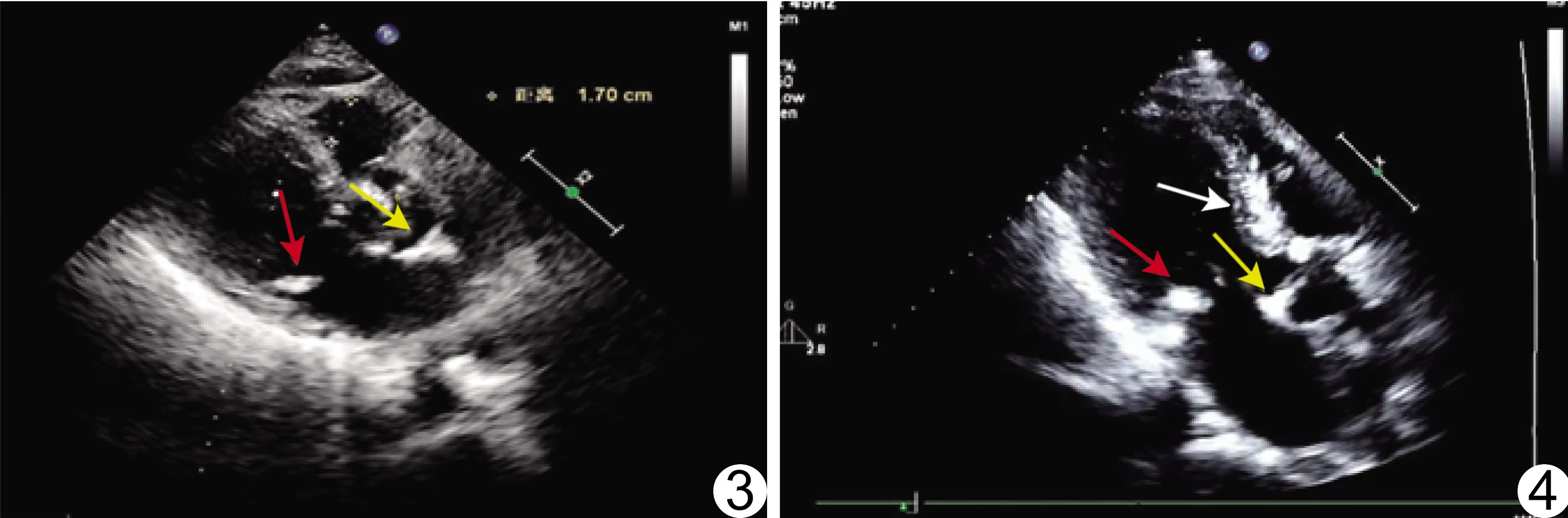
圖3 患者男,78歲,CHD 超聲心動圖示主動脈瓣(黃箭)和二尖瓣(紅箭)鈣化 圖4 患者男,76歲,CHD 超聲心動圖示主動脈瓣(黃箭)、二尖瓣(紅箭)及室間隔(白箭)鈣化
1.3 基本資料 記錄受試者體質量指數(body mass index,BMI)、血壓及病史和空腹血糖(fasting blood glucose,FBG)、Lp(a)、總膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)、LDL、載脂蛋白A(apolipoprotein A,ApoA)、載脂蛋白B(apolipoprotein B,ApoB)及肌酐(creatinine,Cr)檢測結果。
1.4 風險分層 以eCS為0分且Lp(a)<75 nmol/L為CHD低危,eCS≥1分或Lp(a)≥75 nmol/L為中危,eCS≥1分且Lp(a)≥75 nmol/L為高危。
1.5 統計學分析 采用SPSS 22.0統計分析軟件。以±s表示符合正態分布的計量資料,行t檢驗;以中位數(上下四分位數)表示不符合正態分布的計量資料,行秩和檢驗;以頻率表示計數資料,行χ2檢驗。采用Kendall秩相關分析評價eCS與冠狀動脈病變支數的相關性。以Logistic多因素回歸分析評價各指標與CHD的相關性。P<0.05為差異有統計學意義。
2 結果
2.1 基本資料 CHD組與對照組BMI、飲酒史、TC、TG、LDL及ApoB水平差異均無統計學意義(P均>0.05);性別、年齡、吸煙史、糖尿病史及高血壓史差異均有統計學意義(P均<0.05)。CHD組FBG、Lp(a)及Cr水平明顯高于對照組,ApoA及HDL水平明顯低于對照組(P均<0.05),見表1。
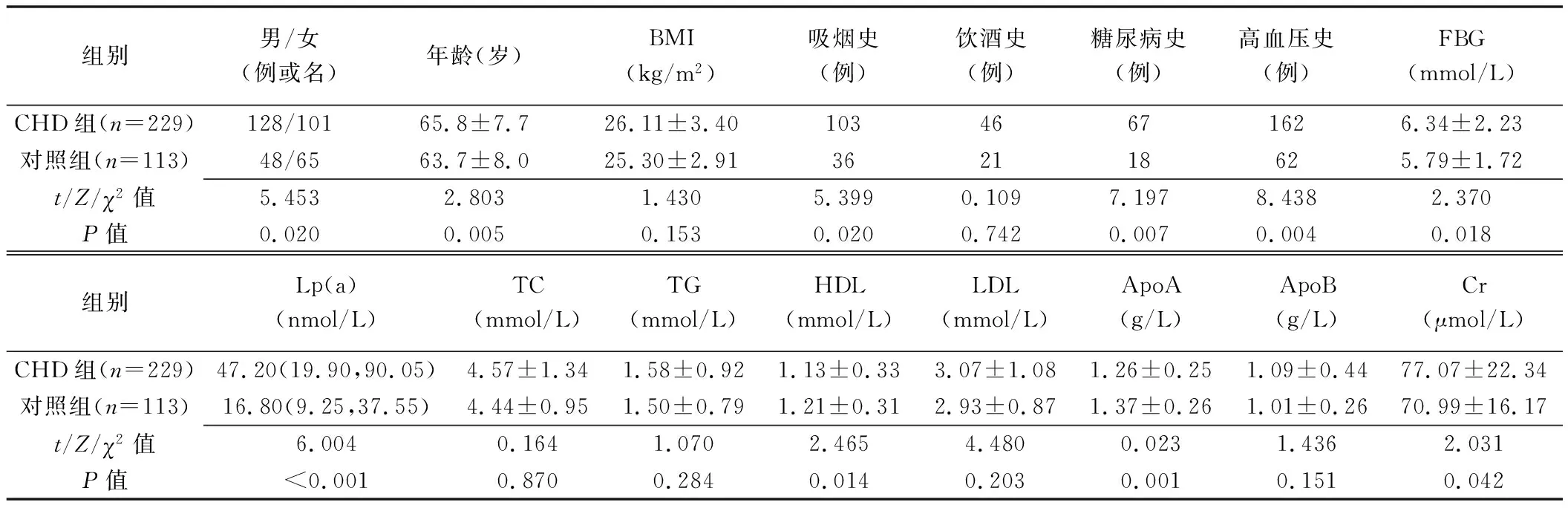
表1 CHD組與對照組基本資料比較
2.2 eCS與Lp(a)水平 CHD組76.86%(176/229)患者eCS≥1分,23.14%(53/229)為0分;對照組20.35%(23/113)受檢者eCS≥1分,79.65%(90/113)為0分;組間eCS差異具有統計學意義(χ2=96.391,P<0.001)。CHD各亞組與對照組eCS差異均有統計學意義(P均<0.05),見表2;eCS與冠狀動脈病變支數呈正相關(r=0.377,P<0.001)。CHD各亞組Lp(a)水平均明顯高于對照組(P均<0.05),雙支及三支亞組Lp(a)水平均明顯高于單支亞組(P均<0.05)。
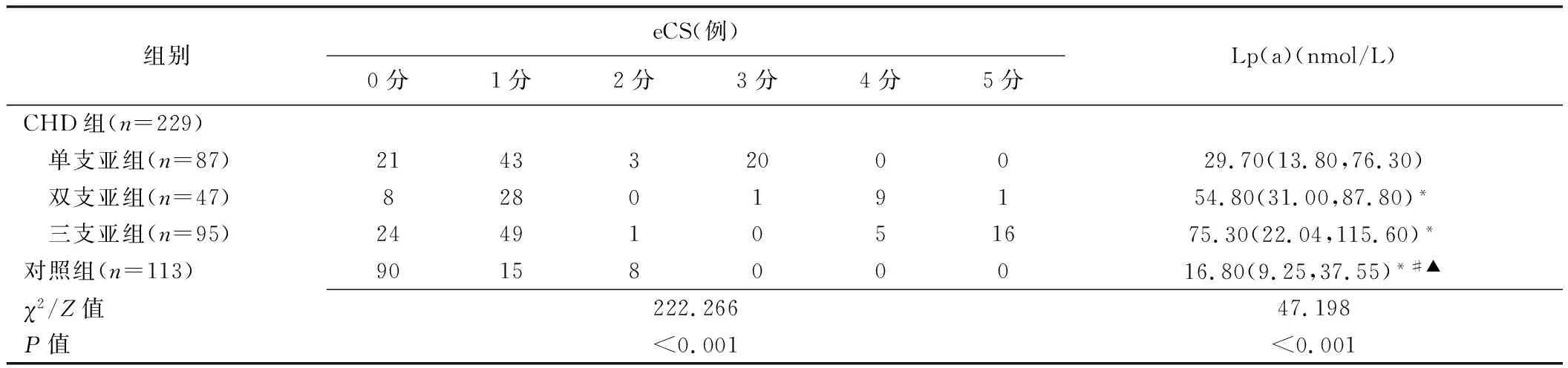
表2 CHD各亞組與對照組eCS比較
2.3 風險分層 CHD組17.03%(39/229)患者風險分層為低危,51.53%(118/229)為中危,31.44%(72/229)為高危;對照組69.03%(78/113)受檢者為低危,27.43%(31/113)為中危,3.54%(4/113)為高危;組間風險分層差異有統計學意義(χ2=96.384,P<0.001)。CHD組中危、高危患者占比明顯高于低危(χ2=56.993、71.090,P均<0.001),中危占比明顯高于高危(χ2=9.255,P=0.002)。
2.4 回歸分析 糖尿病史、eCS及Lp(a)水平均為CHD的獨立危險因素,糖尿病使患者CHD發病風險增加約2.018倍;存在eCS≥1分或Lp(a)≥75 nmol/L其中之一時,CHD風險增加約7.658倍;2個危險因素均存在時,CHD風險增加達36.970倍,見表3。
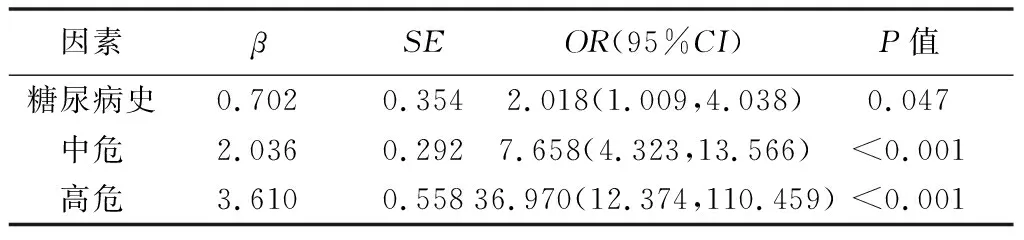
表3 CHD的多因素Logistic回歸分析
3 討論
心臟鈣化與動脈粥樣硬化的病理生理啟動階段機制相似,并共有多項相關生理軸而致纖維化、鈣化[3]。既往已有多項研究[4-5]探討心臟鈣化與CHD的相關性。心臟CT可直接診斷心臟鈣化,是目前的診斷標準,但費用高、存在輻射且無法進行床旁檢查等原因使其臨床應用受限。超聲心動圖操作簡便、易行且無創,各級醫院及機構均可開展,但目前采用的超聲心動圖評估心臟鈣化的標準不完全一致。本研究采用的eCS簡便易行,易于標準化并進行統一分析。GAIBAZZI等[6]指出,eCS評估CHD風險與心臟CT鈣化評分相似,可獨立預測發生CHD的風險,且預測價值高于其他臨床參數;本研究發現CHD組eCS≥1患者占比明顯高于對照組,支持上述觀點。
Lp(a)由脂蛋白及單分子ApoA組成,其水平主要與基因相關,幾乎不受飲食、運動、生活方式或藥物的影響,檢測結果的穩定性強。既往研究[7]證實,Lp(a)水平>75 nmol/L為CVD發生、發展的危險因素。編碼ApoA的LPA基因決定了環狀結構域IV2(kringle IV2,KIV2)在ApoA中出現相同的重復拷貝的數目不等[8],KIV2拷貝數越少則ApoA分子越小,越易于合成、分泌,使相應Lp(a)水平越高,導致CVD發病風險增高[9];但目前不同指南針對何種水平Lp(a)需給予干預或是否需要控制特定人群的Lp(a)水平尚未達成共識[10-11]。本研究基于Lp(a)和eCS進行風險分層,發現CHD組中危和高危患者占比明顯高于低危者,而eCS≥1分和(或)Lp(a)≥75 nmol/L均為CHD的危險因素,有助于實現早發現、早診斷及早治療CHD。
高危患者CHD發生率增高可能與心臟鈣化和動脈粥樣硬化啟動階段的病理生理機制相似以及脂質浸潤沉積于瓣膜及動脈內膜下有關。Lp(a)不易與LDL受體相結合,難以正常代謝;聚集于血管內的Lp(a)進入動脈壁或內皮下后更易被結合,并被巨噬細胞吞噬、降解而致膽固醇堆積[12],且Lp(a)與纖維蛋白和纖溶酶原相互作用,可抑制活化的纖溶酶降解纖維蛋白而促進血栓形成[13];另一方面,Lp(a)可與進入血管壁的氧化脂質結合,并造成氧化脂質蓄積,導致細胞代謝異常[14]。因此,患者同時出現Lp(a)升高與心臟鈣化提示Lp(a)已參與動脈粥樣硬化形成及炎癥鈣化,使其發生CHD的風險明顯升高。
綜上,eCS及Lp(a)水平是CHD的獨立危險因素,可作為篩查CHD的良好指標,且操作簡便,利于大規模篩查。但本研究樣本量較少,有待進一步從分子機制和基因角度評價CHD與Lp(a)及心臟瓣膜心肌組織鈣化之間的相關性,并深入探索其分子生物學機制。

