控制變量法在數字化實驗中的應用——以“影響化學反應速率的因素”為例
湖北省武昌實驗中學(430061) 唐 蘇
1 問題的提出
控制變量法早已滲透到物理、化學、生物等理科教學中,是探究實驗中不可或缺的認知成分。“影響化學反應速率的因素”一節中,人教版化學選修4教材中的3個實驗通過控制單一變量的方法分別研究了濃度、溫度、催化劑對化學反應速率的影響。3個實驗都是根據定性的實驗現象得出結論,但這樣的判斷因人而異,沒有定量的數據,實驗結果往往不太準確。而數字化實驗教學在繼承傳統實驗教學的基礎上,對其進行改進和補充,學生通過簡單的數據處理,能夠對數據背后隱藏的科學規律進行探究,從而有利于培養學生的科學素養。
2 實驗原理與設計
2.1 濃度對反應速率的影響
2.1.1 實驗反應方程式
5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O
2.1.2 實驗原理
古德貝格和瓦格于19世紀中期提出了基元反應的質量作用定律:基元反應速率與各反應物的濃度冪次方乘積成正比,各反應物濃度冪次方的指數等于化學方程式中對應物質的化學計量數。反應物的濃度越高,反應速率越快。
2.1.3 色度傳感器原理
色度傳感器用于測量有色溶液的透光率,相當于一臺簡易的分光光度計。通過對比透射光強度與發射光強度,可得到透光度。
本實驗中隨著反應的進行,酸性高錳酸鉀溶液的顏色會逐漸褪去,透射光強度逐漸增加,反應相同的時間,透光度變化值與反應速率成正比,可以據此確定反應速率的大小。
2.2 溫度對反應速率的影響
2.2.1 實驗反應方程式
Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+
H2O
2.2.2 實驗原理
大多數化學反應速率隨著溫度的升高而增加。范特霍夫曾總結出一條近似規律:溫度每升高10 K,反應速率變為原來的2~4倍。
2.2.3 濁度傳感器原理
濁度傳感器是用于測量液體的渾濁度或化學反應過程中生成的沉淀量,即液體中懸浮物的多少。
在本實驗中,隨著反應的進行,當生成硫的量不斷增加時,顆粒對光的散射增強,溶液的濁度值越大,由反應過程中溶液的濁度變化值可確定反應速率。
2.3 催化劑對反應速率的影響
2.3.1 實驗反應方程式
2.3.2 實驗原理
雙氧水在常溫常壓下可以緩慢地分解成氧氣和水,當它遇光、遇熱、遇大多數金屬氧化物和金屬陽離子時,會加速它的分解。
2.3.3 氧氣傳感器原理
氧氣傳感器利用陶瓷敏感元件測量氧電勢,由化學平衡原理計算出對應的氧濃度,工作原理與干電池相似,傳感器中的氧化鋯元素起類似電解液的作用。在一定條件下,利用氧化鋯內外兩側的氧濃度差,產生電位差,且濃度差越大,電位差越大。
在本次實驗中,氯化鐵作為催化劑時,催化效果好,試管中氧氣的濃度增加明顯;而硫酸銅作為催化劑時,催化效果差,氧氣產生速率慢,易形成空氣對流,導致相同規格的試管中氧氣濃度變化不大。因此,通過測定相同規格試管中氧氣濃度的變化,可以判斷催化劑效果的好壞。
3 實驗過程
3.1 儀器與藥品
朗威DISLab 6.5數據采集器、計算機、色度傳感器、濁度傳感器、氧氣傳感器、比色皿、試管、量筒、滴管、0.005 mol/L酸性KMnO4溶液、0.5 mol/L H2C2O4(草酸)溶液、1.0 mol/L H2C2O4(草酸)溶液、0.1 mol/L Na2S2O3溶液、0.1 mol/L H2SO4溶液、0.1 mol/L FeCl3溶液、0.1 mol/L CuSO4溶液、10% H2O2溶液。
3.2 實驗步驟
3.2.1 濃度對反應速率的影響
(1)如圖1所示連接各裝置,打開數據采集軟件。
我們對化合物1的熱性質進行了分析。從熱分析曲線可以看出,化合物表現為兩步失重,第一步,155-206℃,失重約為6.21%(理論值 7.5%),歸屬為3分子水的失去。第二步,在206到340℃ 范圍內失重約36.7%,相當于1個單純配體oba的失去,理論值為36.25%。

圖1 色度計實驗裝置
(2)色度計用蒸餾水和標準黑體校準。
(3)將2 mL 0.005 mol/L酸性KMnO4溶液和2 mL 0.5 mol/L H2C2O4(草酸)溶液在試管中混合后,倒入比色皿中并立即放入色度計內并記錄數據。
(4)將2 mL 0.005 mol/L酸性KMnO4溶液和2 mL 1.0 mol/L H2C2O4(草酸)溶液在試管中混合后,倒入比色皿中并立即放入色度計內并記錄數據。
3.2.2 溫度對反應速率的影響
(1)如圖2所示連接各裝置,打開數據采集軟件。

圖2 濁度計實驗裝置
(2)濁度計用蒸餾水和標準濁度液校準。
(3)將4 mL 0.1 mol/L Na2S2O3溶液、4 mL 0.1 mol/L H2SO4溶液分別等分為兩份,分別放在熱水(70 ℃)和冷水(25 ℃)中保溫。
(5)將放在冷水中的2 mL 0.1 mol/L Na2S2O3溶液和2 mL 0.1 mol/L H2SO4溶液在試管中混合后倒入比色皿中,立即放入濁度計內并記錄數據。
3.2.3 催化劑對反應速率的影響
(1)如圖3所示連接各裝置,打開數據采集軟件。

圖3 氧氣傳感器實驗裝置
(2)氧氣傳感器用空氣校準。
(3)取20 mL 10%雙氧水于試管中,加入3 mL 0.1 mol/L的FeCl3溶液混合,利用氧氣傳感器記錄數據。
(4)取20 mL 10%雙氧水于相同規格的試管中,加入3 mL 0.1 mol/L的CuSO4溶液混合,利用氧氣傳感器記錄數據。
4 實驗數據記錄與結果分析
4.1 濃度對反應速率的影響
將實驗數據在Excel中作圖,得到圖4。圖中a曲線表示2 mL 0.005 mol/L 酸性KMnO4溶液和2 mL 1.0 mol/L H2C2O4(草酸)溶液反應過程中透光率的變化。b曲線表示2 mL 0.005 mol/L 酸性KMnO4溶液和2 mL 0.5 mol/L H2C2O4(草酸)溶液反應過程中透光率的變化。由圖中的曲線可以清晰地看到草酸濃度為1.0 mol/L時,反應大概從100 s時開始發生,到350 s時,反應基本結束;草酸濃度為0.5 mol/L時,反應大概從200 s時開始發生,到600 s時,反應基本結束。同時還可以看到,a曲線的斜率明顯大于b曲線,也說明了a的反應速率比b要快。在相同條件下,草酸的濃度越大,反應越先開始,越快結束,也就意味著反應物濃度越大,反應速率越快。
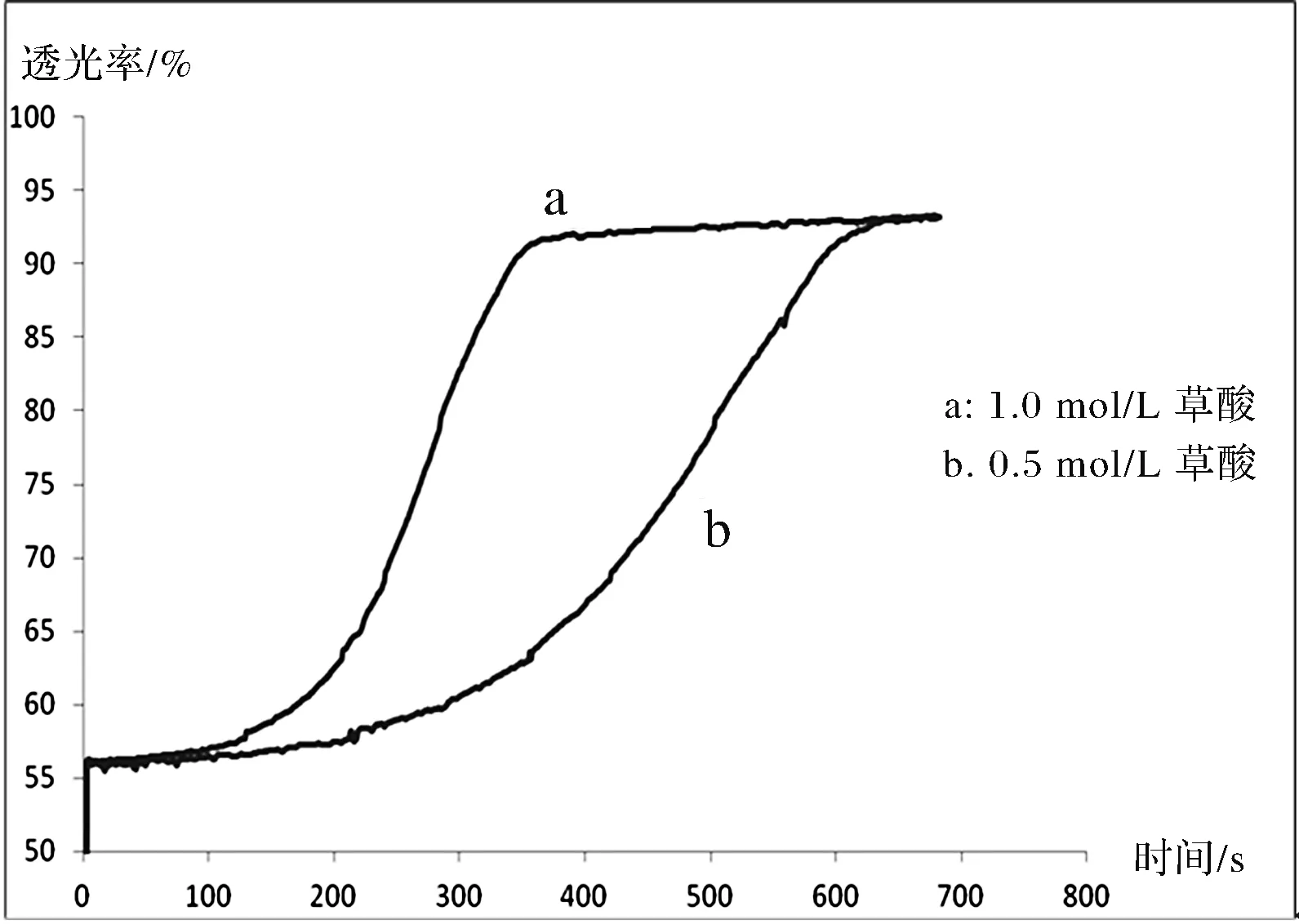
圖4 濃度對反應速率影響實驗圖像
4.2 溫度對反應速率的影響
將實驗數據在Excel中作圖,得到圖5。圖中a曲線表示在熱水中保溫的Na2S2O3溶液和H2SO4溶液混合后的濁度值。b曲線表示在冷水中保溫的Na2S2O3溶液和H2SO4溶液混合后的濁度值。由圖中曲線可以明顯看出在熱水中保溫的溶液一混合就開始反應,在90 s左右時反應結束,而在冷水中保溫的溶液在60 s左右時才開始有明顯反應,大概在500 s時反應結束。并且曲線a的斜率明顯大于曲線b,說明相同濃度、相同體積的Na2S2O3溶液和H2SO4溶液混合,溫度越高,反應速率越快。
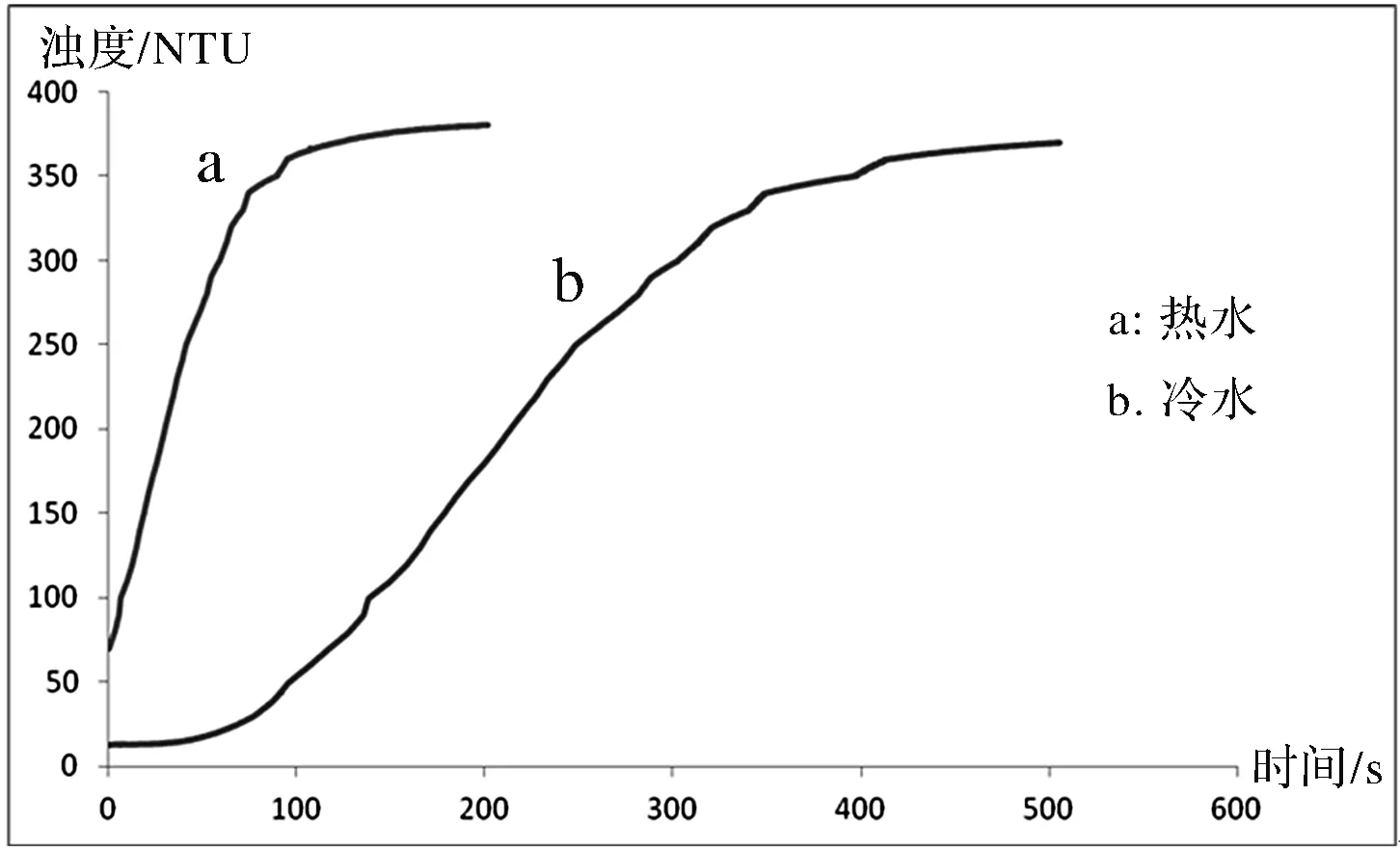
圖5 溫度對反應速率影響實驗圖像
4.3 催化劑對反應速率的影響
將實驗數據在Excel中作圖,得到圖6。圖中a曲線表示催化劑為0.1 mol/L FeCl3溶液時測定的氧氣濃度的變化。b曲線表示催化劑為0.1 mol/L CuSO4溶液時試管中氧氣濃度的變化。由圖6可看出FeCl3的催化效果明顯強于CuSO4。在其他條件均相同的條件下,FeCl3溶液作為催化劑,試管中氧氣的濃度最大可達到約80%,而CuSO4溶液作為催化劑時,試管中氧氣濃度最大僅約為24%。實驗數據說明,雙氧水在分解時,使用氯化鐵作為催化劑的效果要明顯優于硫酸銅溶液。
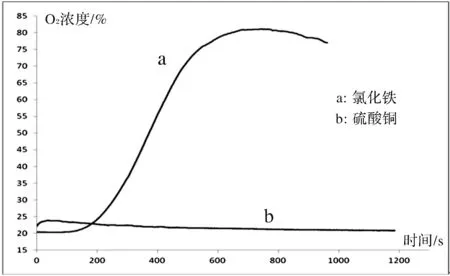
圖6 催化劑對反應速率影響實驗圖像
綜上所述,在其他條件相同的情況下,增大反應物的濃度反應速率增加,升高溫度反應速率增大,不同的催化劑對反應的催化效果不同。對于雙氧水來說,氯化鐵溶液的催化效果明顯優于硫酸銅溶液。
5 教學建議
本節課旨在培養學生對實驗數據和圖像的分析處理能力、實驗設計中控制變量的思想以及綜合設計實驗的能力,因此,筆者將3個實驗的順序做了一些調整,環節如下:
5.1 溫度對化學反應速率的影響
教師做完演示實驗之后,引導學生從以下幾個方面對實驗數據的圖像進行分析:①對圖像進行描述;②起始值不同說明了什么;③斜率表示什么含義,斜率不同又說明了什么問題;④終點值是否相同?
本環節旨在培養學生對實驗數據和圖像分析處理的能力。
5.2 濃度對化學反應速率的影響
教師可以先給出不同濃度的高錳酸鉀溶液、硫酸和草酸溶液,先讓學生分組自主設計實驗探究濃度對反應速率的影響,再對學生設計出的不同方案予以評價。如能否控制草酸或硫酸濃度?然后,根據最優的實驗方案操作實驗。最后,根據實驗圖像,計算不同濃度下的化學反應速率,復習前一課時的內容。
本環節旨在培養學生實驗探究中控制變量的能力以及定量計算的能力。
5.3 催化劑對化學反應速率的影響
向學生介紹氧氣傳感器,然后由學生自主設計、完成實驗,并對實驗圖像進行分析,從而得出結論。教師和學生共同對實驗進行評價,同時拓展能否使用其他傳感器(如壓強傳感器),哪個實驗方案更優(壓強傳感器對裝置氣密性要求較高,且產生的氣體過多時,壓強過大會導致膠塞噴出,實驗有一定風險)?
本環節旨在考查學生在實驗設計中控制變量的能力,以及培養學生綜合設計實驗的能力。

