D-D、PD-1/PD-L1、miR-16與肝癌經導管肝動脈化療栓塞術治療反應性的關系及預測術后復發的效能研究
朱 勇,魯正學,侯 婧
經導管肝動脈化療栓塞術(transcatheter arterial chemoembolization, TACE)可通過栓塞靶血管引起腫瘤組織缺血壞死,是肝癌重要的微創介入策略;但不同患者治療反應性不同,其中未獲緩解及治療后復發成為影響預后主要因素;因此準確評估肝癌TACE患者治療反應性,早期預測TACE后復發風險對指導臨床決策、調整治療方案等意義重大[1]。D-二聚體(D-D)在原發性肝癌患者中水平顯著高于健康對照者,并與預后有關[2-3]。程序性死亡受體-1(PD-1)/程序性死亡受體-配體1(PD-L1)及其介導的協同刺激信號參與機體免疫調控網絡,與肝癌癌細胞惡性生物學行為有關,可能參與了肝癌發病、進展[4-5]。微小RNA-16(miR-16)過表達能通過阻斷Wnt/β-catenin信號通路,抑制肝癌細胞的生長與侵襲[6]。目前關于D-D、PD-1/PD-L1、miR-16與肝癌TACE治療反應性的關系及聯合預測TACE后復發的報道鮮見,本研究對此進行探討,以期為臨床肝癌的治療和預后評估提供參考。
1 資料和方法
1.1臨床資料 選取2017年4月—2020年5月我院收治行TACE治療的169例肝癌為研究對象。納入標準:符合原發性肝癌診斷標準[7];行TACE治療者;肝功能Child-Pugh分級A或B級;TACE前無肝癌相關治療;患者知曉本研究,自愿簽署知情同意書。排除標準:白細胞<3×109/L;有出血傾向者;嚴重腹水者;門靜脈主干完全栓塞者;腎功能嚴重不全者;嚴重黃疸者;碘過敏者;急性感染者;血液系統疾病者;其他原發性惡性腫瘤者。本研究獲我院倫理委員會審核通過。TACE治療后完全緩解55例,部分緩解38例,穩定61例,進展15例。根據治療反應性分為緩解組93例和非緩解組76例。緩解組男50例,女43例;年齡(62.28±11.47)歲;病因:病毒性肝炎75例,酒精性肝炎12例,其他6例;肝功能Child-Pugh分級:A級79例,B級14例;并發癥:門靜脈高壓6例,輕度腹水4例;體質量指數(24.16±1.76)kg/m2;既往病史:高血壓病5例,糖尿病9例,冠心病4例;臨床分期:Ⅰ期2例,Ⅱ期59例,Ⅲ期32例。非緩解組男34例,女42例;年齡(65.09±10.56)歲;病因:病毒性肝炎66例,酒精性肝炎7例,其他3例;肝功能Child-Pugh分級:A級69例,B級7例;并發癥:門靜脈高壓1例,輕度腹水2例;體質量指數(23.97±2.41)kg/m2;既往病史:高血壓病2例,糖尿病4例,冠心病1例;臨床分期:Ⅰ期1例,Ⅱ期53例,Ⅲ期22例。2組性別、年齡、體質量指數等一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.2方法
1.2.1治療方法:所有患者均接受TACE微創介入治療。仰臥位,局部麻醉,Seldinger技術穿刺右股動脈,置入5F導管鞘,插5F RH肝管至肝總動脈實施造影,觀察腫瘤位置、數量、范圍、供血動脈,2.7F微導管選擇至供血動脈,注入化療藥物,將超液化碘油與表柔比星10~20 mg混合后栓塞腫瘤靶血管,待局部小門靜脈顯影或瘤體碘油沉積較密時停止注入,酌情加用吸收性明膠海綿或聚乙烯醇栓塞顆粒。之后給予保肝、護胃、能量支持、止吐等對癥處理,每個治療周期為4~6周,共治療2個周期。
1.2.2各指標檢測:TACE前采集所有患者外周血5 ml,采用免疫層析法檢測血漿D-D水平,采用流式細胞儀檢測CD4+、CD8+ T細胞表面PD-1、PD-L1水平,采用實時熒光定量聚合酶鏈式反應檢測血清miR-16水平。
1.2.3療效評估:完成治療周期后1個月,參考實體瘤療效評估標準[8]評估療效,完全緩解和部分緩解納入緩解組,穩定和進展納入非緩解組,并隨訪3個月統計復發情況。完全緩解復發標準是出現新的病灶,部分緩解、穩定復發標準是在TACE后出現新的進展。比較2組及復發、未復發患者D-D、PD-1/PD-L1通路指標、miR-16水平,分析D-D、CD8+PD-L1、miR-16水平與治療反應性相關性及復發的相關影響因素,并分析各指標預測復發效能。

2 結果
2.1緩解期與非緩解期組D-D、PD-1/PD-L1通路指標、miR-16水平比較 2組CD4+PD-1、CD8+ PD-1、CD4+ PD-L1水平比較差異無統計學意義(P>0.05)。緩解組CD8+ PD-L1、D-D低于非緩解組,miR-16高于非緩解組(P<0.05)。見表1。
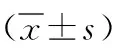
表1 緩解組與非緩解組原發性肝癌D-D、PD-1/PD-L1通路指標、miR-16比較
2.2D-D、CD8+ PD-L1、miR-16水平與治療反應性關系 D-D、CD8+ PD-L1水平與治療反應性呈負相關(r=-0.822、-0.742,P<0.01),miR-16水平與治療反應性呈正相關(r=0.716,P<0.01)。見圖1。

圖1 D-D、CD8+ PD-L1、miR-16與原發性肝癌治療反應的相關性分析
2.3復發與未復發患者D-D、PD-1/PD-L1通路指標、miR-16比較 由于TACE后病情進展患者無法評估復發與否,故不納入數據統計,僅納入完全緩解、部分緩解、穩定共154例。隨訪3個月3例失訪,將獲訪患者中復發22例為復發組,未復發129例為未復發組。與未復發組比較,復發組D-D、CD8+ PD-L1水平增高,miR-16水平降低(P<0.05)。見表2。

表2 復發與未復發原發性肝癌D-D、PD-1/PD-L1通路指標、miR-16水平比較
2.4原發性肝癌復發因素分析 以復發情況作為因變量,0=未復發,1=復發。納入D-D、CD8+ PD-L1、miR-16指標作為自變量,賦值分別為:D-D≤128.33 μg/L=1,>128.33 μg/L=2;CD8+ PD-L1≤31.18%=1,>31.18%=2;miR-16≤1.02=1,>1.02=2。參考各連續變量均值進行分層,將D-D、CD8+ PD-L1、miR-16轉化為二分類變量,應用非條件Logistic回歸方程分析,結果顯示D-D>128.33 μg/L、CD8+ PD-L1>31.18%、miR-16>1.02是原發性肝癌TACE后復發的危險因素(P<0.01)。見表3。

表3 影響原發性肝癌TACE治療后復發的多因素Logistic回歸分析
2.5D-D、CD8+ PD-L1、miR-16對復發的預測 以復發患者D-D、CD8+ PD-L1、miR-16為陽性樣本,以未復發患者D-D、CD8+ PD-L1、miR-16為陰性樣本,繪制各指標預測TACE后復發的ROC,結果顯示D-D、CD8+ PD-L1、miR-16預測原發性肝癌TACE后復發AUC依次為0.774、0.842、0.831;采用SPSS軟件聯合應用ROC理論模式(LogP模式:對各單獨應用指標進行綜合回歸,建立Logistic預測評估模型),結果顯示D-D、CD8+ PD-L1、miR-16三者聯合預測TACE后復發的AUC為0.931。見圖2、表5。

表5 D-D、CD8+ PD-L1、miR-16水平對原發性肝癌TACE治療后復發的預測

圖2 D-D、CD8+ PD-L1、miR-16對原發性肝癌TACE治療后復發的預測ROC曲線
3 討論
目前評估原發性肝癌TACE治療反應性及TACE后復發的方法較少。D-D是纖維蛋白經過活化和水解產生的特異性降解產物之一,可用于評估機體是否存在高凝狀態和繼發性纖維蛋白溶解亢進[9]。既往資料顯示,肝癌介入治療前D-D高于健康體檢者,且介入治療后有效者D-D降低,并低于無效者[10]。本研究結果顯示,緩解組D-D低于非緩解組,且D-D與原發性肝癌治療反應性呈負相關,提示D-D與原發性肝癌TACE治療反應性有關,D-D水平較低患者從TACE治療中獲益的可能性較大。惡性腫瘤患者血漿D-D水平升高,與腫瘤細胞表達促凝活性物質和腫瘤細胞釋放一些細胞因子,激活了血小板、單核細胞、血管內皮細胞,使凝血功能增強有關;且腫瘤細胞合成纖溶酶原激活物,作用于纖溶酶原,從而導致D-D水平升高[11-12]。D-D水平越高,肝癌病情越嚴重,TACE根治性難度越大,因此檢測D-D可評估TACE治療反應性。本研究結果顯示,復發組D-D高于未復發組,檢測D-D預測原發性肝癌TACE后復發的AUC為0.774,提示進行D-D檢測可指導臨床針對性干預,改善預后。
TACE為經導管肝動脈化療栓塞術,PD-L1為程序性死亡受體-配體1,D-D為D-二聚體,miR-16為微小RNA-16,ROC為受試者工作特征
腫瘤細胞免疫逃逸和異常細胞信號通路參與了原發性肝癌的發病[13-14]。CD8+ T淋巴細胞被誘導凋亡是腫瘤免疫逃逸的一個重要機制[15]。PD-1/PD-L1是細胞免疫信號傳導通路中的信息分子,能通過耦聯結合誘導CD8+ T淋巴細胞凋亡,促進腫瘤免疫逃逸[16]。本研究結果顯示,緩解組CD8+ PD-L1低于非緩解組,與程小珍等[17]報道相似,提示CD8+ PD-L1與TACE療效有關。PD-1與PD-L1作用后,可抑制T細胞的增殖和活化,抑制機體對腫瘤細胞的免疫應答,CD8+ PD-L1水平較高患者,腫瘤細胞能逃離宿主的免疫監視和殺傷,呈現出更強的增殖性,因此PD-1/PD-L1成為近年來腫瘤領域研究的熱點。本研究結果同時顯示,CD8+ PD-L1與原發性肝癌TACE治療反應性、復發有關,可見阻斷PD-1/PD-L1信號通路,可促進機體對腫瘤的免疫監視和殺傷,可能有利于原發性肝癌TACE療效和預后的改善,有望成為新型、有效的靶分子。CD8+ PD-L1預測TACE后復發的AUC為0.842,當CD8+ PD-L1>39.36%時,有足夠的陽性證據預測復發,故應進一步加強監測隨訪和綜合干預。
miR-16定位人染色體13q14上,可促進腫瘤細胞凋亡,該基因區域的缺失與肝癌等多種實體腫瘤發病有關[18]。目前關于miR-16與肝癌TACE治療反應性、復發關系的報道鮮見。本研究結果顯示,緩解組miR-16水平高于非緩解組,與治療反應性呈正相關,表明TACE治療前,miR-16水平越高,原發性肝癌患者從TACE獲益可能性越大。核因子-κB是miR-16的靶基因之一,而抑制核因子-κB已被證實與肝癌的轉移和侵襲有關,故miR-16可能是通過調控核因子-κB影響原發性肝癌TACE后治療反應性和復發的[19-21];但缺乏更多相似報道的論證,這一結論及miR-16影響原發性肝癌TACE治療反應性是否還有其他機制,仍需后續的進一步驗證。同時復發組miR-16低于未復發組,且miR-16預測復發的AUC為0.831,呈現出一定應用價值,能為臨床預測TACE后復發提供客觀數據參考。
綜上所述,D-D、PD-1/PD-L1、miR-16與原發性肝癌TACE治療反應性及TACE后復發有關,當D-D>153.38 μg/L、CD8+ PD-L1>39.36%、miR-16≤0.91時,能為臨床預測原發性肝癌TACE后復發提供客觀、量化的數據。

