吡非尼酮通過抑制NLRP3-ASC-IL-1β通路改善大鼠腎缺血再灌注引起的急性腎損傷
馮志鵬,許 俊,姜先洋,王蔭琪,張 勇,馬 燕,龍曉娜,王 露,吳靈培,彭紅英
急性腎損傷(acute kidney injury, AKI)是一種以腎損害為特征,腎功能迅速下降的內(nèi)科疾病,具有較高的發(fā)病率和病死率[1];缺血、膿毒癥和碘化造影劑的使用等眾多因素均有可能導致AKI[2]。目前仍無明確的干預措施被證明能有效地阻斷或延緩AKI[3]。因此,迫切需要開發(fā)新的治療方法來改善AKI患者的生存質(zhì)量。吡非尼酮(PFD)是口服的吡啶酮類似物[4]。研究表明,PFD具有抑制炎癥的功能,可顯著降低糖尿病腎病小鼠模型腎臟中巨噬細胞的浸潤,抑制腎小球系膜基質(zhì)擴張,修復腎功能[5]。已有研究表明,炎癥相關(guān)指標單核細胞趨化蛋白-1(MCP-1)和白細胞介素-1β(IL-1β)與腎損傷密切相關(guān)[6-7]。MCP-1介導的急性缺血和中毒性腎臟損傷,是炎癥反應的敏感指標[8]。IL-1β是一種多效促炎因子,可由核苷酸結(jié)合寡聚化結(jié)構(gòu)域樣受體蛋白3(NLRP3)炎性小體激活后調(diào)控。具體機制為NLRP3炎性小體可激活促進Caspase-1與凋亡相關(guān)斑點樣蛋白(ASC)相互作用,啟動炎性小體的形成,進而將IL-1β前體剪切成具有活性的IL-1β[9]。最新研究發(fā)現(xiàn),PFD抗炎機制與炎性小體途徑密切相關(guān),PFD通過抑制NLRP3炎性小體,阻止高血壓誘發(fā)的心肌纖維化[10]。因此,本研究擬在大鼠腎缺血再灌注-AKI模型中,探究PFD是否能抑制NLRP3炎癥相關(guān)通路,降低炎癥反應對腎臟產(chǎn)生保護作用。
1 材料與方法
1.1實驗動物及分組 清潔級健康成年SD大鼠36只,體質(zhì)量250~280 g,分籠飼養(yǎng)于室溫24℃、相對濕度為(35~65)%,光照周期為12 h/12 h的房間,適應性飼養(yǎng)1周。
1.2實驗試劑 PFD(Pirfenex,西普拉)、MCP-1酶聯(lián)免疫吸附試驗(ELISA)試劑盒(BMS631INST,ThermoFisher)、IL-1β ELISA試劑盒(ab241144)、小鼠抗β-actin(ab6276,Abcam)、兔抗NLRP3(ab263899,Abcam)、小鼠抗ASC(sc-514414,Santa Cruz)、兔抗IL-1β(ab205924,Abcam),大鼠尿素、肌酐ELISA檢測試劑盒(JL21202-96T,江萊生物),蘇木素、伊紅染色液(4960111、4960211,達科為)。
1.3方法
1.3.1分組及AKI模型制備:按照隨機數(shù)字表法將大鼠分為對照組、模型組、治療組,每組12只。參考文獻[11]的方法制備模型:腹腔注射戊巴比妥(50 mg/kg)麻醉大鼠,打開腹腔,暴露右側(cè)腎臟,鈍性分離腎包膜,游離右側(cè)腎動、靜脈、腎上腺、輸尿管及腎上腺動脈,結(jié)扎后切除右側(cè)腎臟。游離左側(cè)腎臟;以同樣方法暴露左側(cè)腎臟并游離左側(cè)腎動、靜脈,用無創(chuàng)血管夾夾閉左側(cè)腎動脈60 min,觀察腎臟顏色變化,60 min后移去動脈血管夾,恢復左側(cè)腎動脈血供。觀察左側(cè)腎臟,如果立即出現(xiàn)花斑狀,從暗黑色或紫黑色轉(zhuǎn)為鮮紅色則說明腎缺血再灌注造模成功,記錄再灌注時間。按每100 g腹腔注射青霉素4萬單位和布比卡因2.5 g/L麻醉和鎮(zhèn)痛。對照組只行麻醉、開腹、切除右側(cè)腎臟,但不阻斷左側(cè)腎臟血流。治療組大鼠造模前給予PFD 200 mg/kg灌胃,1/d,持續(xù)1周,隨后制備腎缺血再灌注-AKI模型,并于造模后24 h取材檢測。模型組與對照組給予等量生理鹽水灌胃,1/d。剔除造模失敗大鼠,每組取8只。
1.3.2大鼠腎臟病理形態(tài):處死小鼠并獲得腎臟組織,將其立即放入10%甲醛緩沖液中固定24 h,并包埋在石蠟中。將組織切成5 μm切片,行蘇木素伊紅(HE)染色。腎臟病理評分參照Paller評分標準[12]:0分為形態(tài)正常;1分為腎小管擴張;2分為細胞管型;細胞脫落或壞死,1分;上皮細胞核固縮、空泡狀或顆粒狀,1分。
1.3.3腎功能及炎性因子:收集大鼠血清,采用ELISA檢測試劑盒檢測尿素、肌酐、MCP-1和IL-1β含量,步驟參照說明書實施。
1.3.4qRT-PCR測定腎組織IL-1β和MCP-1 mRNA:采用Trizol試劑提取腎臟組織中RNA。逆轉(zhuǎn)錄為cDNA,反向轉(zhuǎn)錄參數(shù)如下:95℃預變性20 s,60℃退火20 s,72℃延伸20 s,40個循環(huán)。以β-actin作為內(nèi)參基因,MCP-1和IL-1β 轉(zhuǎn)錄水平采用2-ΔΔCt計算。實驗重復3次,取平均值。引物序列見表1。
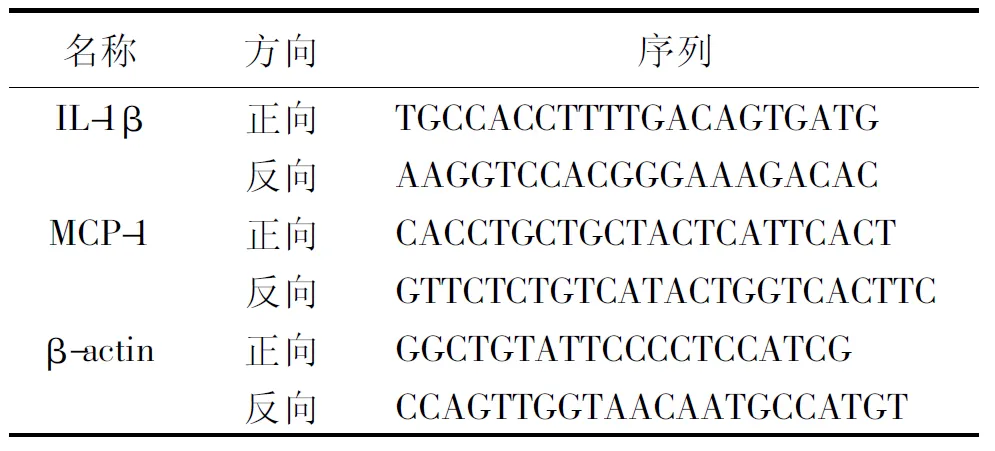
表1 MCP-1和IL-1β引物序列
1.3.5蛋白免疫印跡:使用RIPA從腎臟中提取總蛋白。經(jīng)變性處理后,將等量的蛋白質(zhì)(25 μg)加載到SDS-PAGE上,并轉(zhuǎn)移到PVDF膜上,然后將膜用5%脫脂奶粉封閉,加入一抗(稀釋比例為抗β-actin 1∶3000,抗NLRP3 1∶1000,抗ASC 1∶500,抗IL-1β 1∶1000)4℃孵育過夜,TBST清洗3次;二抗孵育1 h,TBST清洗3次;顯色后成像系統(tǒng)顯影,采集圖片。

2 結(jié)果
2.1PFD對腎組織病理形態(tài)學的影響 對照組大鼠腎臟組織結(jié)構(gòu)完整,腎小球、皮髓交界處的腎小管以及髓質(zhì)處的腎小管都清晰可見。模型組大鼠腎臟可見腎髓質(zhì)高度充血,細胞核固縮、溶解、消失,腎外髓質(zhì)大部分腎小管上皮細胞壞死脫落,遠端腎小管及集合管內(nèi)可見細胞管型。治療組大鼠腎臟損傷較模型組減輕。見圖1。與對照組比較,模型組大鼠腎臟損傷評分顯著升高(P<0.01);與模型組比較,治療組腎臟損傷評分顯著下降(P<0.05)。見圖2。
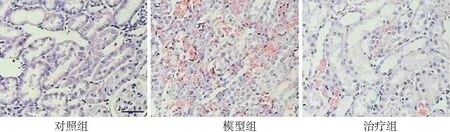
圖1 3組大鼠腎臟病理結(jié)構(gòu)圖(HE,標尺為50 μm)
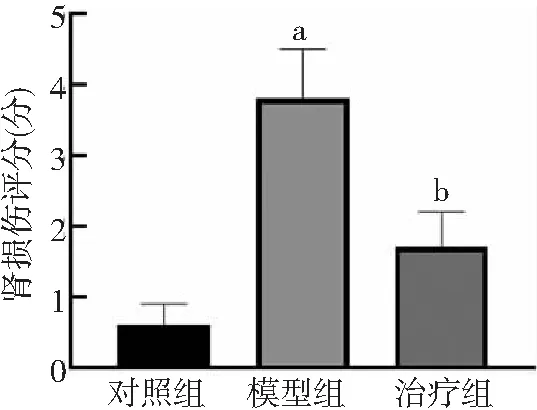
圖2 3組大鼠腎損傷病理評分情況
2.2PFD對腎功能的保護作用 與對照組比較,模型組大鼠血清中尿素和肌酐顯著升高(P<0.01)。與模型組比較,治療組大鼠血清中尿素和肌酐含量下降(P<0.05,P<0.01)。見圖3。
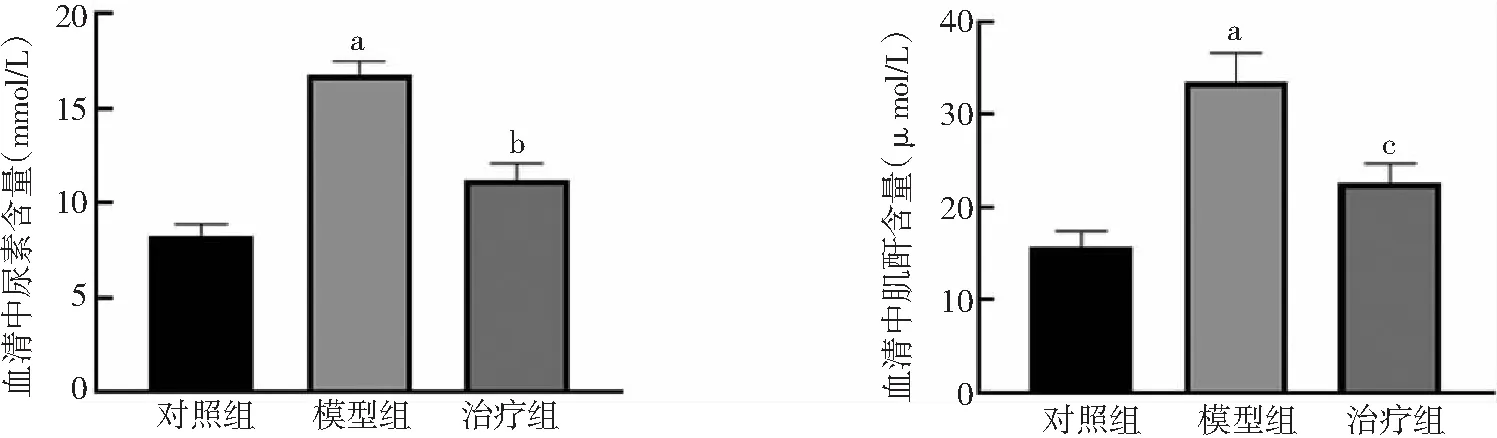
圖3 3組大鼠血清中尿素和肌酐含量比較
2.3PFD對血清MCP-1和IL-1β含量的影響 與對照組比較,模型組大鼠血清中MCP-1和IL-1β含量顯著增高(P<0.01);與模型組比較,治療組大鼠血清MCP-1和IL-1β含量顯著下降(P<0.01)。見圖4。

圖4 3組大鼠血清中MCP-1和IL-1β含量比較
2.4PFD對腎組織MCP-1和IL-1β mRNA轉(zhuǎn)錄的影響 與對照組比較,模型組大鼠腎臟MCP-1和IL-1β mRNA相對表達量顯著升高(P<0.01);與模型組比較,治療組大鼠腎臟MCP-1和IL-1β mRNA相對表達量顯著下降(P<0.01)。見圖5。

圖5 3組大鼠腎臟MCP-1和IL-1β mRNA相對表達量比較
2.5PFD對腎臟NLRP3、ASC和IL-1β表達量的影響 與對照組比較,模型組大鼠腎臟NLRP3、ASC和IL-1β蛋白相對表達量顯著升高(P<0.01);與模型組比較,治療組大鼠腎臟NLRP3、ASC和IL-1β蛋白相對表達量顯著下降(P<0.05,P<0.01)。見圖6。
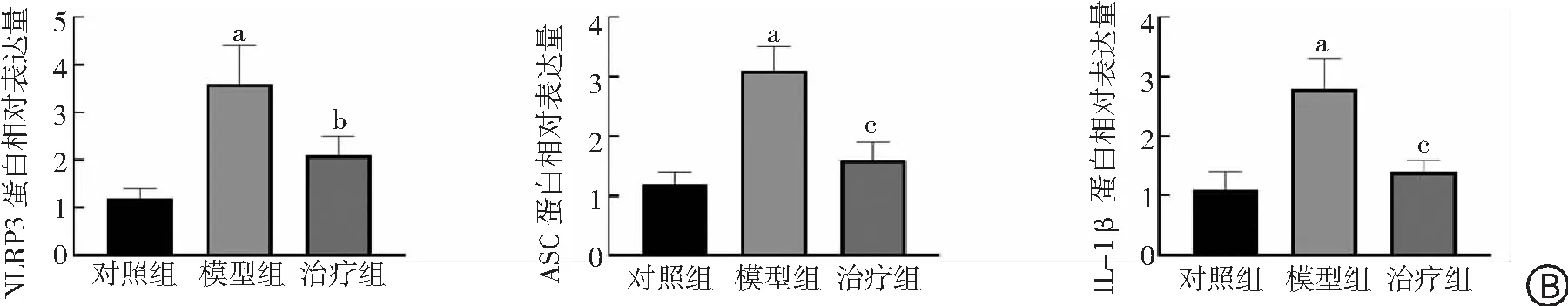
圖6 3組大鼠腎臟NLRP3、ASC和IL-1β蛋白表達量比較
3 討論
AKI臨床特征是腎功能突然下降,表現(xiàn)為廢物排泄減少、電解質(zhì)紊亂和體液內(nèi)環(huán)境平衡紊亂,診斷特征為代謝廢物尿素和(或)血肌酐含量升高[13-14]。AKI目前尚無明確的治療方法,因此早期發(fā)現(xiàn)和及時治療尤為重要[15]。缺血再灌注損傷、毒素直接作用、炎性介質(zhì)、免疫反應和細胞凋亡等因素都參與了AKI的發(fā)病過程[16]。研究表明,缺血再灌注時,缺血缺氧促進了腫瘤壞死因子-α、IL-6等炎性介質(zhì)及細胞因子的釋放[17]。在膿毒癥誘導的AKI中,模型組小鼠腎臟組織中Caspase-1的表達和活性增加,血清C反應蛋白(CRP)和腎臟中IL-1β、IL-18含量升高[18]。此外,在順鉑引起的AKI模型中,血清尿素、肌酐、尿白蛋白/肌酐增加,腎臟中IL-1β、IL-6蛋白表達量升高,MCP-1 mRNA轉(zhuǎn)錄水平升高[19]。

本研究結(jié)果顯示,與對照組比較,模型組大鼠血清尿素和肌酐、MCP-1和IL-1β含量、腎損傷病理評分顯著增加;與模型組比較,治療組大鼠血清尿素和肌酐、MCP-1和IL-1β含量、腎損傷病理評分顯著減低。與既往文獻報道一致[20]。
NLRP3激活后可促進Caspase-1與ASC相互作用,啟動炎性小體的形成,ASC通過招募和激活 Caspase-1前體來生成具有活性的 Caspase-1。Caspase-1是IL-1β的轉(zhuǎn)化酶,將IL-1β前體剪切成具有活性的IL-1β[9]。因此,IL-1β是一種由NLRP3炎性小體激活后調(diào)控的多效促炎因子。MCP-1是單核細胞/巨噬細胞的特異趨化因子,能趨化和激活單核細胞至炎癥部位;同時可參與炎癥反應和調(diào)節(jié)免疫;還可調(diào)節(jié)單核細胞表面黏附分子的表達,促進細胞因子如IL-1和IL-12的分泌[20]。PFD目前已被美國食品藥品管理局批準用于治療特發(fā)性肺纖維化和減緩肺功能下降[4]。最新研究發(fā)現(xiàn),PFD可通過抑制氧化應激、巨噬細胞浸潤和炎癥依賴的NLRP3途徑誘導的炎癥反應,有效地減輕慶大霉素誘導的AKI[21]。本研究結(jié)果顯示,與對照組比較,模型組大鼠血清MCP-1和IL-1β mRNA表達量,NLRP3、ASC和IL-1β蛋白相對表達量均增加;與模型組比較,治療組大鼠血清MCP-1、IL-1β mRNA表達量,NLRP3、ASC和IL-1β蛋白相對表達量均降低。說明腎臟缺血再灌注可促進炎性介質(zhì)如IL-1β的大量釋放;此外,腎組織中MCP-1含量升高,可進一步趨化和激活單核細胞至炎癥部位加重腎損傷;而PFD可通過抑制NLRP3-ASC-IL-1β信號通路,降低NLRP3、ACS和IL-1β 蛋白表達量,降低MCP-1和IL-1β的轉(zhuǎn)錄和翻譯;從而降低血清中MCP-1和IL-1β的含量,對腎臟產(chǎn)生保護作用,最終可降低尿素和肌酐含量。
綜上所述,PFD可有效緩解腎缺血再灌注引起的腎損傷,其保護機制與抑制NLRP3-ASC-IL-1β炎癥信號通路有關(guān)。AKI發(fā)病機制復雜,并非是單一因素導致的疾病,本研究僅以缺血再灌注模型模擬AKI存在一定的局限性。此外,PFD對NLRP3-ASC-IL-1β信號通路的影響仍需在AKI的其他模型中進一步深入研究。

