超高效液相色譜-串聯質譜法測定雞組織中利巴韋林殘留
◎ 馬 凱,楊春萍,楊昌彪,黃永橋,吳新文
(1.貴州省分析測試研究院,貴州 貴陽 550000;2.貴州省檢測技術研究應用中心,貴州 貴陽 550000)
利巴韋林又名病毒唑、三氮唑核苷、尼斯可等[1],是廣譜強效的抗病毒藥物,在人類流感類疾病防治領域應用廣泛,但部分養殖戶將其違規用于畜禽疫病防治,若長期大量使用會導致流感病毒變異,為動物疫病甚至人類流感類疫病的防治帶來不確定性。此外,畜禽食品中藥物的殘留會通過食物鏈進入人體,長期累積后會產生神經毒性,直接誘導人類流感病毒產生變異及耐藥性增強,威脅到人類健康。美國食品藥品管理局(FDA)于2005年開始禁止利巴韋林等抗病毒藥物用于畜禽類養殖;我國農業部公告第560號中將利巴韋林列入了獸藥禁止使用的范疇[2],2021年利巴韋林成為國家食品安全監督抽檢的重要項目。
目前,利巴韋林的檢測方法有放射免疫法[3]、高效液相色譜法[4]、氣相色譜-質譜法[5]、液相色譜-質譜法[6-8]等,其中液相色譜-串聯質譜法靈敏度高,選擇性好,驗證性能可靠,是測定該藥物殘留的理想方法。本研究采用超高效液相色譜-串聯質譜法((UPLC-MS/MS)測定雞組織中利巴韋林殘留量,并對前處理方法和儀器分析條件進行優化,為禽類養殖業中利巴韋林殘留量的監控提供技術支持。
1 材料與方法
1.1 儀器與設備
Agilent 1290/6460超高效液相色譜-串聯質譜儀(美國安捷倫公司)、GZ-250S恒溫培養箱(韶關市廣智科技設備發展有限公司)、HT150R型高速冷凍離心機(長沙湘儀離心機儀器有限公司)、UMV-2多管旋渦混合器(北京普立泰科儀器有限公司)、Milli-Q實驗室超純水制備系統(美國Millipore公司)、SHB-Ⅲ型真空泵(鄭州長城科工貿有限公司)、PHS-3C型pH計(上海儀電科學儀器股份有限公司)、瓶口分液器(德國普蘭德公司)、12管固相萃取裝置(美國SUPELCO公司)、XW-80A型旋渦混合器(蘇州江東精密儀器有限公司)、電子天平(精確到0.01 g,常熟市雙杰測試儀器廠)、移液器(規格10~100 μL、100~1 000 μL、1~5 mL,大龍興創實驗儀器有限公司)。
1.2 材料與試劑
乙腈(色譜純,德國Merck公司)、甲酸(色譜純,上海安譜實驗科技股份有限公司)、乙酸銨(優級純,山東西亞化學股份有限公司)、三氯乙酸(分析純,成都市科龍化工試劑廠)。
酸性磷酸酶(來源于小麥胚芽,≥0.4 U·mg-1,上海安譜實驗科技股份有限公司);CNWBOND PBA SPE小柱(100 mg/3 mL,上海安譜實驗科技股份有限公司);0.22 μm有機微孔濾膜(上海安譜實驗科技股份有限公司);100 μg·mL-1利巴韋林標準溶液, 100 μg·mL-1利巴韋林-13C5標準溶液(天津阿爾塔科技有限公司)。
標準儲備液的配制:準確移取利巴韋林和利巴韋林-13C5標準溶液,用甲醇定容至10 mL,分別配制成濃度為10 μg·mL-1的標準儲備溶液,4 ℃避光可保存 3個月。
標準中間液的配制:分別移取利巴韋林和利巴韋林-13C5標準溶液,用甲醇定容至10 mL,分別配制成濃度為100 ng·mL-1的標準中間溶液,4 ℃避光可保 存1周。
乙酸銨溶液(pH4.8):稱取乙酸銨154.0 g,加水約950 mL溶解,用乙酸調pH至4.8±0.1,加水定容至1 000 mL。
乙酸銨溶液(pH8.5):稱取乙酸銨18.12 g,加水約950 mL溶解,用氨水調pH至8.5±0.1,加水定容至1 000 mL。
三氯乙酸溶液(20 g·L-1):稱取20 g三氯乙酸,加水約950 mL溶解,用氨水調pH至4.8±0.1,加水定容至1 000 mL。
1.3 實驗條件
1.3.1 色譜條件
色譜柱:Agilent Poroshell 120 SB-Aq,2.1 mm× 150 mm,2.7 μm;流動相:A為0.1%甲酸水溶液(含2 mmol·L-1乙酸銨),B為乙腈;流速0.5 mL·min-1;柱溫40 ℃;進樣量2 μL;梯度洗脫程序:0~1min(2%B),1~2 min(2%~15%B),2~3 min (15%~50%B),3~4 min(50%~95%B),4~6.5 min (95%B);后運行時間:3 min。
1.3.2 質譜條件
電噴霧離子源(ESI),多反應監測模式(MRM),正離子掃描,毛細管電壓4 000 V,噴嘴電壓500 V,霧化氣壓力40 psi,干燥氣溫度350 ℃,干燥氣流速 8 L·min-1,鞘氣溫度300 ℃,鞘氣流速10 L·min-1,Delta EMV值為500,利巴韋林和利巴韋林-13C5定性、定量離子、錐孔電壓、碰撞能量等參數見表1。

表1 目標物的保留時間及質譜參數表
1.3.3 樣品前處理
(1)樣品制備。雞肉、肝臟、腎臟等放入組織搗碎機中充分搗碎混勻,均分成兩份,分別裝入潔凈容器作為試樣,密封,并標明標記,將試樣置于-18 ℃冷凍避光保存。雞蛋樣品中取出有代表性樣品約500 g,去殼后用組織搗碎機攪拌充分混勻,均分成兩份,分別裝入潔凈容器作為試樣,密封,并標明標記,將試樣置于4 ℃冷藏避光保存。
(2)提取。準確稱取樣品5 g(精確到0.01 g),置于50 mL具蓋的離心管中,添加100 μL內標標準工作溶液,再加入10 mL乙酸銨緩沖溶液(pH4.8)和100 μL酸性磷酸酶溶液,加入1粒陶瓷均質子,于多管旋渦混合器充分提取5 min,然后將樣品置于37 ℃恒溫培養箱中避光酶解2 h,在酶解液中加入8 mL三氯乙酸溶液,渦旋30 s,4 ℃條件下8 000 r·min-1離心5 min,收集上清液于另一離心管中,用20%氨水調pH至8.5±0.1,加水定容至25 mL,混勻,4 000 r·min-1離心5 min,待凈化。
(3)凈化。取PBA固相萃取小柱,預先以3 mL乙腈,3 mL 1%甲酸水,3 mL乙酸銨溶液(pH8.5)活化,取5 mL樣品提取液過柱,控制流速小于3 mL·min-1, 依次用3 mL乙酸銨溶液(pH8.5),3 mL水淋洗, 3 mL5%氨水甲醇淋洗,真空抽干2~3 min,以2.0 mL 0.5%甲酸水洗脫,擠干小柱,收集洗脫液,加洗脫液定容至2 mL,旋渦混勻后,過0.22 μm微孔濾膜,使用UPLC/MS/MS進行分析。
1.4 數據處理
采用內標法,結合Agilent MassHunter工作站配置軟件,以定量離子的響應峰面積對應質量濃度作出標準曲線,對測定結果進行定量分析。
2 結果與分析
2.1 質譜條件的優化
利巴韋林的分子結構中含有酰胺結構,在正離子模式下能得到較好的分子離子峰[M+H]+,因此質譜方法采用電噴霧正離子模式進行掃描。配制100.0 ng·mL-1利巴韋林和利巴韋林-13C5混合標準溶液,聯機液相色譜,對其進行碰撞解離,通過子離子掃描,得到利巴韋林碎片離子信息,對錐孔電壓、碰撞能量、鞘氣溫度和流量、干燥氣溫度和流量、霧化器壓力、毛細管電壓等參數進行優化,選擇響應較好的特征離子作為定性定量離子,優化后參數見1.3.2。
2.2 液相色譜條件的選擇
利巴韋林極性較強,在反相色譜柱上幾乎無保留,目前色譜分析方法大多采用親水色譜(HILIC)柱以改善利巴韋林的保留情況。此外,根據已發表的相關研究[9-10],雞組織樣品中含有一種與利巴韋林相似的物質,且具有相同的子離子片段,影響目標物的含量測定,需要優化色譜條件,實現有效分離。本研究選取了含有薄殼型填料顆粒的Agilent Poroshell 120 SB-Aq色譜柱,在100%水相流動相條件下起始,按照1.3.1的色譜條件進行梯度洗脫,色譜圖如圖1所示。選用Agilent Poroshell 120 SB-Aq色譜柱可改善利巴韋林在色譜柱上的保留狀況,實現干擾物與利巴韋林的基線分離,避免定性定量的干擾;因采用正離子模式進行掃描,在水相中添加了甲酸和乙酸銨,可促進離子化效率,并改善目標物的峰形。
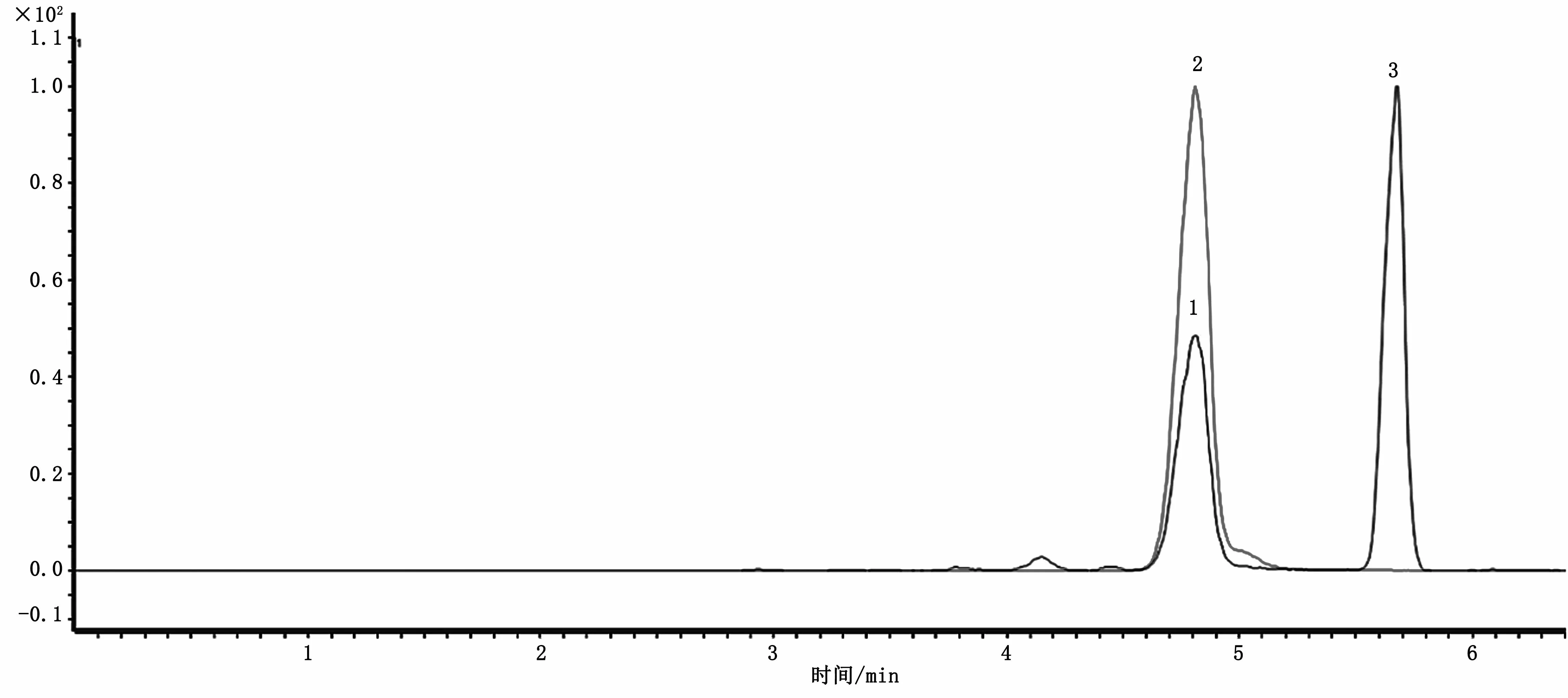
圖1 雞肉樣品中利巴韋林的MRM色譜圖
2.3 樣品前處理的選擇
與其他被使用的諸多抗生素獸藥不同,利巴韋林極性較強,不能使用有機溶劑從動物組織中萃取出來。實驗采用水性緩沖液進行提取,同時考慮到需要在酸性條件下進行酶解以及沉淀樣品的蛋白,在水性緩沖液中加入三氯乙酸溶液,既促進了蛋白的沉淀,又有利于后一步的凈化過程。
實驗采用PBA固相萃取柱,是含有苯硼酸官能團的獨特硅膠基質吸附劑,可保留酶解后游離出的利巴韋林,并使用甲醇淋洗去除更多非極性保留雜質,在酸性條件下,利巴韋林被洗脫出來。本研究使用酸性條件下的水性洗脫液洗脫利巴韋林,與其他酸性條件下的有機型洗脫液相比,吸附劑能保留大量的基質干擾成分,確保凈化效果更加清潔。此外,本實驗選取的色譜柱更適合在高水相流動相條件下的水性樣品進樣。
為消除樣品基質效應對最終定量結果的影響,選用利巴韋林的同位素利巴韋林-13C5作為內標物,采用內標法定量,標準曲線的配制用0.5%甲酸水作為定容溶劑。
2.4 線性范圍與檢出限
用移液器分別移取100 ng·mL-1的標準工作液 0.05 mL、0.10 mL、0.20 mL、0.40 mL、0.80 mL、 1.00 mL,置于10 mL容量瓶,向每個容量瓶中加入0.10 mL濃度為100.0 ng·mL-1內標工作液,用0.5%甲酸水定容至刻度,得到質量濃度分別為0.5 ng·mL-1、 1.0 ng·mL-1、2.0 ng·mL-1、4.0 ng·mL-1、8.0 ng·mL-1、 10.0 ng·mL-1以及內標濃度為1.0 ng·mL-1的標準系列溶液。按照1.3.1和1.3.2條件進行儀器分析,以外標與內標峰面積比值為縱坐標,標準工作曲線中外標與內標濃度比值為橫坐標。結果表明,利巴韋林在0.5~10.0 ng·mL-1范圍內,線性方程為Y=1.001 1X-0.032 5,R2為0.999 8,線性關系良好。選取不含目標組分的陰性樣品,采用樣品加標的方式,按照1.3.3前處理的方法進行處理,儀器測定,以定量離子色譜峰的信噪比(S/N)≥3計算方法的檢出限,方法檢出限為0.5 μg·kg-1。
2.5 方法回收率與精密度
選取不同基質樣品,分別進行3個濃度水平的空白加標實驗,計算回收率,每個添加水平進行6次平行實驗,按照1.3的實驗條件進行樣品前處理和儀器測定,計算目標物的平均回收率和精密度。
由表2可以看出,利巴韋林的平均回收率為78.6%~102.7%,相對標準偏差為3.03%~9.14%,表明該方法的準確度和精密度良好,能夠滿足雞組織中利巴韋林殘留量的檢測要求。
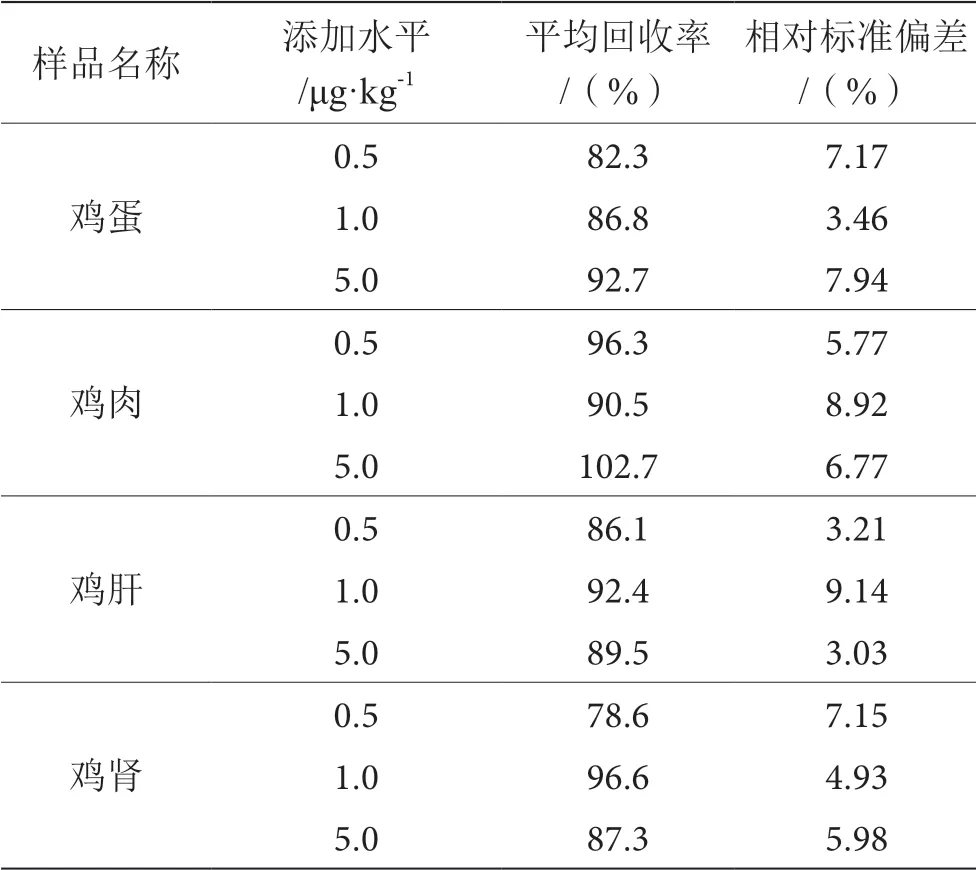
表2 利巴韋林在不同基質中的回收率和相對標準偏差表(n=6)
2.6 實際樣品的測定結果
采用優化后方法對本地區的20份雞組織樣品進行檢測分析,結果表明,所有樣品中均未檢出利巴韋林。
3 結論
本研究建立了雞組織中利巴韋林的超高效液相色譜-串聯質譜檢測方法。雞組織中的利巴韋林經三氯乙酸溶液提取后,經PBA固相萃取柱凈化,采用反相色譜柱分離,在正離子模式下以多反應監測模式測定,同位素內標法定量,通過對方法學參數進行考察,所建立的方法穩定性和重復性好,適用于雞組織中利巴韋林殘留量的測定。

