核酸疫苗研發態勢與發展建議
李愛花,楊雪梅,孫軼楠,苑亞坤,楊俊濤
(1.中國醫學科學院醫學信息研究所,北京 100020;2.中國醫學科學院,北京 100005)
一、前言
疫苗是人類防控傳染病及部分非傳染性疾病(如腫瘤)的重要“武器”。疫苗接種作為有效的控制手段,已經消滅了天花、脊髓灰質炎等疾病,但未能有效防控人類免疫缺陷病毒(HIV)、瘧疾等對人類健康具有重大威脅的傳染病。一些新型傳染病,如傳染性非典型性肺炎、人感染高致病性禽流感、新型甲型流感病毒、埃博拉病毒、寨卡病毒等導致的感染,傳播速度快、致死率高,給居民生命健康帶來了極大威脅;全球尚未有治療上述疾病的特效藥,需要綜合采用多種不同類型的候選疫苗來進行相應疾病的控制和預防。因此,我國需要提前開展疫苗方面的研發布局與技術儲備,才能應對潛在的重大挑戰 [1,2]。
近年來,在傳統的減毒疫苗、滅活疫苗技術基礎上,采用生物化學合成、人工變異、分子微生物學、基因工程等現代生物技術,開發出了多種類型的新型疫苗,代表性的有基因工程亞單位疫苗、重組疫苗、病毒樣顆粒疫苗(VLP)、多糖結合疫苗、合成肽疫苗、基因工程載體疫苗、核酸疫苗(分為脫氧核糖核酸(DNA)疫苗、核糖核酸(RNA)疫苗)等。核酸疫苗盡管研究歷史較長,特別是DNA疫苗的研發可追溯到1990年 [3],但相關工作并未獲得生物技術領域的足夠關注。當前,全球新型冠狀病毒肺炎(COVID-19)疫情仍在持續,信使核糖核酸(mRNA)疫苗在疫情防控中發揮了較為重要的作用,因相較于傳統疫苗更加高效的特點而成為疫苗研發領域的關注熱點,也促進了業內對核酸疫苗的重新審視。有研究分析了冠狀病毒疫苗的研發態勢 [4],發現在冠狀病毒疫苗研發中運用較多的有核酸疫苗、病毒載體疫苗、蛋白亞單位疫苗等技術路線;梳理了針對COVID-19疫情的DNA疫苗、mRNA疫苗關鍵技術與產品研制進展 [5,6];綜述了mRNA疫苗的潛在生物學機制及在某些傳染病、腫瘤中的應用情況 [7]。本文分析了DNA疫苗、RNA疫苗、結合疫苗、亞單位疫苗、病毒樣顆粒疫苗相關的科學引文索引(SCI)論文發表情況:核酸疫苗和其他新型疫苗在近20年來備受關注;RNA疫苗技術是2000年以來新興開展的研究方向,仍處于研究上升階段,且在2020年以來研究關注度得到顯著提升;DNA疫苗處于研究發展的成熟期,但2010 年之后研究熱度已呈現出下降趨勢(見圖1)。
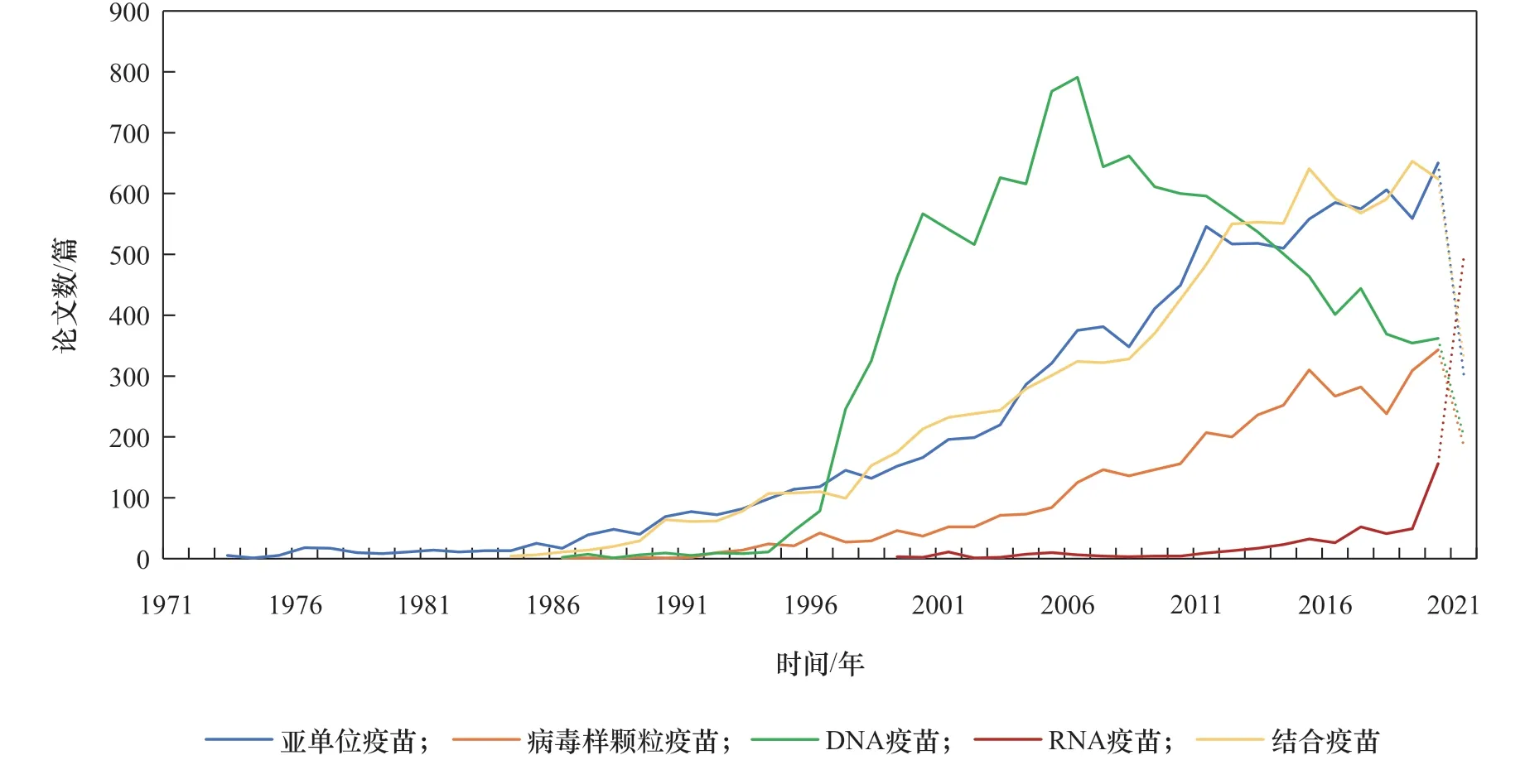
圖1 新型疫苗研究論文發表趨勢
也要注意到,就已經發表的核酸疫苗研究綜述論文來看,尚未對核酸疫苗的整體發展軌跡、DNA疫苗與RNA疫苗研發之間的關聯及演化等進行比較分析,也未開展系統性的研究產出數據比對。針對于此,本文著重開展核酸疫苗的發展歷程梳理、應用態勢分析、發展趨勢研判,提出我國核酸疫苗的發展建議,以期為相關研發布局和管理政策研究提供基礎性參考。
二、核酸疫苗技術概述
核酸疫苗也稱基因疫苗,將編碼某種抗原蛋白的外源基因(DNA或RNA)直接導入動物體細胞內(如以經肌肉注射、微彈轟擊等方式),通過宿主細胞的表達系統合成抗原蛋白,誘導宿主產生對該抗原蛋白的免疫應答,進而達到預防和治療疾病的目的。根據主要成分的不同,核酸疫苗分為DNA疫苗、RNA疫苗,其中RNA疫苗主要指mRNA疫苗。
(一)DNA疫苗技術
DNA疫苗可分為不需要任何化學載體的“裸疫苗”、將編碼某種蛋白質抗原的基因重組到真核表達載體后的DNA質粒 [5];直接或經包裝后導入宿主體內,被細胞(組織細胞、抗原遞呈細胞或其他炎性細胞)攝取,即可在細胞內表達病原體的蛋白質抗原,通過刺激機體產生細胞免疫和體液免疫反應。
與傳統的蛋白質疫苗相比,DNA疫苗的免疫原性受到抗原表達水平偏低的限制,在30多年的研發過程中人體臨床試驗結果并不理想。新技術的引入有望進一步提高DNA疫苗的功效,如通過密碼子優化、基因修飾、佐劑和復雜的啟動–促進方案等來提高疫苗免疫原性,采用電穿孔、脂質納米顆粒等更好的疫苗傳遞技術。
(二)mRNA疫苗技術
mRNA疫苗是在體外合成的含有編碼特定抗原的mRNA序列,被注射至體內后,首先需要通過細胞膜進入細胞內;因mRNA序列結構不穩定且細胞內外含有較多核酸水解酶,需要特殊的保護措施來防止mRNA序列降解,還需兼顧跨膜的效率。mRNA疫苗通常以內涵體的形式進入細胞,釋放到細胞質內發揮作用;為避免過早降解,mRNA翻譯過程也需要一些工具的調節 [8]。
當前的mRNA疫苗主要有傳統mRNA疫苗、自我擴增型mRNA疫苗兩種形式:前者的開放閱讀框(ORF)只含有編碼抗原的基因;后者的ORF不僅包含編碼抗原的基因,還包括RNA擴增需要的非結構蛋白,可使mRNA進行擴增并增加目的抗原的表達量。除了ORF之外,兩種疫苗均含有由5′ 端非翻譯區(5′ UTR)、3′ 端非翻譯區(3′ UTR)、5′ 端帽子結構(Cap)、3′端多聚腺苷酸結構(Poly-A),通過對mRNA的人工修飾,可增強mRNA穩定性并提高mRNA翻譯的準確性和效率,也可降低mRNA自身的免疫原性,提高安全性。
遞送載體對mRNA疫苗的穩定性、翻譯效率同樣起著重要作用,可分為病毒載體、非病毒載體。病毒載體本身具有免疫原性,以之為載體可能會使機體產生干擾抗體,影響mRNA疫苗的功效。非病毒載體以脂質體載體在mRNA疫苗的遞送中應用最為廣泛,主要優勢有:脂質體呈囊狀,通過脂質納米粒包裹mRNA的遞送技術,可將mRNA包裹在空腔中,避免接觸核酸水解酶以防止降解;脂質體性狀與細胞膜相似,可促進載體與細胞膜融合,提高mRNA進入細胞的效率;脂質體可促進mRNA從內涵體中釋放至細胞質中,最終大幅提高mRNA在體內的表達效率,易于量化生產,可應用于批量生產疫苗。
(三)核酸疫苗的特征
與傳統的滅活疫苗、亞單位疫苗相比,核酸疫苗具有突出優點 [5,9]。就理論層面而言,核酸疫苗可以合成表達幾乎所有的蛋白質抗原,為抗原設計提供了極大的靈活性;得益于數據挖掘技術,進一步優化現有抗原、設計獨立于天然基因、實現核酸疫苗的優化和個性化,有可能成為現實。相關優點有:①免疫保護力強,接種后蛋白質在宿主細胞內表達,直接與組織相容性復合Ⅰ類或Ⅱ類分子結合,同時引起細胞和體液免疫;②制備簡單,省時省成本,只需對編碼抗原的基因進行設計和克隆,生產工藝和質量控制體系可以通用,不隨抗原基因的改變而變化,不需體外蛋白質表達和純化,在流行病暴發期可快速開發新的疫苗;③免疫應答較持久,如19個月后仍可檢測到外源基因相當數量的表達 [10];④同種異株交叉保護,選擇病原體的編碼保守蛋白的核酸序列作為疫苗,因其不會變異而對同一種病原產生交叉免疫;⑤兼具預防性和治療性功能,如在防治腫瘤應用中,基因疫苗接種后可誘發機體產生細胞毒性T淋巴細胞免疫應答,對細胞的惡變進行免疫監視,對癌變的細胞產生免疫應答;⑥易于儲存和運輸,主要指DNA疫苗在室溫下相對穩定。
核酸疫苗雖然有優于傳統疫苗的諸多優點,但也存在一些不足。一方面,DNA疫苗誘導產生的抗體,可能不是針對編碼的抗原,而是針對雙鏈質粒DNA分子或mRNA本身,促使自身免疫性疾病的發展并導致機體產生免疫耐受,外源DNA有整合到宿主基因組的潛在風險;DNA疫苗在小動物體內可產生明顯的效果,但在大型動物、人類體內的免疫原性相對較低。另一方面,近年來興起的RNA疫苗具有與活病毒類似的免疫應答機制、簡單快速的化學合成制備方法、良好的熱穩定性、無整合和干擾基因組轉錄的風險等優勢,但仍偶發原因不明的不良反應 [5,11];篩選新抗原時重要的新抗原有可能被研發人員錯過,被選中的反而是低效或脫靶的抗原,會導致潛在安全問題;突變克隆可能差異很大,因此很難確定產生足夠抗原免疫應答的抗原需求量;在合成某些不常見序列、降低相關試劑生產成本方面仍存在障礙 [7]。
三、核酸疫苗研發軌跡和趨勢
(一)DNA疫苗研發相對成熟,mRNA疫苗研發嶄露頭角
核酸疫苗研究始于20世紀80—90年代,在經過滅活疫苗、減毒疫苗、亞單位疫苗等多次疫苗變革后最終走向實際應用。1990年,Wolff等構建了外源性重組質粒,注射入小鼠肌肉后可被細胞攝取并能在體內穩定地表達編碼蛋白 [3,10]。1991 年,Williams等發現外源基因輸入體內的表達產物可誘導產生免疫應答 [12]。1992年,Tang等發現外源質粒的體內表達能夠誘發機體產生針對表達基因產物的抗體反應,產生特異性抗體標志著基因疫苗概念的確立 [13]。1993年,Ulmer等將含有編碼甲型流感病毒核蛋白的重組質粒注射到小鼠肌肉,質粒可有效地保護小鼠抵御流感病毒異源株的攻擊 [14]。此后的大量動物實驗表明,在適當的條件下,DNA進入體內能引起細胞免疫和體液免疫。1994年在日內瓦召開的專題會議上將這種疫苗命名為核酸疫苗,后被稱為繼滅活疫苗和減毒疫苗、亞單位疫苗之后的“第三代疫苗”。
早 在1990年,Wolff 等[3]將 體 外 合 成 的mRNA經肌肉注射至小鼠骨骼肌內,發現在骨骼肌細胞內有特定表達的蛋白質生成并產生免疫反應,展示了mRNA的治療潛力。然而,mRNA容易被無處不在的RNA酶降解,具有不穩定的固有特點,一般認為實用性較低,多年來mRNA疫苗及藥物研究進展緩慢。隨著RNA穩定技術、遞送系統的發展,近年來RNA疫苗技術得到進一步發展,如德國美因茨大學研究團隊針對不同黑色素瘤患者,研發了含有多種腫瘤新抗原的個性化mRNA疫苗 [15]。從整體趨勢來看,DNA疫苗技術研究處于穩中有降的狀態;RNA疫苗步入上升期,自2014 年起相關論文數和專利申請量增長明顯(見圖1、圖 2)。RNA疫苗的研發技術趨于完善,基本滿足了COVID-19疫情對快速高效疫苗的需求,在2020年兩款RNA疫苗有效性迅速得到驗證后,研究熱度明顯超過其他類型(見圖1)。
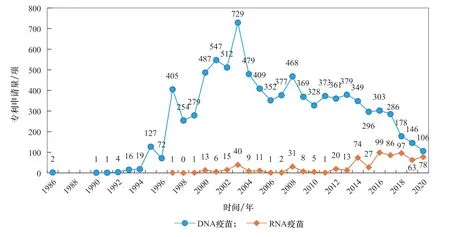
圖2 DNA疫苗和RNA疫苗專利申請數量的變化趨勢
值得指出的是,在2020年以前,國家級研究基金資助的RNA疫苗研究明顯少于DNA疫苗。國家自然科學基金委員會(NSFC)、美國國立衛生研究院(NIH)是世界各國資助核酸疫苗研究最多的機構,資助產生的DNA疫苗研究論文占DNA疫苗論文總量的80%~90%,資助產生的RNA疫苗研究論文約為DNA疫苗的1/10。
(二)COVID-19疫情促進mRNA疫苗研究提速
在2020年以前,雖有多項核酸疫苗研發進入臨床Ⅲ期試驗,但都以失敗告終,世界范圍內沒有人用核酸疫苗上市;僅有7種獸用DNA疫苗獲批上市,用于預防馬西尼羅病毒感染的West Nile-Innovator DNA是世界首個獲準上市的DNA疫苗。
COVID-19疫情暴發后,對疫苗的需求顯著推動了核酸疫苗的研發進程,相關疫苗方案有超過20%為核酸疫苗類型。截至2021年6月30日,核酸疫苗產品已有707項,一年半時間內的新增產品較之前24年總量增長了18%,有394項產品(含356項DNA疫苗、38 項RNA疫苗)已終止研發。目前,仍處于活躍研發階段的疫苗產品有313 項(含190 項DNA疫苗、123 項RNA疫苗),其中約10%的產品處于藥物發現階段,約88%的產品處于臨床前或臨床研究階段;2 項產品因經費或數據問題處于中止狀態,1 項產品處于預注冊階段,2 項mRNA產品(mRNA-1273、BNT162b2)已通過緊急授權上市使用。
自2020年以來,新啟動開發的核酸疫苗產品,有66項(約占60%)為針對COVID-19開發,其中44項為mRNA疫苗。目前在研的COVID-19預防性mRNA疫苗有41項,COVID-19預防性DNA疫苗有23項。另外,針對流感病毒、HIV病毒、乙肝病毒、寨卡病毒及其他病毒感染,腫瘤等非感染性疾病開展研究的疫苗有44項。mRNA疫苗從啟動研發到上市應用僅耗時1年,大大突破了通常情況下疫苗研發8~10年上市的周期,這為新發突發傳染病快速獲取預防性疫苗帶來了新希望。
(三)各國核酸疫苗產品研發態勢不均衡
從核酸疫苗專利申請表征產品研發強度的角度看,美國在DNA疫苗和RNA疫苗領域均處于領先位置(見圖3、表1),且自2015年起明顯傾斜于RNA疫苗;德國近10年的mRNA疫苗研發顯著增加。因此,美國、德國具備較好的mRNA疫苗研發技術儲備,在COVID-19疫情暴發后能夠迅速研發mRNA疫苗并保持領先態勢。美國、德國的COVID-19 mRNA疫苗產品數量分別占世界mRNA疫苗產品數量的10%、5%。
鑒于RNA疫苗研發風險較高,我國在新型疫苗研發方面偏重技術較為成熟的亞單位疫苗、病毒載體疫苗、DNA疫苗等。近20年來,我國在DNA疫苗領域的研發具有較強實力,專利申請量僅次于美國,但RNA疫苗研發相對滯后(見表1、表2、圖3)。但在COVID-19疫情暴發之后,鑒于RNA疫苗的良好應用潛力,我國高度重視并及時布局RNA疫苗研發,相關專利申請量已超越德國成為世界第二大RNA疫苗研發國(見圖3)。也要注意到,我國核酸疫苗研發產品數量增速慢于專利申請數量,需要比先發國家以更長時間才能體現出技術向產品的轉化。目前,我國主導的DNA、RNA疫苗產品的研發數量分別約占世界的2%、9%。
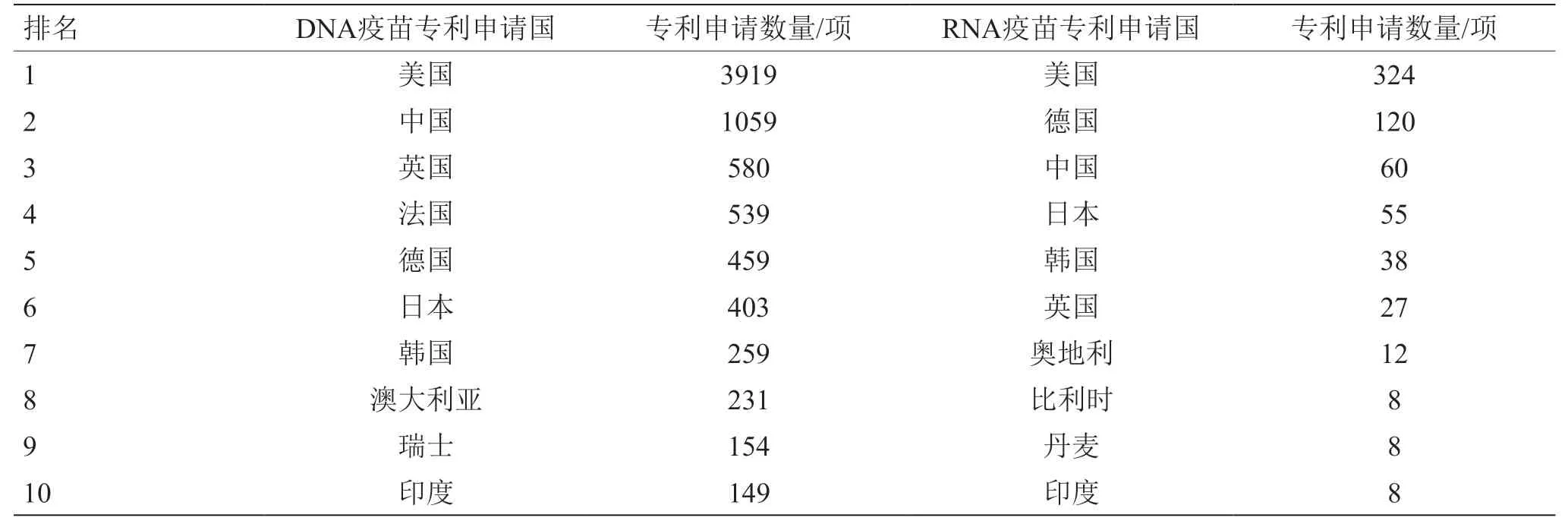
表1 核酸疫苗主要專利申請國家的分布情況
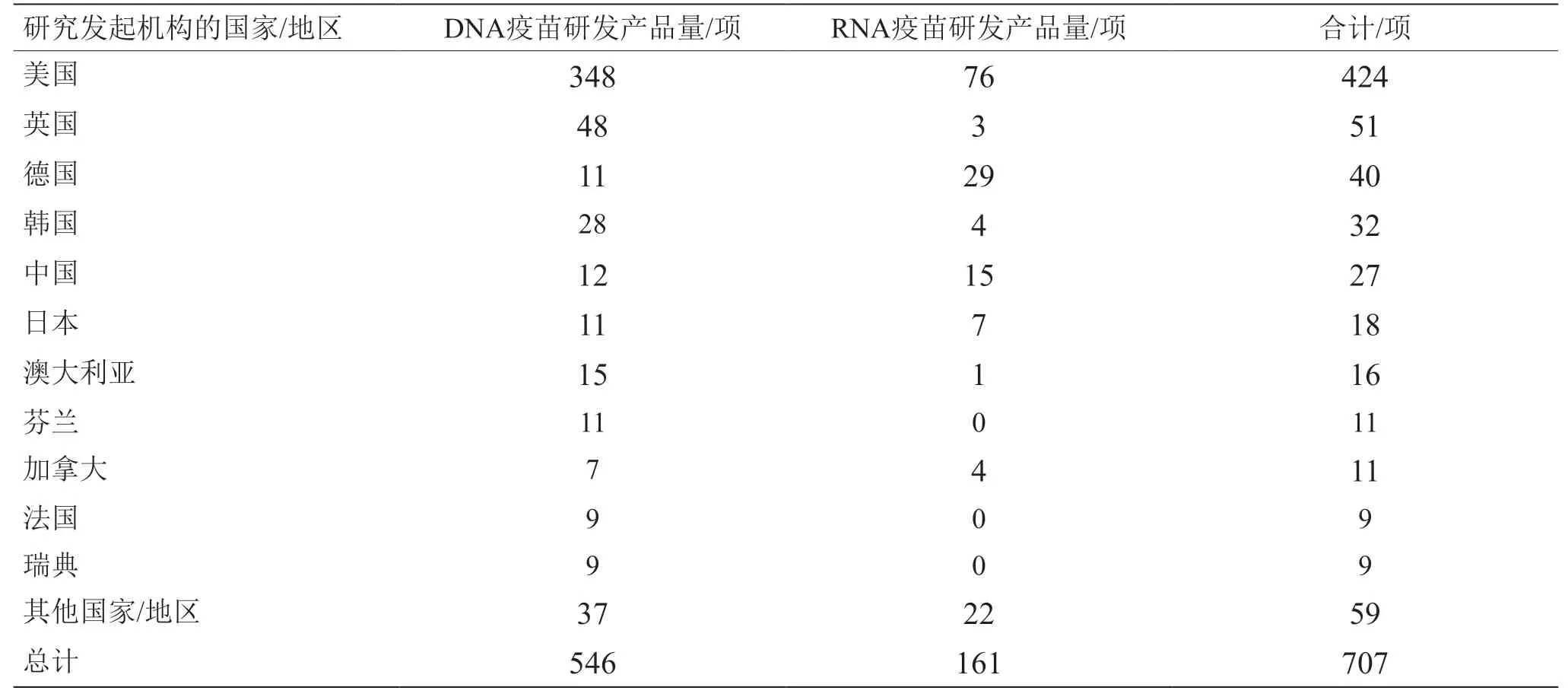
表2 核酸疫苗產品主要研究發起國家/地區的分布情況
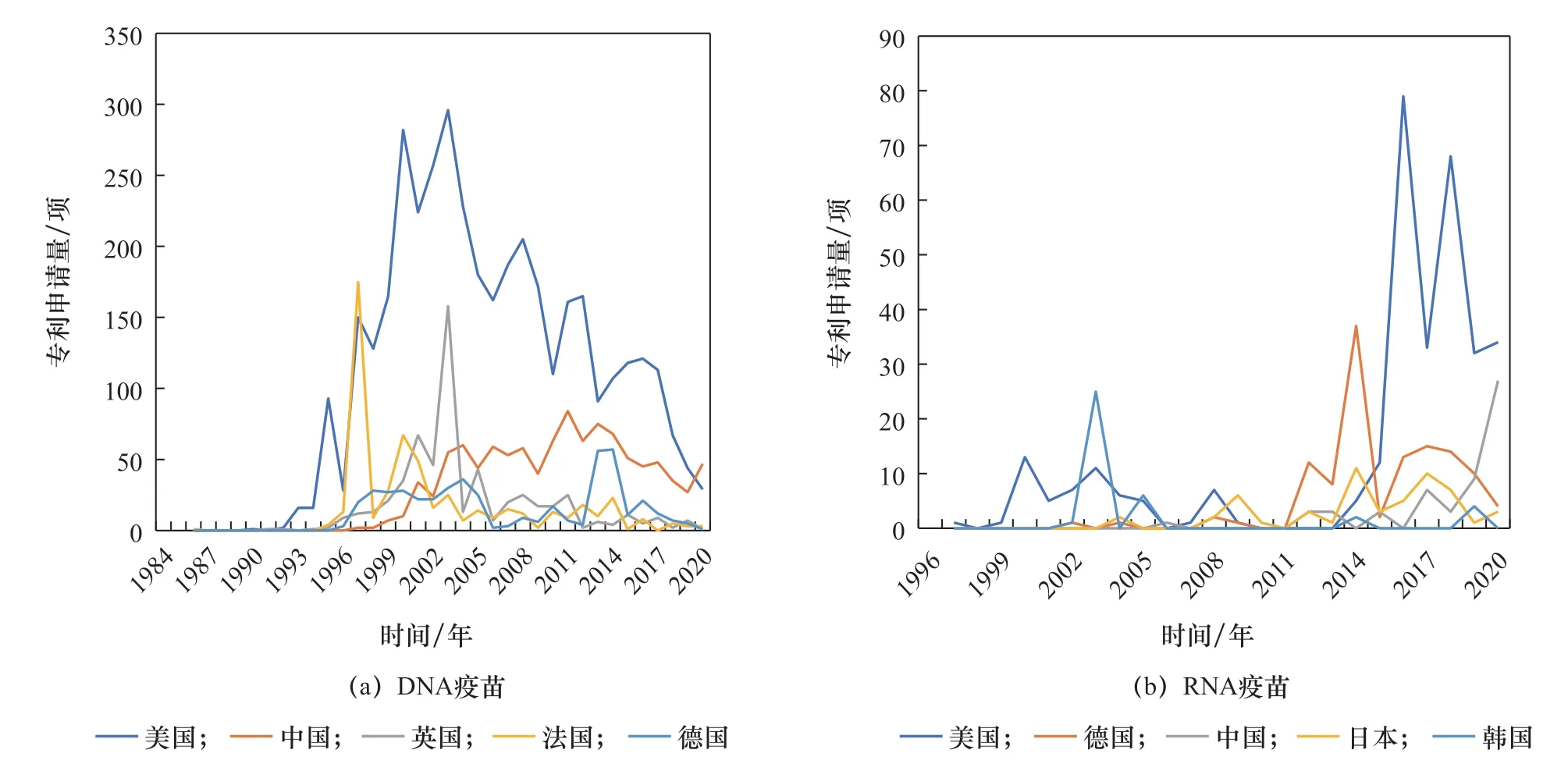
圖3 核酸疫苗專利申請趨勢
(四)感染和腫瘤是核酸疫苗的主要應用方向
從基礎性研究論文來看,核酸疫苗研發主要針對高致病性病毒(HIV、丙型肝炎病毒(HCV)、寨卡病毒、西尼羅病毒等)、腫瘤(如宮頸癌、前列腺癌、乳腺癌等),研究內容涉及疫苗結構及制備、免疫機制、有效性、安全性/毒性等。
核酸疫苗產品應用方向同樣以病毒感染、腫瘤預防與治療為主。病毒主要有流感病毒、乙型肝炎病毒(HBV)、HCV、HIV、SARS-CoV-2等,腫瘤主要有乳腺腫瘤、黑色素瘤、膠質母細胞瘤、非小細胞肺癌、卵巢腫瘤、前列腺腫瘤等。還有少量的核酸疫苗用于免疫疾病、神經/精神疾病、糖尿病視網膜病變等非傳染性疾病的防治。與其他應用方向不同,針對COVID-19的疫苗以mRNA疫苗為主,且相關疫苗的成功上市帶動了流感病毒感染疫苗研發更多轉為mRNA疫苗方向(見表3、圖4)。
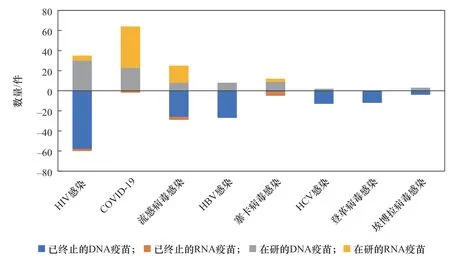
圖4 部分病毒核酸疫苗研發產品比較
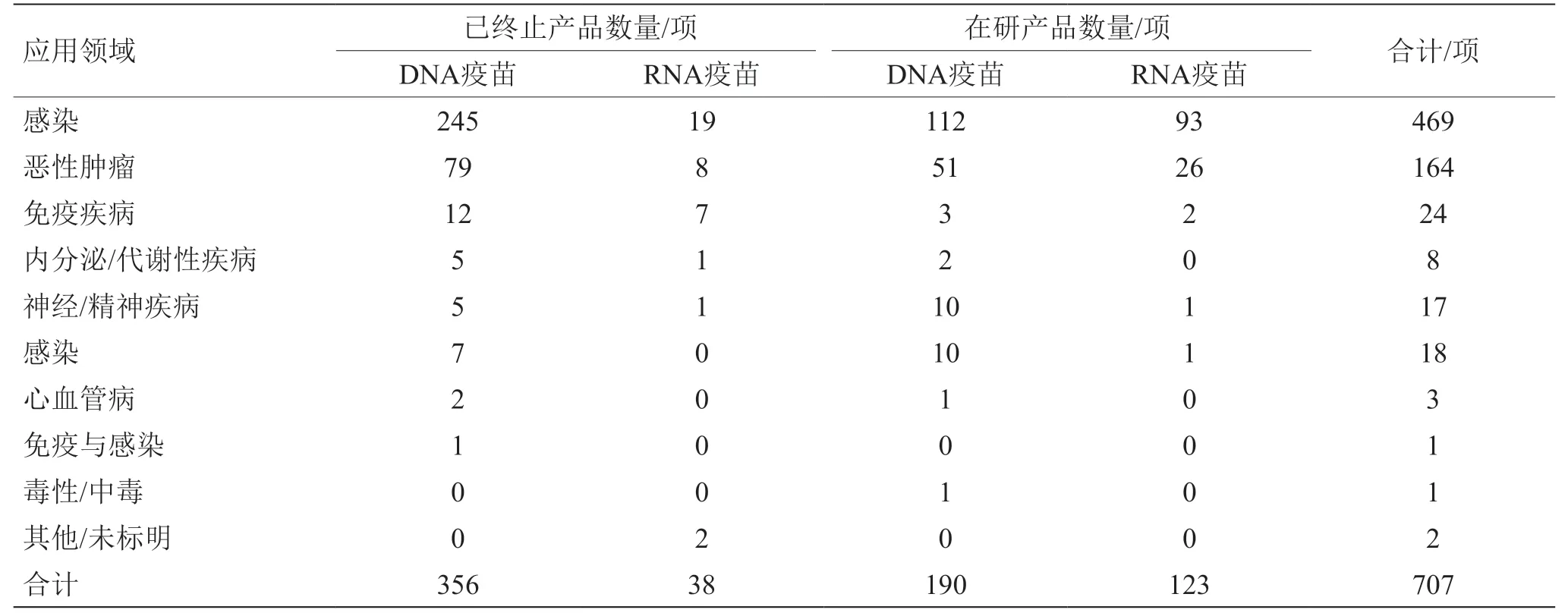
表3 核酸疫苗產品預防或治療疾病類型分布情況
四、核酸疫苗發展建議
核酸疫苗特別是mRNA疫苗,在臨床方面的成功應用顯著增強了對新發傳染病的反應和控制能力,從刺激人體自身免疫反應的角度考慮則顯著增強了治療經典和重新出現傳染病與腫瘤的能力。惟有從技術研發、安全監管、前瞻布局方面共同發力,才能較好解決核酸疫苗的技術成熟度、安全性等問題,從而有效應對急性傳染病暴發,推動疫苗從預防性應用拓展至治療性應用,為人類健康、經濟社會發展創造更大價值。
(一)技術發展建議
1.改良目的基因表達
核酸疫苗研究已進入精準設計階段,應用保護組學分析、結構疫苗學、合成生物學等交叉學科技術,創新研究思路,預測靶標/靶點,進行新抗原再設計;通過優先使用優勢密碼子并避免使用稀有密碼子、甲基化堿基等方式,改造骨架或添加免疫刺激序列優化目的基因;對質粒載體的啟動子、增強子、內含子等轉錄調控元件進行優化,提高外源基因的表達。
2.完善遞送系統
對于將外源性DNA導入靶細胞,為克服常規方式的質粒轉染效率低、在人體內難以引起有效免疫效果的問題,采取新型物理或化學方法來提高外源性DNA對細胞的轉染效率,如電穿孔、基因槍、生物噴射器(無針注射)、微針陣列等。對于mRNA疫苗,除了基于脂質納米顆粒等載體進行遞送外,探索脂質體運載、聚合物運載、脂質體聚合物納米遞送平臺等新方式,實現高效包載并保護mRNA不被RNA酶降解。
3.提高免疫應答
加入免疫佐劑是增強機體對抗原的免疫應答或改變免疫應答類型的有效途徑。除了細胞因子、趨化因子、信號分子、模式識別受體配體等免疫佐劑類型外,開展純化體外轉錄mRNA研究,在mRNA分子中引入修飾性的核苷基團或形成mRNA-載體分子復合物,優化編碼mRNA的核心序列,提高翻譯效率,延長mRNA半衰期,達到調節mRNA免疫刺激性的目的。
4.增強mRNA穩定性及易存性
深入開展保持mRNA疫苗活性及保存期的研究,通過對DNA模板上的5′ UTR、3′ UTR區域序列、Poly-A尾,體外轉錄時的Cap、核苷三磷酸(NTP)等合成mRNA元件進行設計,或利用分離和純化技術來優化mRNA,提高mRNA的穩定性和翻譯效率。進一步改進遞送系統,采用高效的mRNA遞送載體來顯著改善mRNA疫苗的穩定性和翻譯效率。研究在凍結條件下與載體分子復合的mRNA儲存效果,延長疫苗的保存期 [16]。
(二)行業政策建議
1.嚴格監管核酸疫苗的安全性和有效性
盡管核酸疫苗在COVID-19疫情中因其高效快速的特點而得到國外監管機構破例批準上市,但該類疫苗技術的長期效果仍需進一步驗證。在疫苗研制企業得出有效性、短期安全性的前提下,建議我國監管機構仍應嚴格依據審批制度,穩妥推動在傳統疫苗已經上市條件下核酸疫苗的過渡使用,力求逐步完善長期安全性驗證問題。鑒于核酸疫苗在COVID-19疫情之前都未曾正式獲批人體使用的實際情況,對于在疫情防控特殊情境下加速獲批的人用核酸疫苗,我國監管機構應保持高度關注并持續跟蹤,以準確掌握核酸疫苗的長期安全性、研發投入與綜合產出效益。
2.注重技術研發的前瞻布局并促進轉化
核酸疫苗作為新型疫苗,相關技術仍處于不斷完善的過程中,在疫苗結構、遞送、免疫原性、穩定性等方面仍存在一些問題。面對傳染病疫情對安全有效疫苗的亟需,國外優勢機構及時調整研發重心,在mRNA疫苗研發方面取得了階段性重大突破。建議我國行業管理機構在此領域堅持前瞻性思維和問題導向,在把握成熟研發方向的同時,面向亟待解決問題(傳染病防控、腫瘤治療)開展前瞻布局,穩妥處置、積極扶持有關核酸疫苗的高風險研究;積累和打牢基礎技術儲備,注重技術轉化與應用效能,形成產品批量生產能力,穩步提升我國疫苗研發綜合實力。

