TGF-β1/Smad4信號通路對去卵巢骨質疏松大鼠骨髓微環境的影響及針刺干預機制
白登彥 王冠 張海軍 朱濤 趙志鵬 尹秦 郭小榮
1.西北民族大學附屬醫院,甘肅 蘭州 730000
2.甘肅省第二人民醫院,甘肅 蘭州 730000
3.甘肅中醫藥大學附屬醫院,甘肅 蘭州 730000
骨質疏松癥(osteoporosis,OP)是以骨量減少、骨微結構退化導致的骨質變化、骨脆性增加從而極易引發骨折的全身代謝性疾病[1]。研究[2]發現,OP的發生是免疫系統、神經內分泌系統以及骨髓微環境動態失衡等共同作用的結果。骨髓微環境(bone marrow microenvironment,BMM)由成骨細胞、成纖維細胞、破骨細胞、基質細胞及其產生的細胞外基質和細胞因子等成分組成。BMM能夠提供生理屏障,阻斷調控多種細胞的分化、凋亡的信號,其變化與多種信號因子存在密切關系,其中Runx 2、PPARγ、TGF-β1、Smad 4是BMM動態平衡的重要指標[3]。TGF-β1/Smad 4信號通路是由轉化生長因子β1 (transforming growth factor,TGF-β1)和Smad 4構成。研究[4-5]認為,TGF-β1/Smad 4信號通路對骨細胞的形成、分化及凋亡具有一定的調節作用,但具體機制尚未完全闡明。研究[6-7]表明,針刺能夠改善骨微結構,調控BMM,但其是否通過調控TGF-β1 /Smad4信號通路影響OP發病尚未見相關報道。因此本研究擬通過切除雌性大鼠雙側卵巢的方法建立OP大鼠模型,給予電針刺激“腎俞穴”“三陰交穴”“關元穴”及“足三里穴”進行干預,旨在觀察針刺對去卵巢大鼠TGF-β1 /Smad4信號通路的干預,并分析其對BMM的影響。
1 材料與方法
1.1 材料
1.1.1實驗動物:選取3月齡SPF級雌性Wistar大鼠60只,體質量(200±20)g,由甘肅中醫藥大學實驗動物中心提供,動物合格證號:SCXK(甘)2019-0001,適應性喂養1周后開始實驗造模。本研究經甘肅中醫藥大學動物實驗倫理委員會批準,實驗過程及操作均遵守國家健康與醫學研究委員會(NHNRC)動物道德準則。
1.1.2試劑及儀器:纖毛機械刺激針(NC12775,美國StoeltingCo.),HANS-200A 電針儀(南京濟生)。戊酸雌二醇片(國藥準字J20191038,規格:1 mg×21片,拜耳)。Runx2抗體 (批號:XGK100552),PPARγ抗體(批號:WL01800),TGF-β1抗體(批號:YS-0086R),Smad4抗體(批號:XY-0585R),全部購自美國BioVision;BALP ELISAKit(批號:E202006)、CBF-α1 ELISAKit(批號:E202905)、CTX-I ELISAKit(批號:E202012)、PINP ELISAKit(批號:E202010)、OC ELISAKit(批號:E202014),均購自江蘇江萊生物。Benchmark Plus 酶聯免疫檢測儀(美國賽默飛世爾科技公司);實驗動物微型CT影像系統(西門子Inveon,德國);倒置相差熒光顯微鏡(日本,Olympus);骨密度儀(韓國osteosys)。
1.2 方法
1.2.1動物分組與造模:將60只大鼠按照隨機數字法分為4組:空白組(A組)、模型組(B組)、針刺組(C組)及雌二醇組(D組),每組各15只。適應性喂養1周后,除空白組外,其他大鼠均參照文獻[8]去除卵巢,建立OP模型大鼠。造模成功后[9]進行干預治療12周。
1.2.2干預:A、B組大鼠給予等劑量生理鹽水灌胃;C組按文獻[10]取穴,置于自制鼠袋固定大鼠,暴露針刺穴位,將毫針刺入穴位后,接電針儀,疏密波,刺激強度2 mA,2 Hz/100 Hz,每次15 min,1次/d;D組按照人鼠等效劑量給予戊酸雌二醇50 μg/(kg·d)灌胃,共治療12周。A、B組大鼠常規飼養,各組大鼠生長環境及飼養條件相同。
1.2.3骨代謝標志物含量測定:將大鼠處死后心臟取血2 mL,置于離心機中,離心半徑10 cm,轉速3 000 r/min,離心10 min,取上清液,采用ELISA法檢測血清中骨特異性堿性磷酸酶(bone specific alkaline phosphatase,BALP)、核結合因子-α1(core binding factor-α1,CBF-α1)、I型膠原羧基末端肽(cterminal type I collagen telopeptide,CTX-I)、I型前膠原氨基端前肽(procollagen type I amino-terminal peptide,PINP)、骨鈣素(osteocalcin,OC)含量水平。
1.2.4骨小梁微結構及骨密度測定:采用Micro-CT掃描分離后的各組大鼠右側股骨遠端干骺端。所有標本從股骨遠端生長板頂點至皮質部分去掉后為本次興趣區域(region of interest,ROI),提取圖像資料,用自帶骨骼分析軟件( advanced bone analysis, ABA ) 測定骨組織相關計量學指標,包括:相對骨體積(BV/TV)、骨小梁厚度(Tb.Th)、連接密度(Conn.D)、骨小梁分離度(Tb.Sp)、骨小梁數量(Tb.N)、結構模型指數(SMI)。通過骨密度儀分析各組大鼠骨密度(bone mineral density, BMD)變化。所有操作分析均由同一組人完成。
1.2.5TUNEL法檢測股骨遠端細胞凋亡情況:取各組大鼠股骨組織剪碎后置于4 %多聚甲醛溶液內浸泡24 h,不同濃度乙醇按順序脫水后,進行切片操作,脫蠟后將標本置于蘇木精中進行染色15 min后脫水透明10 min,通過TUNEL試劑盒檢測不同組大鼠切片標本中細胞凋亡情況,激光共聚焦顯微鏡下觀察細胞凋亡情況。
1.2.6RT-PCR法檢測TGF-β1、Smad4、Runx2、PPARγ mRNA表達:提取各組大鼠股骨遠端部分骨組織,使用RNA抽提試劑盒提取不同組大鼠骨組織中總RNA,檢測RNA純度含量后用Takara逆轉錄試劑盒反轉錄獲取cDNA,應用Primer5.0設計引物序列,RT-PCR法檢測各組大鼠不同組織中TGF-β1、Smad4、Runx2、PPARγ mRNA表達量,甘油醛-3-磷酸脫氫酶(GAPDH)作為內參對照,采用 2-ΔΔCt方法分析數據。引物序列見表1。

表1 PCR 引物序列
1.2.7Western blot法檢測TGF-β1、Smad4、Runx2、PPARγ蛋白表達:將大鼠處死后,迅速取其股骨遠端的部分骨組織剪碎,加入RIPA裂解緩沖液放置在冰上30 min,提取各組大鼠骨組織中的總蛋白,使用BCA蛋白測定試劑盒測定各組大鼠骨組織中蛋白質的濃度。蛋白質用SDS-PAGE進行等量分離,然后移至PDVF膜上,并置于4 ℃下添加一抗(1∶500)孵育過夜。洗滌后添加辣根過氧化物酶綴合的二抗(1∶500),常溫下孵育2 h。ECL試劑顯影后應用軟件QuantityOne對蛋白相對表達水平進行分析。
1.3 統計學方法
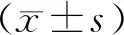
2 結果
2.1 大鼠骨代謝標志物比較
與空白組比較,各組大鼠造模后骨代謝標志物BALP、CBF-α1、PINP、OC含量明顯降低(P<0.05),CTX-I含量明顯升高(P<0.05);干預治療12周后,與模型組比較,雌二醇組大鼠和針刺組大鼠BALP、CBF-α1、CTX-I、PINP、OC改善程度優于模型組(P<0.05),且針刺組優于雌二醇組明顯(P<0.01)。見表2。
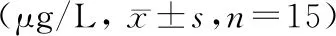
表2 各組大鼠骨代謝標志物含量比較
2.2 大鼠骨小梁微結構及骨密度比較
與空白組比較,模型組大鼠造模后BMD、BV/TV、Tb.N、Tb.Th、Conn.D、Tb.Sp、SMI均出現不同程度改變(P<0.05);干預12周后,與模型組比較,雌二醇組大鼠和針刺組大鼠BMD、BV/TV、Tb.N、Tb.Th、Conn.D、Tb.Sp、SMI參數不同程度改變(P<0.05);其中針刺組干預效果優于雌二醇組(P<0.01)。見表3。
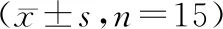
表3 大鼠骨小梁微結構比較
2.3 大鼠股骨遠端細胞凋亡情況比較
TUNEL染色提示藍色熒光為正常細胞核,綠色熒光為凋亡的成骨細胞和骨細胞。激光共聚焦顯示,空白組大鼠骨組織正常,綠色熒光極少;模型組大鼠造模后綠色熒光增多,提示成骨細胞和骨細胞凋亡增加;干預治療后,針刺組和雌二醇組大鼠股骨遠端成骨細胞和骨細胞凋亡數量減少。見圖1。
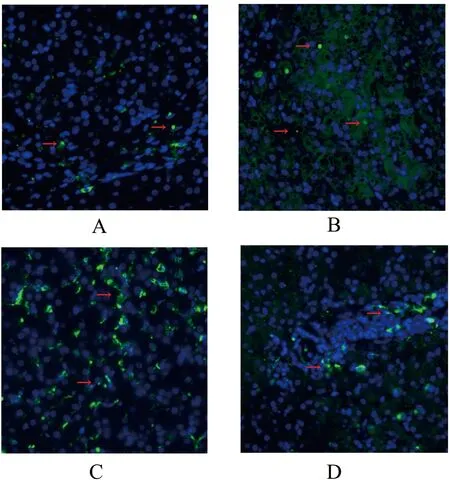
圖1 大鼠股骨遠端細胞凋亡情況比較
2.4 大鼠股骨遠端骨組織中TGF-β1、Smad4、Runx2、PPARγ mRNA表達量比較
與空白組比較,各組大鼠造模后股骨遠端骨組織中TGF-β1、Smad4 mRNA表達量明顯下降(P<0.05),Runx2、PPARγ mRNA表達量明顯上升(P<0.05);與模型組比較,干預12周后,各治療組大鼠股骨遠端骨組織中TGF-β1、Smad4表達量明顯上升(P<0.05),Runx2、PPARγ mRNA表達量明顯下降(P<0.05);其中針刺組和雌二醇組大鼠股骨遠端骨組織中TGF-β1、Smad4、Runx2、PPARγ mRNA的表達效果優于模型組(P<0.05),針刺組明顯優于雌二醇組(P<0.01)。見表4。
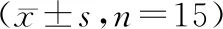
表4 骨組織中TGF-β1、Smad4、Runx2、PPARγ mRNA表達量比較
2.5 大鼠股骨遠端骨組織中TGF-β1、Smad4、Runx2、PPARγ蛋白表達量比較
與空白組比較,各組大鼠造模后股骨遠端骨組織中TGF-β1、Smad4 蛋白表達量明顯下降(P<0.05),Runx2、PPARγ 蛋白表達量明顯上升(P<0.05);與模型組比較,干預12周后,各治療組大鼠股骨遠端骨組織中TGF-β1、Smad4蛋白表達量明顯上升(P<0.05),Runx2、PPARγ 蛋白表達量明顯下降(P<0.05);其中針刺組和雌二醇組大鼠股骨遠端骨組織中TGF-β1、Smad4、Runx2、PPARγ 蛋白的表達效果優于模型組(P<0.05),針刺組明顯優于雌二醇組(P<0.01)。見圖2。

圖2 股骨遠端骨組織中TGF-β1、Smad4、Runx2、PPARγ蛋白表達量比較
3 討論
OP發病原因與骨組織代謝異常、骨髓微環境改變等多種因素有關[11]。隨著近幾年激素使用過多,人口老齡化加快,OP患者正在逐年增長[12]。中醫學將骨質疏松歸為“骨痿”“骨枯”范疇,辨證該病時多從腎脾等入手。張介賓[13]指出:“水谷之海先天為之主,精血之海后天為之資……先天不足者,后天培養之,亦可居其強半”。說明腎精氣充足與脾胃功能密切相關,脾胃健旺,則水谷精微化源充盛,骨骼強盛。骨髓微環境異常時,腎主骨生髓之功能也異常,進而可至骨痿,正如《素問·脈要精微論》所述“骨者,髓之府,轉搖不能,腎將憊矣”,《素問·痿論》言:“腎氣熱則腰脊不舉,骨枯而髓減,發為骨痿”,這也說明“腎將憊”與“腎氣熱”與腦的生理功能異常存在著密切的聯系。針刺能夠明顯調節骨髓微環境,改善骨微結構,修復成骨細胞增長、改善骨質量,但其具體機制仍不明確[14-16]。研究[17-19]指出,“腎俞穴”“三陰交穴”“關元穴”及“足三里穴”是補腎健脾重要穴位,而且對于OP的發生發展有重要影響。因此,本次研究在此基礎上選擇了上述穴位。
BMD是目前臨床檢測骨質疏松變化的重要指標。本研究結果顯示,大鼠在卵巢摘除后,其BMD明顯降低,骨小梁微結構嚴重破壞,證明成功建立OP模型。PINP作為I型前膠原細胞外分泌產物是骨形成的敏感指標,CTX-I是骨吸收過程中I型膠原釋放入血的產物。血液中PINP及CTX- I含量變化與I型膠原的合成速率、成骨細胞活動情況以及骨吸收過程密切相關,是診斷OP的特異性指標[20-21]。CBF-α1屬于Runt結構域基因家族的轉錄因子,由成骨細胞特異性表達,對成骨細胞的分化的起重要作用。研究[22]指出,CBF-α1能夠調節成骨細胞分化,調控骨細胞的功能因子表達,對骨骼形成和發育有重要作用。OC又稱骨R-羥基谷氨酸蛋白,主要由成骨細胞、成牙質細胞合成,作為成骨細胞分泌的特殊非膠原蛋白,其含量變化可用于監測骨發育以及骨代謝情況,在調節骨鈣代謝中起重要作用[23]。在OP中,CTX-I、CBF-α1以及OC均能特異性反映骨髓微環境平衡情況。本研究發現,與空白組比較,模型組大鼠血清中BALP、CBF-α1、CTX-I、PINP、OC等骨代謝標志物含量明顯改變,這表明去卵巢大鼠造模后骨量出現丟失,這與OP的病理表現相符。與模型組比較,針刺干預后大鼠骨代謝相關標志物水平明顯改善,BMD含量明顯增加,骨小梁微結構及骨髓微環境明顯改善,這與王亞軍[24]、邵雨薇[25]等的研究結果一致。
骨髓微環境紊亂與絕經后骨質疏松癥的骨代謝特點非常相似,而骨髓微環境平衡是多種因素共同作用的結果[26]。其中Runx2 和 PPARγ能夠調節骨髓間充質干細胞向成骨細胞和脂肪細胞這兩種細胞方向分化,是骨髓微環境動態變化的重要指標因子[27-28]。TGF-β1是調節骨髓微環境中骨吸收和骨形成的重要多肽類生長因子,Smad4是TGF-β1跨膜傳導多種信號所需的重要分子之一,TGF-β1/Smad4信號通路在骨髓微環境的平衡調節過程中發揮著重要作用,是絕經后骨質疏松癥發生的重要機制[29-30]。但針刺是否通過調控TGF-β1/Smad4信號通路影響OP的骨髓微環境仍不明確。本研究結果顯示,大鼠造模后股骨遠端骨組織中TGF-β1、Smad4、Runx2、PPARγ表達含量明顯改變,但經針刺干預后,骨組織中TGF-β1、Smad4、Runx2、PPARγ趨向好轉,這提示針刺能夠調節OP大鼠TGF-β1/Smad4信號通路的表達,進而影響OP骨髓微環境改變。
綜上所述,針刺能夠影響去卵巢大鼠骨髓微環境改變,改善骨代謝標志物表達,調控骨代謝平衡,其機制可能與針刺調控TGF-β1/Smad4信號通路表達有關。

