山東省大蒜主產區根腐病病原菌分離與鑒定
高園園 張龍平 任艷云 朱庚振 劉國偉 王南南


摘要:為進一步探討山東省大蒜主產區根腐病的病原菌及種類,于2020年從山東省濟寧市任城區、金鄉縣,菏澤市巨野縣,臨沂市蘭陵縣等采集發病大蒜植株,通過組織分離法獲得4株分離物,利用形態學鑒定方法,結合Blast同源性分析,利用MAGE 7.0構建系統發育樹的方法對分離物進行鑒定。結果表明,尖孢鐮孢菌(Fusarium oxysporum)、腐皮鐮孢菌(F. solani)、芳香鐮孢菌(F. redolens)、木賊鐮孢菌(F. equiseti)是山東省大蒜主產區根腐病的致病菌。通過對比4種鐮孢菌對大蒜根腐病的致病性發現,分離出尖孢鐮孢菌的植株根腐病最為嚴重,可見尖孢鐮孢菌是大蒜根腐病病害的主要致病菌。結果可為大蒜根腐病拮抗菌的篩選和防治及大蒜——根腐病互作機理研究提供理論依據和技術參考。
關鍵詞:大蒜;根腐病;尖孢鐮孢菌;病原菌鑒定;腐皮鐮孢菌;芳香鐮孢菌;木賊鐮孢菌
中圖分類號:S436.33 ? 文獻標志碼: A ?文章編號:1002-1302(2021)14-0086-04
大蒜(Allium sativun L.)為百合科蔥屬一年生或二年生草本植物,原產于西亞和中亞,漢代張騫出使西域帶回我國[1],至今已有2 000多年的種植歷史[2]。大蒜性溫味辛,富含營養物質,是人們生活中重要的蔬菜和調味品。據統計,我國是世界上大蒜種植面積最大、產量最高的國家[3],大蒜種植成為多數地區經濟發展的重要支柱性產業和出口創匯農產品之一[4]。近年來隨著大蒜產業的發展和效益的增加,在大蒜主產區由于連作、管理不善等因素影響,大蒜病害呈現高發態勢[5],尤其是大蒜根腐病較為嚴重,影響大蒜的產量和品質。已有研究表明,根腐病發生是由多種病原菌混合侵染造成的[6],比如牡丹根腐病病原菌是茄腐皮鐮刀菌(Fusarium solani) 、鏈格孢菌(Alternaria spp.) 、立枯絲核菌(Rhizoctonia solani)等;甜瓜、黃瓜、苜蓿等作物的根腐病病原菌是茄腐皮鐮刀菌;寧國山核桃根腐病的病原是尖孢鐮刀菌(F. oxysporum)和瓜果腐霉菌(Pythium aphanidermatum)。有關大蒜根腐病的病原,前人進行了一定研究,已知的有真菌性和細菌性病原菌。張博等通過對病株進行分離和致病力測定,確定致病菌是腐霉(Pythium)[7];而有的研究則認為大蒜根腐病是由鐮刀菌屬的真菌引起的,其中尖孢鐮刀菌是致病的優勢種[8];有的研究則認為大蒜根腐病屬細菌性病害,是大蒜軟腐病的一種[9];由此可見,導致大蒜根腐病的致病菌在不同地區存在差異。本研究以大蒜根腐典型發病植株為供試材料,采用組織分離法對病原菌進行分離純化,運用菌落形態學和分子生物學相結合的方法進行鑒定,以期明確導致大蒜發生根腐病的病原菌種類,旨在為大蒜生長過程中根腐病病害的有效防治提供理論基礎和技術借鑒。
1 材料與方法
1.1 樣品來源
于2020年從山東省濟寧市任城區、金鄉縣,菏澤市巨野縣,臨沂市蘭陵縣等大蒜種植主產區采集發病的植株樣品,將以上樣品保存于無菌采樣袋中,立刻到實驗室進行病原菌分離。
真菌固體培養采用馬鈴薯葡萄糖瓊脂培養基(PDA)、Ezup柱式真菌基因組DNA抽提試劑盒購于生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 菌株分離純化 采用常規組織分離法進行病原菌分離[10-11],取患根腐病的大蒜植株,流水沖洗根部30 min,75%乙醇浸泡1 min,3%次氯酸鈉浸泡2 min,無菌水漂洗5次,無菌濾紙吸干。取病健交界處用無菌刀切2 cm小段接種于PDA培養基,28 ℃培養5~7 d,挑取邊緣菌絲轉接純化。
1.2.2 菌株的致病性測定 斜面保存的菌株接種到PDA液體培養基中,28 ℃、160 r/min搖床培養 7 d,制成107個孢子/mL的孢子懸浮液,用于接種備用,裝有基質的組培瓶滅菌后備用。采集苗期大蒜植株,用流水沖洗20 min,乙醇消毒鱗莖和根部 1 min,無菌水沖洗5次,移栽到滅過菌的基質中,加入25 mL菌懸液灌根,對照組接無菌水培養,觀察接種后的發病情況。根據科赫法則,對發病的植株再次進行病原菌分離,并與原接種菌株進行比較。
1.2.3 菌株鑒定
1.2.3.1 形態觀察 將分離到的致病菌接種到PDA培養基上,28 ℃培養5 d后觀察菌落形態。挑取菌絲進行菌體顯微觀察,參照《真菌鑒定手冊》進行形態學鑒定[12]。
1.2.3.2 ITS序列分析 將純化培養好的菌株用真菌基因組DNA提取試劑盒進行提取。采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)進行擴增。PCR反應體系為:DNA模板0.5 μL,10×Buffer 2.5 μL,dNTP 1 μL,酶0.2 μL,上下游引物各0.5 μL,加雙蒸H2O至25 μL。反應條件:94 ℃預變性4 min,94 ℃ 變性45 s,55 ℃退火45 s,72 ℃延伸1 min,30個循環;72 ℃延伸10 min。PCR產物經1%瓊脂糖凝膠電泳檢測后,DNA 片段經膠回收試劑盒回收,將擴增產物送生工生物工程(上海)股份有限公司進行序列測定。
1.2.3.3 構建系統發育樹 從NCBI網站下載與待測菌株相似的序列,通過CLUSTAL_X (version 1.81)[13]進行序列比對,去除冗余序列。用鄰接法(neighbour-joining,NJ)[14]在MEGA 7.0[15]軟件中構建系統發育樹,設定值Bootstrap均為500次。
2 結果與分析
2.1 菌株分離純化結果
通過組織分離法從發病大蒜植株中分離到4株菌落形態特征不同的真菌菌株,依次編號為55R-1、BR917-3、JSS6、LZR,進一步分離純化培養后,進行菌落形態鑒定和分子生物學鑒定。
2.2 菌株致病性測定
采用科赫法則進行致病性驗證,將分離到的菌株重新接種到健康大蒜植株上。接種7 d后,分別接種不同病原菌分離物的植株均呈明顯干枯癥狀,根部呈腐爛狀(圖1)。對根部發病部位重新分離病原菌,分離結果與原接種真菌一致。根據科赫法則,證明接種的真菌55R-1、BR917-3、JSS6、LZR是引起大蒜根腐病的致病菌。
2.3 菌株鑒定
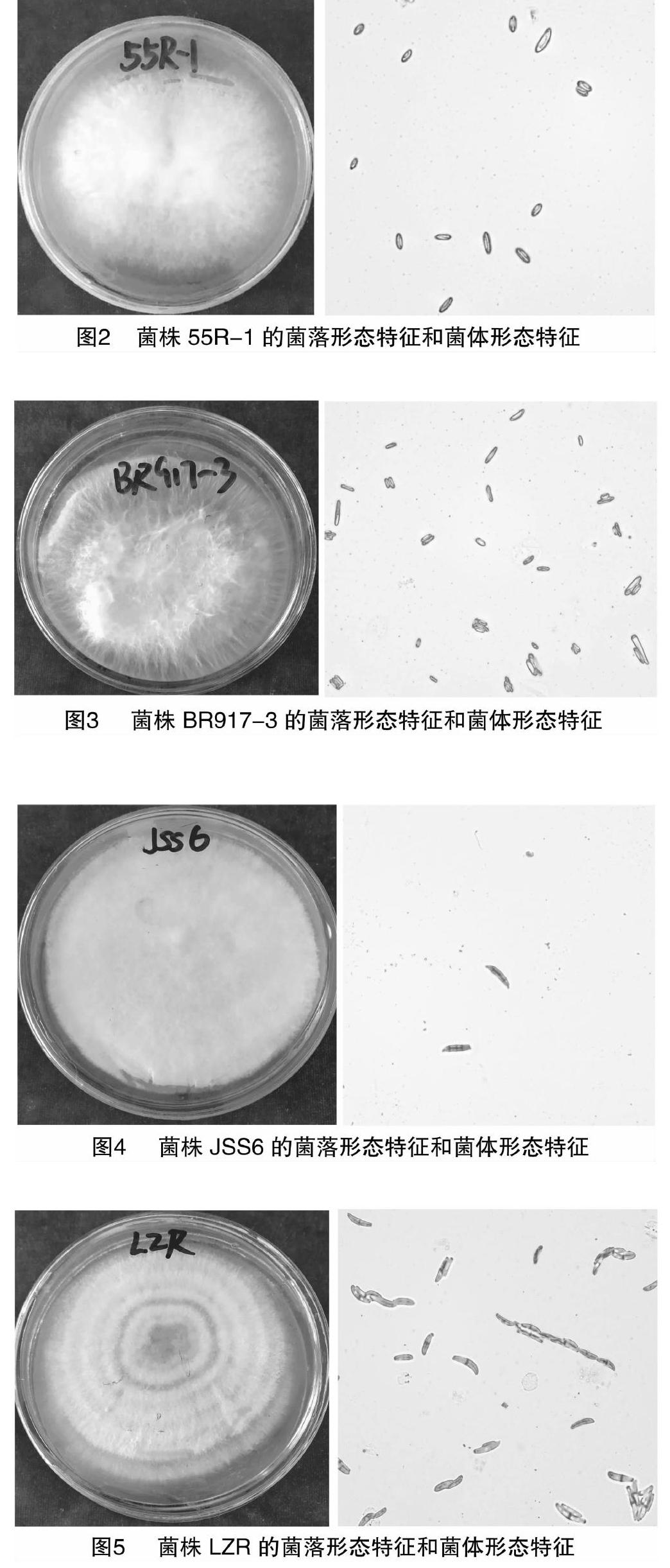
2.3.1 形態特征鑒定 菌株55R-1菌落顏色呈白色,菌落背面為淺黃色,生長速度中等,菌絲白色、絮狀、致密。大分生孢子紡錘形,有橫隔,1~3隔常見,小分生孢子棒槌形(圖2)。
菌株BR917-3菌落顏色呈白色,菌落背面呈黃色,中心區域菌絲隆起,絮狀茂盛,邊緣菌絲顏色稍暗。大分生孢子細長,鐮刀型或紡錘形,1~3 個隔膜,兩端細胞尖或稍彎,小分生孢子紡錘形或者橢圓形(圖3)。
菌株JSS6菌落顏色呈白色,菌落背面為土黃色。菌絲白色、密實、邊緣齊。小孢子長橢圓形,大孢子頂端漸尖,呈鐮刀狀,多數3隔(圖4)。
菌株LZR菌落呈同心環狀,初期顏色為淺白色,在生長后期中心圓環區呈土黃色,菌落背面黃色。大型分生孢子呈鐮刀型,1~3橫隔,小型分生孢子呈卵圓形或柱形,偶有橫隔(圖5)。
2.3.2 ITS序列分析 對PCR擴增產物采用瓊脂糖凝膠電泳進行檢測,電泳結果見圖6,擴增條帶大小在510~540 bp之間。
將4個菌株ITS序列進行Blast同源性分析,利用MEGA軟件構建系統發育樹,結果如圖7所示。菌株55R-1與芳香鐮孢菌(F. redolens)表現出最高相似度(100%)且聚在一支,結合菌落形態及顯微觀察結果,鑒定菌株55R-1為芳香鐮孢菌;菌株JSS6與木賊鐮孢菌(F. equiseti)的同源性最高,相似性100%且與該物種其他菌株均聚在一支,結合菌落形態及顯微觀察結果,鑒定菌株JSS6為木賊鐮孢菌;菌株BR917-3與尖孢鐮孢菌(F. oxysporum)的相似性最高(100%)且聚到一支,結合菌落形態及顯微觀察結果,鑒定菌株BR917-3為尖孢鐮孢菌;菌株LZR與腐皮鐮孢菌(F. solani)的其他菌株均聚到一支且表現出最高相似性(100%),結合菌落形態及顯微觀察結果,鑒定菌株LZR為腐皮鐮孢菌。
3 討論
近年來由于市場需求增大,大蒜種植盲目擴大生產,連作、病害、種質資源退化等已成為山東省大蒜生產的主要限制因素[16],尤其是土傳病害已嚴重制約和影響大蒜的產量提高和品質改善。張麗等研究表明,土傳病害的病原菌種類和數量與氣候、土壤類型及生物因子等密切相關[17]。前人對大蒜根腐病的致病菌進行了大量研究,但不同地域的研究者分離得到的病原菌卻不盡相同[16],可見不同區域大蒜根腐病的致病菌存在明顯差異。本研究從山東省3個地市4個縣(市、區)取樣大蒜根腐病病株,通過形態學和分子生物學鑒定均為鐮孢菌屬,分別為尖孢鐮孢菌、腐皮鐮孢菌、芳香鐮孢菌、木賊鐮孢菌,可見鐮孢菌屬是山東省大蒜主產區根腐病的致病菌。但從分離地理區域來看,不同地域所分離到的分離物種類存在明顯差別[18],究其原因可能與各縣(市、區)的地理位置、氣候因素和耕作制度等密切相關[11]。本研究的取樣區域多采取大蒜連作種植模式,該種植模式致使土壤地力下降,自身有毒物質不斷積累,造成微生物群落結構和優勢菌群發生明顯變化,加劇根腐病等土傳病害的發生[16],這與張麗娟等的研究結果類似[8]。
同一種屬不同種類的致病菌對根腐病的致病效果差異明顯,本研究通過對比尖孢鐮孢菌、腐皮鐮孢菌、芳香鐮孢菌、木賊鐮孢菌對大蒜根腐病的致病性發現,分離出尖孢鐮孢菌的植株根腐病較為嚴重,分離出腐皮鐮孢菌、芳香鐮孢菌、木賊鐮孢菌的植株根腐病較輕,可見尖孢鐮孢菌是該病害的主要致病菌。下一步筆者所在課題組將通過盆栽和大田試驗,進一步研究在不同生長時期尖孢鐮孢菌對大蒜根腐病的致病機制,同時開展針對該病害的抗病品種選育和種苗繁育工作,篩選高效防治藥劑[19],以期為防治山東省大蒜主產區根腐病提供理論依據和技術支撐。
4 結論
綜上,尖孢鐮孢菌、腐皮鐮孢菌、芳香鐮孢菌、木賊鐮孢菌均可導致山東省大蒜主產區大蒜根腐病的發生,尤其是尖孢鐮孢菌是該病害的主要致病菌。本研究能為開展山東省大蒜主產區根腐病病害的深入研究和防治工作奠定理論基礎,為解決大蒜根腐病識別及科學防治提供了一定的參考,對提高大蒜產量和改善大蒜質量意義重大。
致謝:中央級公益性科研院所基本科研業務費專項(161013201704)資助。
參考文獻:
[1]曹 琳,曹 東,陳存坤,等. 鮮剝大蒜種腐敗微生物的分離純化及鑒定[J]. 中國釀造,2017,36(9):123-126.
[2]鐘文文,劉婷婷,趙志龍,等. 山東省蒼山大蒜(Allium sativum)貯藏期新病原菌的分離與鑒定[J]. 安徽農業科學,2015,46(21):140-144.
[3]李旭雙,陳 典,梁 譽,等. 大蒜干腐病病原菌的分離鑒定[J]. 中國蔬菜,2012(20):88-93.
[4]何 祎,范龔健,吳彩娥,等. 邳州地區霉腐蒜頭致病性真菌的分離鑒定[J]. 生物技術,2019,29(3):267-271.
[5]程智慧,沈永杰. 大蒜紫斑病菌的分離及培養條件研究[J]. 西北農業學報,2008,17(2):274-278.
[6]穆向榮,馬逾英,楊枝中,等. 藥用植物根腐病防治的研究進展[J]. 中藥與臨床,2014,5(2):5-8.
[7]張 博, 李長松,李 林,等. 大蒜腐霉根腐病藥劑防治試驗[J]. 山東農業科學,2008(8):84-86,89.
[8]張麗娟,茆 軍,張志東,等. 新疆大蒜根腐型病害根際土壤微生物群落多樣性初探[J]. 新疆農業科學,2013,50(11):2109-2117.
[9]沙榮艷,徐紅霞. 地膜大蒜根腐病的發生及防治技術[J]. 長江蔬菜,2009,23:30-31.
[10]陳 龍,王 勇,李旭雙,等. 大蒜干腐病原菌分離鑒定及室內藥劑篩選[J]. 北方園藝,2015(6):110-113.
[11]蔣承歡,瞿鴻飛,王忠宇,等. 一種煙草細菌性病害病原菌分離培養及致病性測定[J]. 山東農業科學,2016,48(11):72-75.
[12]趙金梅,高貴田,谷留杰,等. 中華獼猴桃褐斑病病原菌鑒定及抑菌藥劑篩選[J]. 中國農業科學,2013,4(23):4916-4925.
[13]Thompson J D,Gibson T J,Plewniak F,et al. The CLUSTAL_X Windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research,1997,25(24):4876-4882.
[14]Zhang W,Sun Z R. Random local neighbor joining:a new method for reconstructing phylogenetic trees[J]. Molecular Phylogenetics and Evolution,2008,47(1):117-128.
[15]Kumar S,Stecher G,Tamura K. MEGA7:molecular evolutionary ?genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution,2016,33(7):1870-1874.
[16]謝玉清,張麗娟,茆 軍,等. 新疆地區根腐病大蒜根際土壤微生物群落特征研究[J]. 現代農業科技,2015(21):133-136.
[17]張 麗,耿肖兵,王春玲,等. 黑龍江省大豆鐮孢根腐病菌鑒定及致病力分析[J]. 植物保護,2014,40(3):165-168.
[18]張德珍,李鵬昌,陳曉霞,等. 山東省小麥根腐病病原菌的分離鑒定[J]. 植物保護學報,2016,43(2):233-240.
[19]王容燕,高 波,陳書龍,等. 河北省甘薯鐮孢菌腐爛與潰瘍病的病原鑒定[J]. 植物保護學報,2016,43(2):241-247.

