疏肝消脂方調(diào)控apoB48干預(yù)非酒精性脂肪性肝病的腸源性機制研究*
翟芬芬 王燕青 馮 楝 許林藝 江丹生 韓志毅 彭得倜 陳家碧 邢宇鋒△
1.深圳市福田區(qū)慢性病防治院 (廣東 深圳,518000) 2.深圳市中醫(yī)院肝病科 3.廣州中醫(yī)藥大學(xué)第四臨床醫(yī)學(xué)院
隨著肥胖癥和代謝綜合征在全球的流行以及病毒性肝炎疫苗的普及,非酒精性脂肪性肝病(NAFLD)已成為發(fā)達國家肝功能酶學(xué)異常和慢性肝病最常見的原因,NAFLD發(fā)病率明顯增加并且呈低齡化發(fā)展趨勢。NAFLD診斷依賴于組織學(xué),需除外由酒精及其他明確肝損害因素,其疾病譜包括單純性脂肪性肝病、脂肪性肝炎、肝硬化和肝細(xì)胞癌[1]。目前NAFLD的治療方法以改變生活方式、減肥[2]、胰島素增敏劑及抗氧化劑[3]、保肝藥[4]和益生菌[5]為主。單一使用針對某一發(fā)病機制的藥物無法治愈NAFLD,急需研發(fā)安全有效的治療藥物。
中醫(yī)藥在NAFLD的防治中具有極大的優(yōu)勢。課題組童光東教授基于數(shù)十年臨床經(jīng)驗,根據(jù)“肝病傳脾”“肝病實脾”理論,從氣郁為肝病的主要病機出發(fā),提出“氣郁—痰濕內(nèi)蘊化熱—致瘀”為NAFLD的病理機制,創(chuàng)立疏肝消脂方治療NAFLD。在本研究中,擬觀察疏肝消脂方對NAFLD模型大鼠腸道菌群多樣性和豐度、腸道屏障功能和腸道脂質(zhì)轉(zhuǎn)運功能的影響,研究其調(diào)節(jié)菌群失調(diào)、保護腸黏膜屏障、調(diào)節(jié)載脂蛋白的作用途徑,并探討其防治NAFLD可能的機制,為中醫(yī)藥防治NAFLD提供理論和實驗依據(jù)。
1 材料與方法
1.1 實驗動物 SPF級Wistar大鼠40 只,雌雄各半,體重(120±20)g,購自廣州中醫(yī)藥大學(xué)動物中心[合格證號:SYXK(粵)2013-0001],實驗方案已通過深圳市中醫(yī)院實驗動物倫理委員會審查。
1.2 藥物及試劑 疏肝消脂方:柴胡、枳實、桅子各10 g,炒白芍、白術(shù)各15 g,甘草5 g,茵陳、澤瀉、山楂、草決明、荷葉、海浮石各30 g,茯苓20 g等。本研究中藥采用免煎劑,由深圳華潤三九醫(yī)藥有限公司提供。BSA(A7906,Sigma);進口脫脂奶粉(M203,Amresco);蛋白分子量Marker(Invitrogen);RIPA裂解液(普利萊,P1053);蛋白酶抑制劑cocktail(11873580001,Roche);BCA蛋白定量試劑盒(23227,Thermo)。
1.3 實驗儀器 石蠟切片機(Leica,德國);Western blot轉(zhuǎn)膜電泳儀系統(tǒng)(Amersham,BioSciences);機械勻漿器(Fisher Scientific,125);恒溫振蕩器(培英,9211K);層析實驗冷柜(北京博儀康儀器有限公司,YC-1)。
1.4 實驗方法
1.4.1 動物分組 將40只大鼠隨機分為4組:正常組、高脂模型組、疏肝消脂方低劑量組和疏肝消脂方高劑量組。每組10只大鼠。
1.4.2 動物造模及給藥 以基礎(chǔ)飼料飼養(yǎng)正常組大鼠,其余三組以高脂飼料(膽固醇2%,膽酸鈉0.5%,丙硫氧嘧啶0.2%,蔗糖5%,豬油10%,基礎(chǔ)飼料82.3%)飼養(yǎng),誘導(dǎo)高脂模型[6],高脂飼料喂養(yǎng)8周后,隨機從每組中挑選5只大鼠做肝組織病理檢測,判斷動物模型是否成功。疏肝消脂方低劑量組和高劑量組分別予20、40 g/(kg·d)劑量,給予正常組和模型組用等體積蒸餾水灌胃。取材前1天禁食不禁水,第2天腹腔注射10%水合氯醛溶液麻醉大鼠,取小腸組織和新鮮糞便。
1.5 觀察指標(biāo)
1.5.1 各組大鼠腸道菌群豐度檢測 處死動物前,每組取新鮮大鼠腸糞標(biāo)本,每組取5個標(biāo)本。利用Illumina HiSeq測序平臺對16S rRNA V3、V3-V4和V6區(qū)域進行測序,對20個樣本的16S rDNA測序數(shù)據(jù)在初始數(shù)據(jù)、OTU、物種豐度和群落結(jié)構(gòu)水平進行常規(guī)分析。
1.5.2 各組大鼠小腸組織ZO-1、Occludin和SIgA蛋白表達檢測 采用免疫組化法檢測各組大鼠小腸組織中ZO-1、Occludin和SIgA蛋白表達情況。方法如下:取出固定于4%多聚甲醛溶液中的小腸組織,進行脫水、透明、浸蠟、包埋、切片處理,切片用二甲苯脫蠟,梯度乙醇脫水,3%過氧化氫處理25 min,蒸餾水洗滌2次(5 min/次),抗原熱修復(fù)15 min,PBS洗滌2次(5 min/次)。切片與ZO1、Occludin和SIgA抗體在室溫下孵育2 h,與Envision二抗(Abcam, Cambridge, UK)在37℃孵育30 min,PBS洗滌2次(5 min/次),用新鮮配制的DAB液沖洗。用流水終止染色。進一步與蘇木精染色4 min,水洗后,加入1%鹽酸乙醇,返藍(lán)后流水沖洗15 min。梯度乙醇脫水,二甲苯透明處理,用中性膠密封,顯微鏡下觀察。
1.5.3 各組大鼠小腸組織apoB48蛋白表達檢測 采用Western blot法檢測各組大鼠小腸組織apoB48蛋白表達情況。方法如下:每組隨機抽取5只大鼠,取小腸組織作為樣本,勻漿后取上清,測定蛋白濃度,經(jīng)過上樣、電泳、轉(zhuǎn)膜、一抗孵育、二抗孵育、發(fā)光、膠片顯影后,經(jīng)掃描儀掃描取圖。
2 結(jié)果
2.1 疏肝消脂方對大鼠腸道菌群的影響 對新鮮糞便標(biāo)本進行腸道微生物檢測,并進行PCA和聚類分析。結(jié)果表明(如圖1B所示),模型組與正常組腸道微生物群落結(jié)構(gòu)有顯著性差異。高劑量組和低劑量組與正常組結(jié)構(gòu)相似。如圖1A、C所示,模型組腸道菌群中乳酸菌科、產(chǎn)堿桿菌科和卟啉單胞菌科的相對豐度顯著降低,而螺旋菌科、擬桿菌科、消化鏈球菌科和產(chǎn)堿桿菌的相對豐度顯著提高。疏肝消脂方處理后,大鼠螺旋菌科、擬桿菌科、弧菌科的相對豐度降低,卟啉單胞菌科的相對豐度顯著升高。
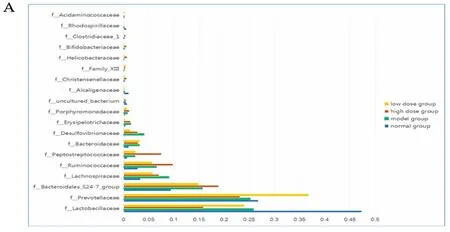
圖1 疏肝消脂方調(diào)節(jié)腸道微生物組成和多樣性情況圖 (A.多樣本物種分類圖;B.物種豐度分布Heatmap圖;C.PCoA分析圖)
2.2 疏肝消脂方對大鼠腸道黏膜屏障的影響 與正常組相比,模型組腸緊密連接蛋白ZO-1、Occludin表達水平顯著降低(P<0.05),SIgA表達水平顯著升高(P<0.05)。高、低劑量組ZO-1、Occludin蛋白水平明顯高于模型組(P<0.05),SIgA表達明顯低于模型組(P<0.05)。見表1、圖2。
表1 不同實驗組對大鼠腸道黏膜屏障功能相關(guān)蛋白表達的影響

圖2 各組大鼠小腸病理圖 (免疫組化染色,200×)
2.3 對腸道脂質(zhì)轉(zhuǎn)運蛋白apoB48蛋白的影響 與正常組相比,模型組apoB48蛋白表達水平顯著增加(0.493±0.040vs0.164±0.003,P<0.01);與模型組相比,高劑量組apoB48蛋白水平明顯降低(0.186±0.005vs0.493±0.040,P<0.01),低劑量組apoB48蛋白水平(0.464±0.012)未見明顯變化。見圖3。
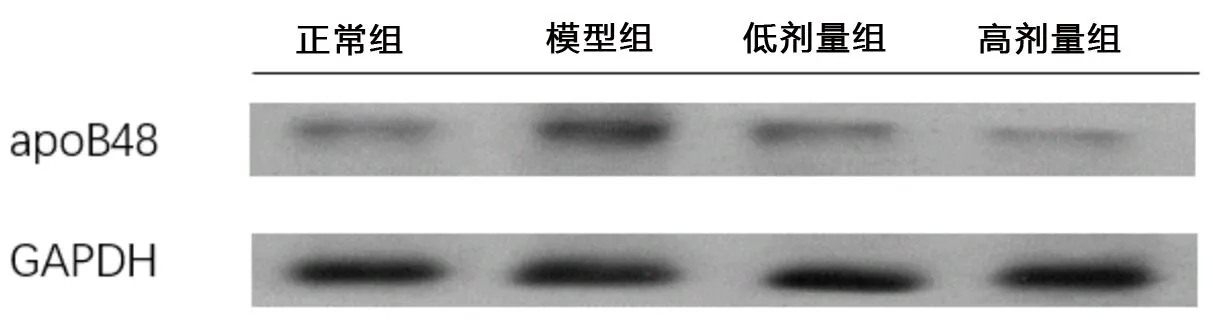
圖3 各組大鼠小腸組織apoB48蛋白表達情況
3 討論
NAFLD病理主要表現(xiàn)為脂肪顆粒沉積于肝臟,肝細(xì)胞發(fā)生氣球樣變,炎性細(xì)胞增多并浸潤肝臟組織,是全身性代謝綜合征在肝臟組織中的表現(xiàn)。NAFLD雖為良性疾病,但它有可能發(fā)生肝臟纖維化,進而發(fā)生肝硬化甚至肝癌。
腸道和肝臟在胚胎時期有共同的起源——前腸,腸道淋巴細(xì)胞起源于發(fā)育中的肝臟,這種組織的同源性決定了肝臟和腸道組織在生理病理過程中密切相關(guān)。門靜脈將兩個器官從解剖學(xué)上緊密聯(lián)系。在腸道屏障功能受損時,腸道內(nèi)細(xì)菌和內(nèi)毒素大量進入門靜脈系統(tǒng)。內(nèi)毒素激活肝臟內(nèi)的巨噬細(xì)胞(枯否細(xì)胞)釋放一系列促炎細(xì)胞因子,炎癥介質(zhì)介導(dǎo)肝臟組織損傷。研究發(fā)現(xiàn)NAFLD患者攝入過多脂質(zhì),腸道內(nèi)菌群結(jié)構(gòu)因此發(fā)生改變,內(nèi)毒素產(chǎn)生增加,加速肝臟內(nèi)甘油三酯的合成,失衡的腸道菌群降低分布于外周脂肪組織和肝臟細(xì)胞中腺苷酸活化蛋白激酶(AMPK)活性,脂肪酸氧化減少,脂代謝發(fā)生紊亂[7]。腸道菌群與血清炎癥因子水平顯著相關(guān)[8,9]。有研究[10]發(fā)現(xiàn)胃癌脾胃虛弱證患者舌苔卟啉單胞菌科與血清白介素-6水平呈負(fù)相關(guān)。調(diào)節(jié)腸道菌群已成為治療NAFLD的新靶點[11]。
apoB48的表達與高脂血癥密切相關(guān),apoB48特異性表達于小腸上皮細(xì)胞,僅由小腸上皮細(xì)胞合成,是甘油三酯(TG)的載脂蛋白[12]。TG與apoB48 結(jié)合成乳糜微粒(CM),通過淋巴循環(huán)進入體內(nèi)。NAFLD 患者存在小腸細(xì)菌過度生長(SIBO)和腸粘膜通透性改變現(xiàn)象。腸粘膜完整性的保持極大程度依賴于腸道上皮細(xì)胞之間的緊密連接。Occludin、claudin-1和ZO-1作為緊密連接的重要組成部分,組成腸道的機械屏障。這些蛋白可以特異性反映小腸組織緊密連接的完整性,可以通過控制緊密連接的通透性參與上皮屏障功能的調(diào)控[13,14]。研究發(fā)現(xiàn),NAFLD患者腸粘膜通透性增高,腸粘膜上皮緊密連接縮短,緊密連接蛋白Occludin、ZO-1明顯表達減少[15]。因此從腸道菌群多樣性和豐度、腸道屏障功能和腸道脂質(zhì)轉(zhuǎn)運功能入手,開展NAFLD脂質(zhì)過載誘發(fā)腸道微生態(tài)紊亂-腸粘膜屏障障礙-內(nèi)毒素異位-肝臟炎癥損傷機制研究具有重要意義。
前期研究證明,疏肝消脂方能改善NASH患者的臨床癥狀,降低非酒精性脂肪性肝炎(NASH)大鼠TG、膽固醇(TC)、游離脂肪酸(FFA)、血漿黏度值和AST水平[16]。同時,疏肝消脂方降低NASH大鼠肝組織TG、TC指數(shù),上調(diào)過氧化物酶體增殖劑激活受體α(PPARα)、下調(diào)固醇調(diào)節(jié)元件結(jié)合蛋白-1c(SREBP-1c)基因的表達,調(diào)節(jié)肝內(nèi)脂肪酸代謝,增加脂肪酸β氧化,從而減輕肝臟脂肪沉積程度[17]。
本研究發(fā)現(xiàn),疏肝消脂方低、高劑量組大鼠微生物代謝相關(guān)菌群均顯著減少,小腸緊密連接變長,腸粘膜通透性降低,提示疏肝消脂方能有效改善NAFLD大鼠腸道菌群失調(diào),改善小腸機械屏障和免疫屏障。同時,不同劑量疏肝消脂方可明顯降低apoB48蛋白表達,這表明,疏肝消脂方可能通過下調(diào)apoB48蛋白的表達,從而調(diào)節(jié)腸道菌群和小腸屏障功能,這可能是其治療NAFLD的機制之一,但還需進一步探討。

