尿素氮/肌酐比值對于非ST段抬高急性冠脈綜合征患者經皮冠狀動脈介入治療后對比劑腎病的預測價值
張昭 王仁學 毛琳霜 凌維維 吳丹 姜子超 劉康 錢賡
(1.中國人民解放軍總醫院海南醫院心血管內科,海南 三亞 572014; 2.中國人民解放軍總醫院第一醫學中心心血管內科,北京 100853)
隨著現代醫療技術的發展,心血管疾病的診斷與治療越來越多地應用放射技術和介入治療技術,造影劑使用量增加的同時,對比劑腎病(contrast induced nephropathy,CIN)的發病率也在升高。CIN是急性醫源性腎損傷的第3位最常見原因[1],增加了院內死亡率、致殘率、住院時間和醫療花費,也可增加患者發生慢性腎功能不全、心血管事件和腦卒中等并發癥的風險。CIN的病理生理機制及最佳治療方案尚未完全研究清楚,因此早期識別高危患者,預防CIN的發生十分重要。水化治療之所以是CIN預防的關鍵措施,在于充分水化可使患者血容量穩定,有效增加腎臟灌注,增加尿量并有效減少腎實質缺血的發生。低容量狀態是CIN的非常重要的危險因素之一[2],尿素氮/肌酐(blood urea nitrogen/creatinine,BUN/Cr)與人體容量平衡有密切的關系,廣泛應用于臨床以鑒別腎前性和腎實質性疾病,BUN/Cr比值的升高往往提示患者有效血容量不足。目前對BUN/Cr和CIN的相關性研究較少,因此本研究的目的在于分析BUN/Cr與CIN發生的相關性,探討術前高BUN/Cr水平對于CIN的預測價值,為臨床提供參考。
1 資料與方法
1.1 一般資料
連續選取2014年1月—2016年9月于中國人民解放軍總醫院心血管內科住院行經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)的患者。納入標準:急性冠脈綜合征患者(包括不穩定性心絞痛及非ST段抬高心肌梗死),心電圖有明確缺血證據(胸前或肢體導聯ST段壓低>0.1 mV,且有動態變化),年齡18~90歲,擇期行PCI,術中采取球囊擴張術或冠狀動脈支架植入術,術后第一天及第三天常規復查過血肌酐水平。排除標準:急性ST段抬高心肌梗死;造影劑過敏;術前腎功能衰竭(腎小球濾過率<30 mL/min);罹患惡性腫瘤;急慢性感染;血液透析治療中;近一周內使用過造影劑。本研究經中國人民解放軍總醫院倫理委員會審議并批準。
1.2 定義及診斷標準
(1)高血壓診斷標準:在未使用抗高血壓藥的情況下,非同日3次測量診室血壓,收縮壓≥140 mm Hg(1 mm Hg=0.133 3 kPa)和/或舒張壓≥90 mm Hg;既往有高血壓史,目前正在使用抗高血壓藥,血壓雖然低于140/90 mm Hg,仍應診斷為高血壓;家庭自測血壓≥135/85 mm Hg;動態血壓:白天平均值≥135/85 mm Hg,夜間平均值≥120/70 mm Hg或24 h平均值≥130/80 mm Hg。(2)糖尿病診斷標準:多飲、多尿和不明原因的體重減輕,且隨機靜脈血漿葡萄糖≥11.1 mmol/L,隨機血糖濃度為餐后任意時間的血糖濃度;空腹靜脈血漿葡萄糖≥7.0 mmol/L,空腹禁止攝入熱量8 h以上;患者無明顯的糖尿病癥狀,餐后或空腹隨機靜脈血漿葡萄糖均未達到標準,用75 g無水葡萄糖的水溶液進行口服糖耐量試驗后2 h靜脈血漿葡萄糖≥11.1 mmol/L。(3)貧血診斷標準:在海平面地區,成年男性血紅蛋白<120 g/L,成年女性血紅蛋白<110 g/L。(4)CIN診斷標準:使用造影劑后48~72 h內血肌酐上升超過44 μmol/L(0.5 mg/dL)或較基礎值上升>25%,并除外其他腎臟損害因素。(5)低血壓的定義:收縮壓<90 mm Hg至少1 h或需要使用藥物升壓或主動脈內球囊反搏支持。(6)高BUN/Cr的定義:BUN(mg)=mmol/L×2.8,Cr(mg)=μmol/L÷88.4,換算成統一單位(mg)后,高BUN/Cr定義為BUN/Cr>20,高BUN/Cr提示患者可能存在腎前性功能障礙。
1.3 方法
1.3.1 資料收集
收集所有研究對象的一般資料,包括性別、年齡、身高、體重指數(BMI)和既往病史包括糖尿病史、高血壓病史等;以及患者術前的抽血檢測結果:血常規、心肌酶、血糖、肝腎功能和血脂水平。收集術前心電圖和心臟彩超的基本資料等。冠狀動脈造影結果分析:冠狀動脈造影結果由2個相互獨立的不參與本研究的心臟介入醫師完成,在造影過程中造影劑的使用劑量根據術中的具體情況記錄。
1.3.2 Mehran評分計算
評分方法為:低血壓、行主動脈內球囊反搏和充血性心力衰竭(心衰)各計5分,年齡>75歲計4分,貧血和糖尿病各計3分,每用100 mL造影劑計1分,血清肌酐>133 μmol/L(1.5 mg/dL)計4分或腎小球濾過率估算值(eGFR):40~60 mL/(min·1.73 m2)計2分,20~40 mL/(min·1.73 m2)計4分,<20 mL/(min·1.73 m2)計6分。計算8個變量的總分,根據總分分為低危(≤5分)、中危(6~10分)、高危(11~15分)和極高危(≥16分)[3]。
1.3.3 統計學方法

2 結果
2.1 一般情況基線
所有入組急性冠脈綜合征患者一共1 163例,其中男863例,女性300例,最大89歲,最小18歲,平均(61.52±11.46)歲,其中非ST段抬高心肌梗死患者共281例(24.2%),不穩定型心絞痛患者共882例(75.8%)。入組患者中高血壓患者773例,糖尿病患者共562例。冠狀動脈造影結果發現三支病變患者共355例(30.5%)。根據術后監測的血肌酐結果分析,CIN患者共102例(8.77%)。
2.2 CIN組與非CIN組基本臨床資料的比較
兩組臨床資料比較,年齡、男性、身高、體重、BMI、造影劑使用量、貧血、高血壓、糖尿病、術前肌酐以及尿素氮無顯著差異,差異無統計學意義(P>0.05)。CIN組與非CIN組相比較,低血壓及高脂血癥的患者比例明顯升高,CIN組心臟射血分數明顯下降,心衰患者的比例明顯升高(P<0.05),CIN組患者中BUN/Cr>20的比例明顯高于非CIN組(50.00% vs 34.68%,P=0.002),結果見表1。
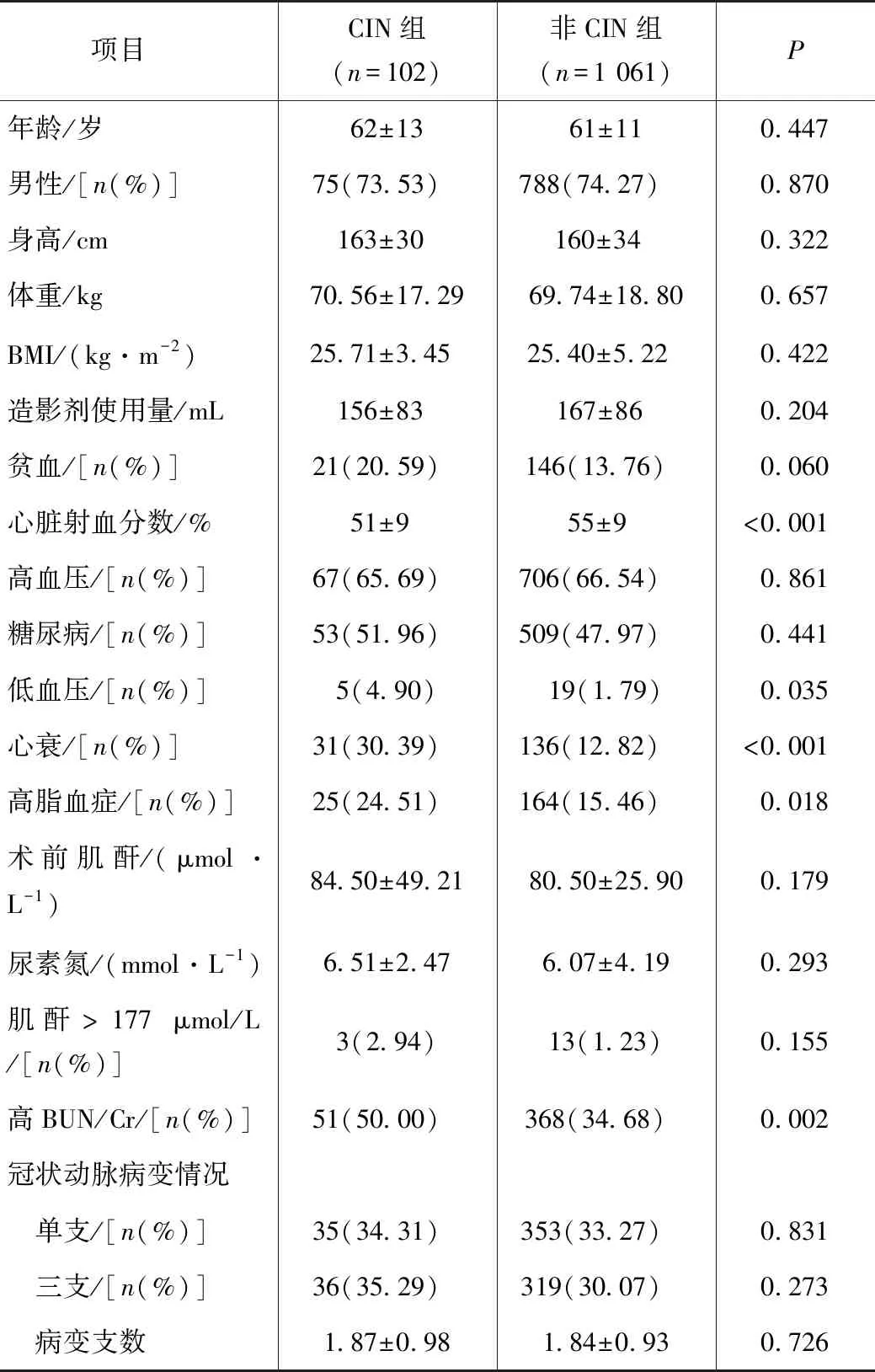
表1 CIN組與非CIN組基本臨床資料的比較
2.3 影響冠心病患者PCI術后發生CIN的獨立危險因素
將體重、年齡、高脂血癥、糖尿病、造影劑使用劑量、高BUN/Cr、貧血、是否存在心衰、低血壓和血肌酐>177 μmol/L(2 mg/dL)等納入多因素回歸分析模型。多因素logistic回歸分析顯示,高BUN/Cr(OR=2.018,95%CI1.241~3.284,P=0.005)是發生CIN的獨立危險因素。此外心衰(OR=2.652,95%CI1.548~4.544,P<0.001)、血肌酐>177 μmol/L(OR=3.897,95%CI1.021~14.876,P=0.047)和高脂血癥(OR=2.652,95%CI1.572~4.471,P<0.001)也是發生CIN的獨立危險因素。結果見表2。
2.4 ROC曲線分析高BUN/Cr對患者CIN發生的預測價值
通過ROC曲線分析Mehran評分預測CIN的曲線下面積(AUC)為0.612(95%CI0.583~0.640,P<0.001),高BUN/Cr替換貧血納入評分模型預測CIN的AUC為0.635(95%CI0.607~0.663,P<0.001)(圖1)。經Z檢驗,Z=1.455,P=0.145 7,其AUC并無統計學差異(P>0.05),見圖1。
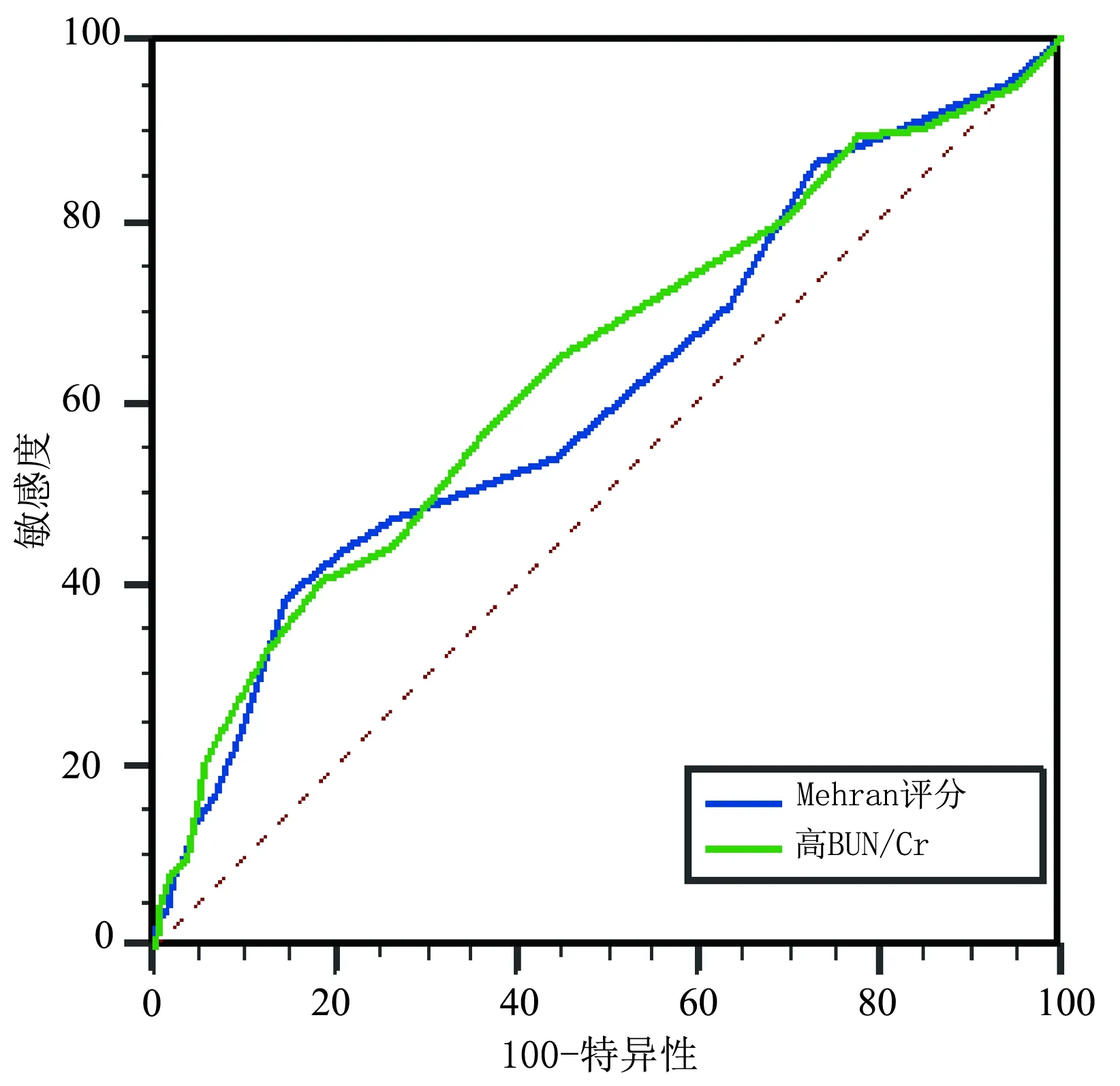
圖1 高BUN/Cr和Mehran評分對CIN預測價值的ROC曲線圖
3 討論
CIN是指患者應用造影劑后新發生的、未發現其他原因的急性腎損傷,在造影劑使用后48~72 h內,血肌酐水平上升超過44 μmol/L(0.5 mg/dL)或基礎值上升>25%,多數患者血肌酐在2周內逐漸恢復至基線值,少數患者可遺留腎功能損害,需進行血液透析治療[4]。與CIN有關的最常見的操作是冠狀動脈血管造影術和/或血管成形術以及計算機斷層掃描[5]。本研究中1 163例患者中有102例發生CIN,發生率為8.77%。CIN的病理生理機制可能是由于造影劑對腎小管的直接毒性作用,腎內血管收縮導致的腎實質缺血以及腎小管梗阻等[6]。目前尚無CIN的完美治療方案,因此掌握其發生的高危因素,盡早采取預防措施是十分必要的。目前臨床上預防CIN的措施有水化療法,使用N-乙酰半胱氨酸、他汀類藥物、低滲及等滲造影劑等[7-8]。

表2 CIN的單因素和多因素回歸分析結果
CIN的危險因素分為內源性和外源性,既往研究顯示,低血容量是CIN的一個重要的外源性獨立危險因素[9],術前容量不足的患者行PCI術后發生CIN的風險明顯升高。其可能的機制為:腎臟血流灌注減少,腎素-血管緊張素-醛固酮系統以及交感神經系統被激活,腎血管收縮,造成腎臟進行性缺血,而持續的腎實質缺血會導致氧自由基和活性氧的生成,損傷腎小管上皮細胞[10],上皮細胞壞死脫落形成管型,造成腎小管堵塞,腎小球濾過率下降,造影劑排泄減慢,在腎小管內停留的時間延長,對腎小管細胞的直接毒性作用增強;此外腎血管收縮還會促進平滑肌增生,發生腎間質的纖維化,導致腎功能減退[11]。目前水化療法是臨床上廣泛使用的預防措施,經濟、高效、易推廣、無創指導下的個體化水化預防策略還在探索研究中,通過充分水化擴張容量,糾正血流動力學紊亂,增加腎臟血流灌注,改善腎髓質組織缺血狀態,減輕造影劑對腎組織的直接損傷。此外,還可抑制腎素-血管緊張素系統活化,減少抗利尿激素的產生,增加尿量促進造影劑排泄,縮短腎小管上皮細胞暴露于造影劑的時間[12]。針對患者個體情況實行個體化水化預防方案能有效降低CIN發生率,如術前測量左室舒張末壓引導水化,中心靜脈壓指導給藥和生物阻抗引導水化等[10]。
貧血、低血壓、酸中毒和BUN/Cr≥20等指標可有效地提示機體處于血容量不足的狀態,目前已有研究證實貧血和低血壓是CIN發生的危險因素[13],但對于BUN/Cr與CIN的相關性研究較少,因此本研究探討BUN/Cr對CIN的早期預測價值。BUN/Cr已被廣泛應用于臨床醫學,其標本容易獲得,檢測簡單易行,對腎前性和腎實質性疾病有很高的鑒別價值,當血容量不足時,腎小管對尿素的吸收率增加,尿素排泄率下降的程度與腎小球濾過率下降的程度不平行,最終導致BUN/Cr的升高[14]。本研究以BUN/Cr≥20作為節點,將患者分為高BUN/Cr組和對照組,發現高BUN/Cr組發生CIN的比例明顯高于對照組,而CIN組患者高BUN/Cr比例明顯高于非CIN組;單因素及多因素logistic回歸分析顯示,高BUN/Cr是PCI術后發生CIN的獨立危險因素,其對CIN的預測價值優于傳統貧血指標。對術前高BUN/Cr的患者,應針對其可能存在的低容量狀態,積極給予水化和其他穩定容量的治療措施,有效預防CIN的發生。
本研究也發現心衰、高脂血癥為CIN的獨立危險因素。心臟與腎臟的功能有著緊密的聯系,心衰患者心臟輸出量減少,腎臟由于灌注不足發生缺血性損傷,同時體循環瘀血也會導致腎靜脈瘀血而加重腎損傷[11],在造影劑的協同作用下,進一步發展為CIN。高脂血癥是血脂代謝紊亂引起血漿中某一類或某幾類脂蛋白水平升高的代謝性疾病。有研究證明高脂血癥可引起腎間質損傷[15],高膽固醇血癥會導致腎血流動力學改變,其均增加了PCI術后發生CIN的風險。
目前臨床上用于評估患者行PCI術后發生CIN風險的有Mehran評分,根據Mehran評分,1 163例患者中CIN低危、中危、高危和極高危分別為752、324、78和9例,發病率在低危、中危、高危和極高危組中分別為6.78%、10.49%、17.95%、和33.33%,發病率隨著危險程度的升高而隨之升高。將高BUN/Cr替換貧血指標納入評分系統中時,1 163例患者中CIN低危、中危、高危和極高危分別為626、414、109和14例,發病率在低危、中危、高危和極高危組分別為5.75%、9.42%、20.18%和35.71%,發病率也隨著危險程度的升高而隨之升高。ROC曲線分析顯示,高BUN/Cr代入CIN評分系統后,改良的Mehran評分系統對CIN的預測價值高于原本Mehran評分系統,但考慮到Mehran風險評分是基于大量病例的,所以高BUN/Cr的預測價值還需進一步研究。
本研究的局限性有:(1)研究為單中心回顧性臨床研究,因此研究的病例可能存在人群限制,需更大的樣本量來檢驗高BUN/Cr對CIN的預測價值;(2)進行多因素logistic回歸分析時仍有可能存在其他混雜因素;(3)本研究只研究了患者住院期間的高BUN/Cr,并未觀察該指標是否對患者的遠期預后仍有預測價值。
綜上所述,本研究結果初步證明高BUN/Cr患者PCI術后發生CIN的風險更高,高BUN/Cr可作為早期識別CIN高危患者的一項指標。

