椰子吸器多糖的結構和體外生物學活性分析
張玉鋒,陳穎嫻,溫遠芬,唐敏敏,宋 菲,朱婷婷,張有林
(1.中國熱帶農業科學院椰子研究所,國家重要熱帶作物工程技術中心(椰子研發部),海南省椰子深加工工程技術研究中心,海南文昌 571339;2.陜西師范大學食品工程與營養科學學院,陜西西安 710119;3.海南熱帶海洋學院食品科學與工程學院,海南三亞 572022)
椰子(Cocos nciferaL.)是棕櫚科椰子屬單子葉植物,與油棕、油茶和油橄欖并稱“世界四大木本油料植物”,廣泛分布于世界上90 多個國家和地區,享有“生命之樹”的美譽[1]。海南是我國椰子主產區,種植面積和產量均占全國的95%以上。全省椰子加工產品達200 多種,年產值超200 億元,是重點發展的“三棵樹”(椰子、檳榔和橡膠)產業和熱帶特色高效農業之一[2]。而產業的快速發展,也意味椰子水、椰蓉、椰粕等加工副產物的大量產生。這些副產物目前多作為動物飼料、堆肥或食品輔料使用,精深加工利用途徑和技術基本處于空白。這不僅造成了資源浪費,還存在環境污染風險,同時也不利于產業的健康發展。
吸器是椰子萌發過程中由胚發育成的海綿狀吸收器官[3],能分泌出高活性的脂肪酶、纖維素酶和蛋白酶等,從椰子水和發育后期的胚乳中吸收營養,供給胚胎發育[4],在海南本地被稱為“椰寶”“椰子餅”,是椰子加工副產物之一。國內外關于吸器的相關研究還較少,主要集中在萌發過程中微觀結構、形態特征、基本成分變化等方面[5?8],如李靜等[9?10]分析了海南本地高種椰子吸器萌發過程中的超氧化物歧化酶(SOD)、過氧化物酶(POD)活性、可溶性蛋白和多酚含量的變化規律。Arivalagan 等[11]用不同添加量的椰子吸器粉末(0%、10%、20%和30%)替代大米和玉米粉制備了不同類型膨化食品,并探究了吸器添加量對產品理化性質、感官特性和功能活性的影響。尚未見到吸器多糖的有關報道。因此,本文擬以椰子吸器為原料,利用水提醇沉法提取粗多糖,并初步分析其體外抗氧化和降糖酶抑制活性,以期能為吸器的開發利用提供新的思路和支持。
1 材料與方法
1.1 材料與儀器
新鮮椰子吸器 由海南文昌東郊椰正道椰子加工專業合作社提供;α-葡萄糖苷酶(≥10 units/mg 蛋白質)、α-淀粉酶(≥5 units/mg 固體)、單糖標準品(包括巖藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、果糖和半乳糖醛酸,均為色譜級,純度>98%)購自美國Sigma 公司;對硝基苯基-β-D-吡喃半乳糖苷(pNPG)、碳酸鈉、葡萄糖、無水乙醇、硫酸、1,1-二苯基-2-三硝基苯肼(DPPH)等試劑 均為分析純。
UV-1600 型紫外可見分光光度計 翱藝儀器(上海)有限公司;DAWN HELEOS-II 18 角度激光光散射儀 美國懷雅特公司;Shodex Ohpak SB-806M HQ 色譜柱(8.0 mm×300 mm,13 μm) 日本昭和電工株式會社;Nicolet 67 傅里葉紅外光譜儀 美國賽默飛世爾公司;ICS-3000 離子色譜儀 美國戴安公司。
1.2 實驗方法
1.2.1 吸器多糖的制備 新鮮椰子吸器去除表面殘留物等雜質,用蒸餾水洗滌后,切成0.2 cm 左右的薄片,60 ℃鼓風干燥至恒重,粉碎后過80 目篩,得吸器粉末。參考趙小龍等[12]的方法稍作修改后提取吸器多糖。取適量粉末,按1:40 料液比(m:v,g:mL)加入蒸餾水,50 ℃震蕩水浴提取5 h 后,4000 r/min離心20 min,收集上清液,45 ℃真空濃縮至上清液體積的1/4 后,加入四倍體積的無水乙醇,4 ℃沉淀24 h,取沉淀真空冷凍干燥,得到吸器多糖,密封于?20 ℃保存,備用。
1.2.2 吸器多糖的化學組成分析 椰子吸器多糖的主要化學成分包括中性糖、糖醛酸和蛋白質,分別用硫酸-蒽酮法[13]、咔唑-硫酸法[14]和考馬斯亮藍法[15]測定含量。
1.2.3 吸器多糖的單糖組成 取樣品10 mg 于水解管中,加入4 mol/L 的三氟乙酸4.0 mL,充氮1 min排出管內空氣,旋緊螺旋蓋,于120 ℃水解2 h,待冷卻后氮氣吹干水解液,除去過量的三氟乙酸,加超純水定容至10 mL。稀釋20 倍,并用0.2 μm 濾膜過濾后,取濾液20 μL 分析單糖組成。色譜條件:流動相A 為水,B 為250.0 mmol/L 的氫氧化鈉,C 為1.0 mol/L 的乙酸鈉;流速0.5 mL/min;進樣體積10 μL;柱溫:35 ℃;洗脫條件為0~20 min,94% A 和6% B;20~20.1 min,89% A、6% B 和5% C;20.1~35 min,74% A、6 % B 和20% C;35.1~45 min,20% A 和80% B;45.1~55min,94% A 和6% B。
1.2.4 吸器多糖的分子量測定 配制1 mg/mL 的樣品溶液,過0.22 μm 濾膜后,用測定多糖的分子量。色譜條件為:流動相為0.1 mol/L 氯化鈉,流速為0.5 mL/min,上樣量為200 μL,柱溫25 ℃。分別采用高效體積排阻色譜(HPSEC)廣譜校正及其串聯的多角度激光光散射的標準方法對多糖的分子量(Mw)及其分布進行分析。
1.2.5 傅里葉紅外光譜(FIIR)分析 將樣品粉末與KBr 按照1:100 質量比混勻,壓成薄片,測定波數范圍為4000~400 cm?1。
1.2.6 吸器多糖的體外生物學活性測定
1.2.6.1 DPPH 自由基清除能力 參考王杰等[16]的方法,并稍作修改。將0.2 mL 不同濃度的樣品溶液與0.2 mL 的DPPH 溶液(0.2 mmol/L)充分混勻后,于37 ℃避光反應30 min,取反應液在517 nm 處測吸光值。以Vc 陽性對照。DPPH 自由基清除率按下式計算:

式中A0、A1、A2和A3分別表示蒸餾水和無水乙醇混合的空白組、樣品組、無水乙醇替代DPPH 溶液的樣品空白組和蒸餾水替代樣品的對照組的吸光值。
1.2.6.2 羥自由基清除能力測定 參考王杰等[16]的方法,并稍作修改。將0.2 mL 不同濃度的樣品溶液依次和0.2 mL 的FeSO4溶液(6 mmol/L)、0.2 mL的水楊酸溶液(6 mmol/L)以及0.2 mL 的H2O2溶液(6 mmol/L)混合均勻,室溫靜置反應1 h 后,在510 nm處測定反應液的吸光值。以Vc 作陽性對照。羥自由基清除率按下式計算:
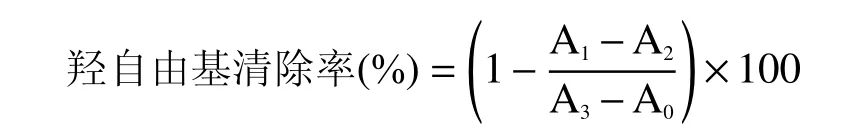
式中A0、A1、A2和A3分別表示蒸餾水和無水乙醇混合的空白組、樣品組、以蒸餾水替代H2O2溶液的樣品空白組和以蒸餾水替代樣品的對照組的吸光值。
1.2.6.3 還原力的測定 參考錢海峰等[17]的方法,并稍作修改。將1.0 mL 不同濃度的樣品溶液與0.1 mL磷酸鹽緩沖液(pH 6.6)、0.1 mL 鐵氰化鉀溶液(1%)混合均勻,于50 ℃水浴20 min 后,向反應體系中加入0.1 mL 三氯乙酸(10%),混勻后,迅速冷卻至室溫;然后取0.1 mL 反應混合液,依次加入0.2 mL 三氯化鐵(0.1%)和1.0 mL 蒸餾水,并在700 nm 處測吸光值。以0.1 mL 蒸餾水代替鐵氰化鉀為樣品對照,以Vc 作陽性對照。還原力以吸光值大小表示,吸光值越大,還原力越強。
1.2.7 吸器多糖的降糖酶抑制活性測定
1.2.7.1α-淀粉酶抑制活性的測定 參考朱嬌嬌等[18]的方法,并稍作修改。將0.1 mL 不同濃度的樣品溶液與0.1 mLα-淀粉酶(1 U/mL,用含有6.7 mmol/L氯化鈉的pH6.8 磷酸鹽緩沖液配制)混合,37 ℃水浴10 min 后;加入0.1 mL 淀粉溶液(1%)并混勻,37 ℃水浴10 min;加入3,5-二硝基水楊酸(DNS)試劑0.2 mL,沸水浴5 min,迅速冷卻至室溫,加入2.0 mL蒸餾水,于540 nm 處測定反應液的吸光值。以阿卡波糖作陽性對照。α-淀粉酶抑制率的計算公式如下:
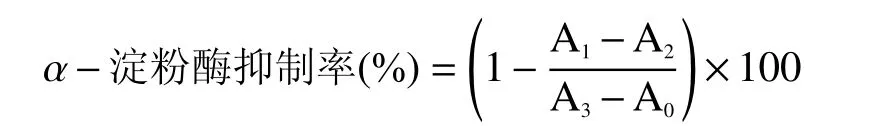
式中A0、A1、A2和A3分別表示以磷酸鹽緩沖液替代樣品和酶液的空白組、樣品組、以磷酸鹽緩沖液替代酶液的樣品空白組和以磷酸鹽緩沖液替代樣品的對照組吸光值。
1.2.7.2α-葡萄糖苷酶抑制活性的測定 參考鐘麗霞等[19]的方法,并稍作修改。將0.2 mL 不同濃度的樣品溶液與0.2 mLα-葡萄糖苷酶(0.05 U/mL,用0.1 mol/L 的pH6.8 磷酸鹽緩沖溶液配制)混勻,37 ℃水浴5 min 后; 加入0.1 mL PNPG 溶液 (濃度為0.5 mmol/L,用0.1 mol/L PBS 配制),37 ℃水浴30 min;再加入0.25 mL Na2CO3溶液(0.2 mol/L)終止反應,室溫靜置5 min 后,于405 nm 處測定吸光值。
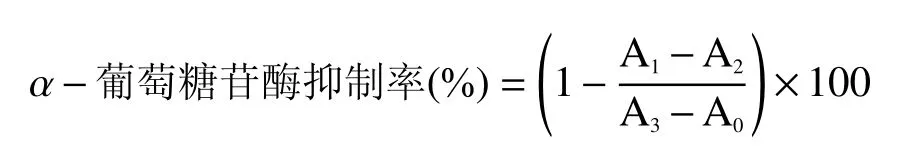
式中A0、A1、A2和A3分別表示以磷酸鹽緩沖液替代樣品和酶液的空白組、樣品組、以磷酸鹽緩沖液替代酶液的樣品空白組和以磷酸鹽緩沖液替代樣品的對照組吸光值。
1.3 數據分析
每組實驗至少有三次平行,數據均以平均值±標準差表示。數據分析和圖表制作采用了Office 2010、Origin 8.5 和SPSS 25.0 軟件。
2 結果與分析
2.1 吸器多糖的基本成分與單糖分析
吸器多糖(CHP)的中性糖、糖醛酸和蛋白質含量分別為(42.33%±0.11%)、(21.34%±0.03%)和(1.59%±0.02%)。也即實驗所得椰子吸器多糖的主要成分為碳水化合物(63.67%),同時還含有部分的蛋白質殘留,中性糖和糖醛酸的比例約為2:1。進一步利用離子色譜儀分析其單糖組成后發現:吸器多糖是一種雜多糖,由巖藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖和半乳糖醛酸組成(圖1)。7 種單糖的摩爾比為1.00:4.40:21.27:21.07:51.76:7.06:4.33。其中,葡萄糖為最主要的單糖,摩爾含量達64.76 μg/mL,其次為半乳糖(26.36 μg/mL)和阿拉伯糖(22.18 μg/mL)。
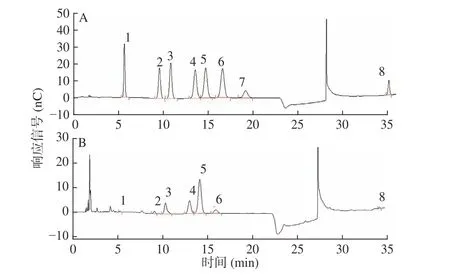
圖1 椰子吸器多糖的單糖組成色譜圖Fig.1 Chromatogram of monosaccharide composition of CHP
2.2 吸器多糖的分子量
高效凝膠滲透色譜串聯多檢測器測定結果顯示,椰子吸器多糖由3 個組分構成,其中峰1 為含量極少的高分子量聚合體,僅在光散射檢測器中可見(圖2)。而示差檢測器中則有2 個低分子量的洗脫峰2 和峰3,尤其是峰3 為吸器多糖的主要組分,約占77.52%。因此,為探究多糖的構效關系,可通過分離純化得到純度更高、均一性更好的多糖純品。
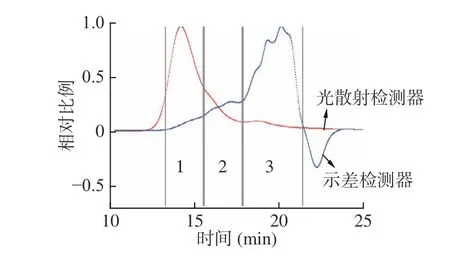
圖2 椰子吸器多糖的高效凝膠滲透色譜圖Fig.2 High performance gel permeation chromatography of CHP
利用ASTRA5.3.4 軟件計算吸器多糖各組分的分子參數如表1 所示,峰1、峰2 和峰3 的重均分子質量(Mw)分別為1.79×106、1.43×105和1.53×104g/moL,對應的多分散系數(Mw/Mn)分別為1.63、1.46 和1.37(表1)。這就說明吸器多糖的分子尺寸是一種寬分布,峰3 的分子質量分布最窄、均一性最好,峰2 次之。另外,三個洗脫組分的旋轉半徑(Rz)與重均分子量的大小順序也不一致,這可能是由于氯化鈉洗脫時樣品分子皺縮導致分子量變化造成的[20]。借助旋轉半徑和分子摩爾質量之間的擬合曲線斜率(α值為0.13),推測吸器多糖中的大分子組分峰1 為球形或團狀結構[20]。
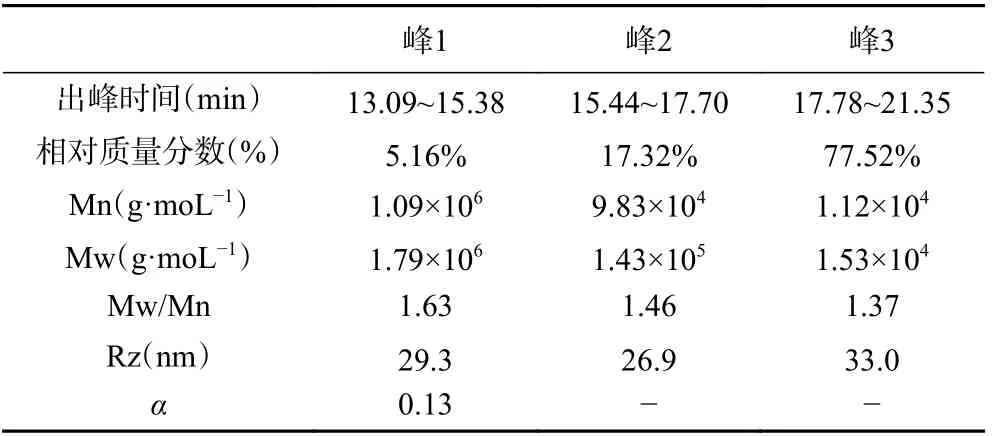
表1 椰子吸器多糖的分子參數Table 1 Molecular parameters of CHP
2.3 吸器多糖的紅外光譜分析
紅外光譜(圖3)顯示:吸器多糖在3200~3600、2800~3000、 1400~1700 cm?1和 1000~1200 cm?1有特征吸收峰。其中3418.97 cm?1和2925.65 cm?1分別代表O-H 和C-H 的伸縮振動,且這兩處吸收峰為酸性多糖的特征吸收[21],這與硫酸-咔唑法和單糖組成分析結果相吻合。而1648.61 cm?1和1398.79 cm?1分別代表酰胺基中羰基的伸縮振動和羰基陰離子基團的對稱伸縮振動,說明多糖中含有蛋白質組分;而1113.28 cm?1則表明多糖中含有吡喃糖單元[22]。
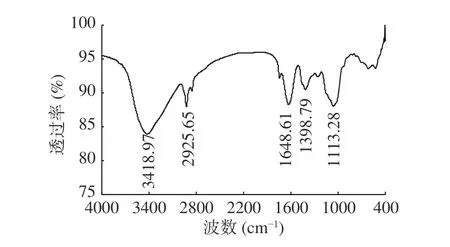
圖3 椰子吸器多糖的紅外光譜Fig.3 Fourier transform infrared spectroscopy of CHP
2.4 吸器多糖的體外抗氧化活性
在體外抗氧化模型實驗中,椰子吸器多糖對DPPH 自由基的清除能力均隨樣品濃度的增加而增大,6 mg/mL 的多糖樣品對DPPH 自由基的清除率達82.49%,與15 μg/mL 時Vc 的清除效果相當(88.25%);就羥自由基而言,椰子吸器多糖的清除能力也呈“劑量效應”,8 mg/mL 時清除率達95.13%(圖4)。但與陽性對照維生素C(Vc)相比,椰子吸器多糖對DPPH 和羥自由基清除的IC50值分別約為Vc 的188 倍和9 倍,即吸器多糖對DPPH 和羥自由基的清除能力均弱于Vc,吸器多糖的羥自由基清除能力與Vc 差距更小。然而,椰子吸器多糖仍然表現出與分離純化后的黃羽扇豆多糖(YLP-1,IC50為(2.50±0.22) mg/mL)[23]和石菖蒲多糖(RATPS2,IC50為(2.028±0.017) mg/mL)[24]相當的羥自由基清除能力。由于羥自由基是目前已知的生物體內具有最強活性和毒性的活性氧之一,它可以攻擊碳水化合物、脂類、蛋白質和核酸等幾乎所有的生物大分子,進而導致機體氧化損傷[25],故椰子吸器多糖為一種潛在的抗氧化資源。
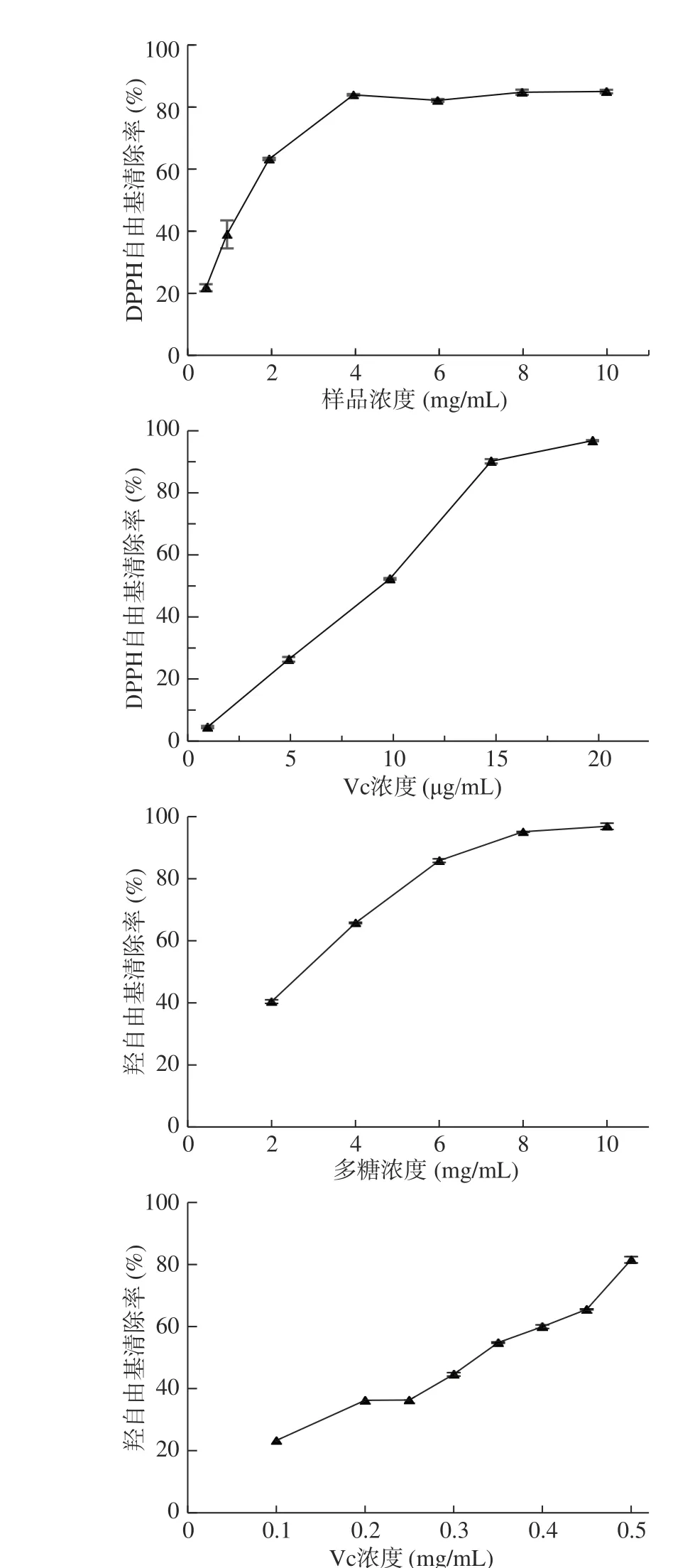
圖4 椰子吸器多糖和維生素C 對DPPH 和羥自由基的清除活性Fig.4 DPPH and hydroxyl radical scavenging activity of coconut haustorium polysaccharide and Vc
大量研究表明,多糖的還原力大小常與其分子內部存在還原酮有關,還原酮可以通過提供電子終止自由基鏈式反應來發揮抗氧化作用,同時還原酮還能與過氧化物的某些前體反應,防止過氧化物的形成[26]。椰子吸器多糖和Vc 的還原力測定結果如圖5 所示。可以看出:在測定濃度范圍內,椰子吸器多糖和Vc 的還原力與樣品濃度分別呈對數函數和線性關系,R2分別達到了0.9854 和0.9968。3 mg/mL 吸器多糖的還原力(A700nm=0.53)與100 μg/mL 的Vc 能力相當(A700nm=0.51)。也即椰子吸器多糖也能在一定程度上作為電子供體來終止自由基鏈式反應,降低機體氧化損傷。
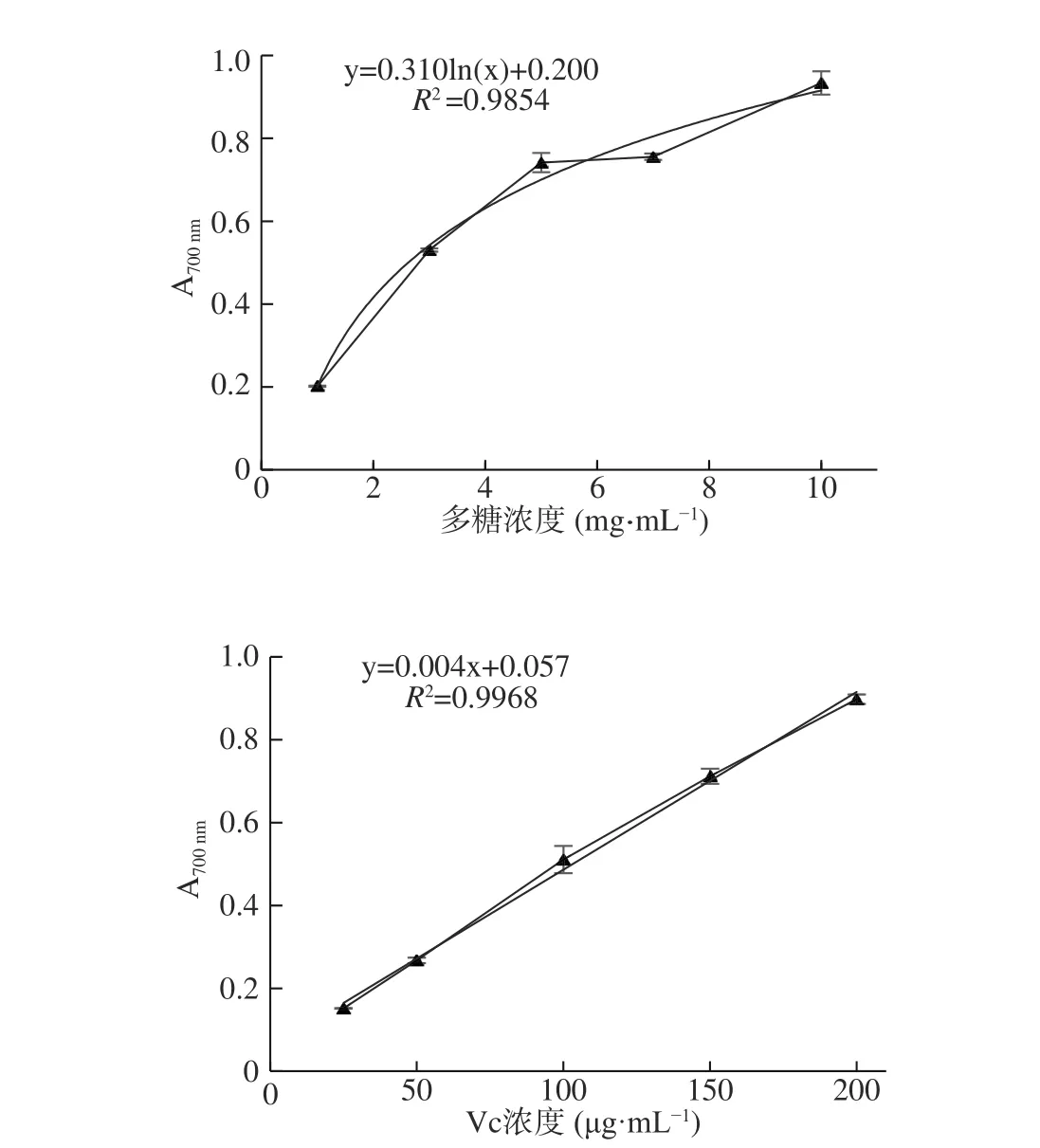
圖5 椰子吸器多糖(上)和Vc(下)的還原力Fig.5 Reducing power of CHP(on)and ascorbic acid(down)
2.5 吸器多糖的體外降糖酶抑制活性
α-淀粉酶和α-葡萄糖苷酶可將食物中的淀粉水解成單糖,經腸道吸收后引起餐后血糖升高。因此,阿卡波糖、伏格列波糖和米格列醇等α-葡萄糖苷酶抑制劑成為了臨床常見的降糖藥物。但是這些藥品因本身藥理特點也易產生腹脹、腹瀉、肝臟和腎臟損傷等副作用,故尋求安全高效的酶抑制劑成為了食品和醫藥界的研究熱點[27]。如圖6 所示:椰子吸器多糖和阿卡波糖對α-淀粉酶的抑制率和樣品濃度之間均表現出二項式函數關系(R2分別為0.8922 和0.9911),計算出半抑制濃度(IC50)分別為62.38 mg/mL和16.50 μg/mL。可見吸器多糖對α-淀粉酶的抑制效果遠低于阿卡波糖。
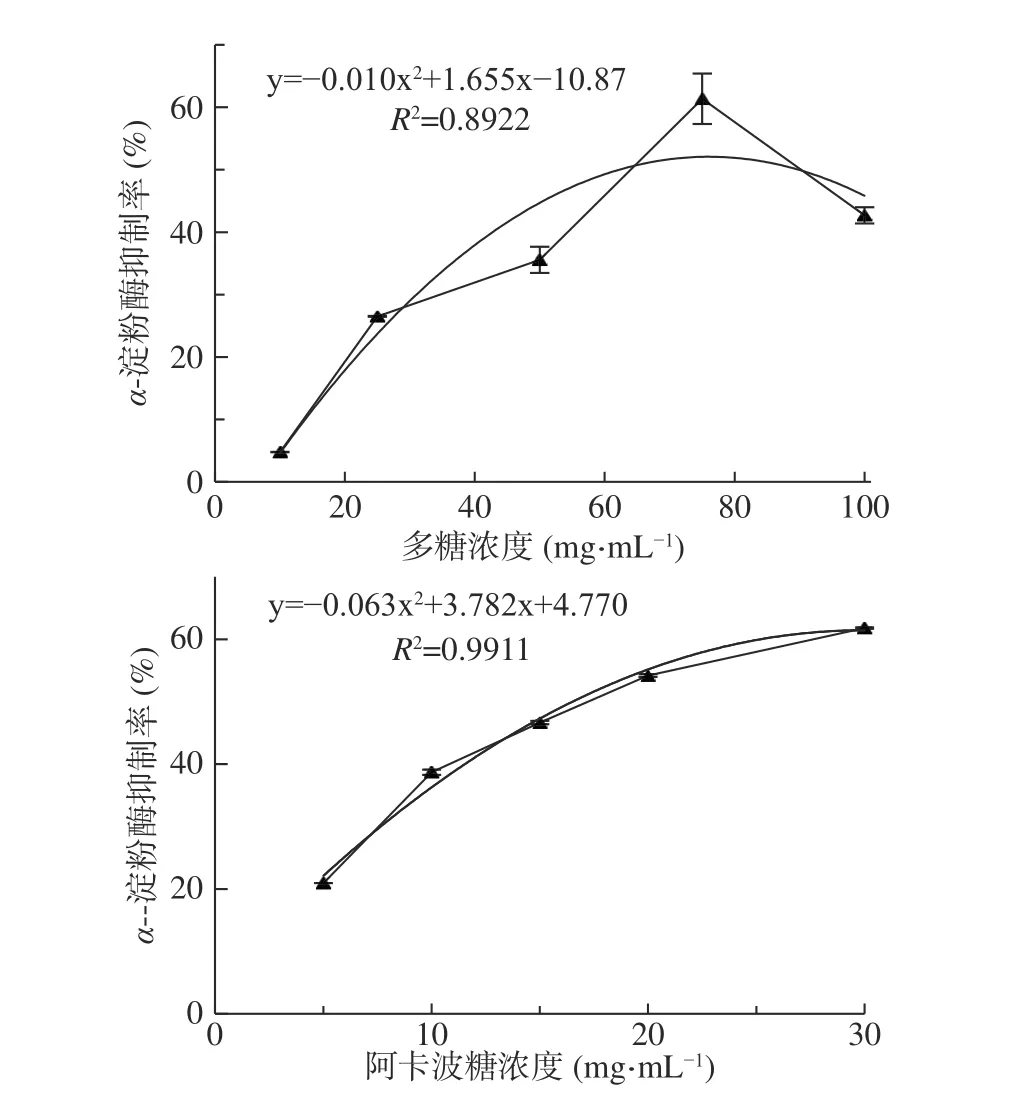
圖6 椰子吸器多糖(上)和阿卡波糖(下)對α-淀粉酶的抑制作用Fig.6 Inhibiting activity on α-amylase of CHP(on)and acarbose(down)
就α-葡萄糖苷酶抑制效果來說,吸器多糖和阿卡波糖的抑制率均與濃度呈線性相關(圖7),即隨著樣品濃度的增加,α-葡萄糖苷酶抑制率也逐漸升高。100 mg/mL 的吸器多糖對α-葡萄糖苷酶抑制率為69.91%(圖7),與1 mg/mL 的阿卡波糖的抑制效果相當(70.60%)。可見,椰子吸器多糖對α-葡萄糖苷酶具有一定的抑制效果,可以作為一種潛在的降糖食品或藥品輔助資源進行開發[20]。
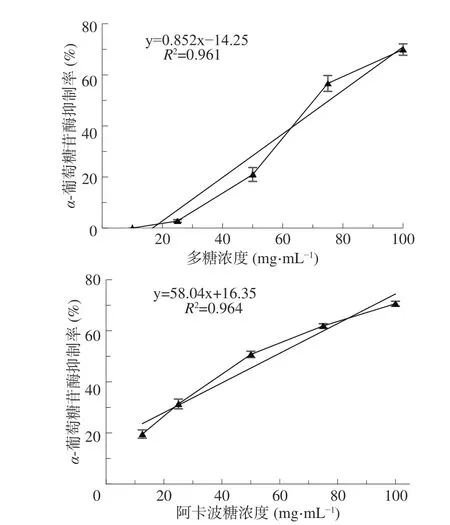
圖7 椰子吸器多糖(上)和阿卡波糖(下)對α-葡萄糖苷酶的抑制作用Fig.7 Inhibiting activity on α-glucosidase of CHP(on)and acarbose(down)
3 結論
以椰子加工副產物(吸器)為原料,制備了吸器多糖,并探究了其化學組成、結構特征、體外抗氧化和降糖酶抑制活性。結果表明:椰子吸器中含有大量的糖醛酸,是一種含有吡喃環結構的酸性雜多糖,含有葡萄糖、半乳糖和阿拉伯糖等7 種單糖,多糖分子由3 個組分構成,其中主成分(峰3)的分子質量為1.53×104g/moL,大分子組分(峰1)為球形或團狀結構。該多糖還具有一定的體外抗氧化和降糖酶抑制活性,其清除羥自由基清除和抑制α-葡萄糖苷酶活性的半劑量濃度(IC50值)分別為2.56 mg/mL和75.41 mg/mL,可作為潛在的抗氧化或降糖藥物資源進行開發。

