鈣離子對植物乳桿菌LIP-1 抗冷凍干燥性能的影響
孫瑞胤,王瑞雪,鄂晶晶,姚彩青,何宗柏,張巧玲,陳子超,馬蓉澤,包秋華,王俊國
(內蒙古農業大學食品科學與工程學院,乳品生物技術與工程教育部重點實驗室,農業農村部奶制品加工重點實驗室,內蒙古呼和浩特 010018)
益生菌一詞源于希臘語,意思是“對生命有益”。2002 年世界糧農組織(FAO)和世界衛生組織(WHO)專家組對益生菌做出了定義,即通過攝取適當的量,對使用者的身體健康能發揮有效作用的細菌[1]。研究發現益生菌制劑中菌株活性對最終產品的益生功效起到至關重要的作用[2]。菌株常通過干粉狀態進行運輸與貯藏,在一定時期抑制菌株生理活性,從而延長其保質期并節約運輸成本[3]。目前工業生產中主要通過真空冷凍干燥法制備乳酸菌制劑,其具有活菌數高、發酵活力強、遺傳穩定性好等優點,但也會對菌體造成一定的損傷[4]。因此,保證冷凍干燥存活率至關重要。在早期的研究中,人們通常選用改變保護劑成分以及優化凍干工藝來提高菌株的抗冷凍干燥性能,但近年來研究發現,益生菌在冷凍干燥過程中的存活率與其生長培養基的成分也有著十分密切的聯系[5]。
研究表明通過改變如碳源、氮源、生長因子以及微量元素等培養基成分可以提高菌株的凍干存活率[5]。Rault 等[6]發現在生長培養基中加入海藻糖可以提高保加利亞乳桿菌Lb6 的冷凍存活率。包維臣等[7]將培養基的氮源由酵母浸膏改為動物蛋白胨時,保加利亞乳桿菌ND02 在真空冷凍干燥過程的存活率明顯升高。Carvalho 等[8]發現當甘露糖替代MRS 培養基中的葡萄糖時,保加利亞乳桿菌具有更好地抗冷凍干燥性能。張鈺等[1]發現鈣能夠刺激鼠李糖乳桿菌ZY 的生長,使其細胞形態由長鏈變為短鏈。蘇郁文等[9]發現鈣離子的添加能夠提高鼠李糖乳桿菌GG 在噴霧干燥過程中的存活率。除此之外,一些微量元素,如鎂離子[10?11]、錳離子[12]和鐵離子[4]添加到培養基中時均可促進不同菌株的生長量。由此可知,改變培養基成分,如碳源,氮源,生長因子及微量元素均可有效提高菌株的生長量及冷凍干燥抗性。
雖已有研究表明在培養基中添加鈣離子可提高菌株冷凍干燥的抗性[13],但對其作用機制研究尚少。本研究以植物乳桿菌LIP-1 為研究對象,在培養基中添加不同濃度的鈣離子,探究鈣離子對該菌株培養后的活菌數及抗冷凍干燥性能的影響,并通過菌株大小分布、關鍵酶活以及細胞膜脂肪酸的檢測來探討其內在作用機制,同時通過8 周常溫貯藏實驗評價其貯藏穩定性,以期為今后提升菌株的冷凍干燥抗性提供理論參考。
1 材料與方法
1.1 材料與儀器
植物乳桿菌 LIP-1(Lactobacillus plantarumLIP-1)是一株分離自新疆自然發酵酸馬奶,擁有較好的耐酸耐膽鹽特性及較強的降膽固醇活性的益生菌[14]由內蒙古農業大學乳品生物技術與工程教育部重點實驗室提供;氯化鈣(分析純) 天津永晟精細化工有限公司;正己烷(色譜純) 福晨(天津)化學試劑有限公司;甲醇(色譜純) 天津市光復科技發展有限公司;30wt%甲醇鈉溶液(色譜純)、氯仿(色譜純)上海麥克林生化科技有限公司;堿性磷酸酶試劑盒、Na+K+-ATP 酶試劑盒 北京索萊寶試劑公司。
移液槍 德國Eppendorf;MLS-3750 型滅菌鍋、STAC-S45F 型恒溫培養箱 日本三洋;Centrifuge-5810R 高速離心機 德國艾本德;ZHJH-1214B 超凈工作臺 南京依貝儀器設備有限公司;FD-1A-50 真空冷凍干燥機 北京博醫康實驗儀器有限公司;DW-86L388J 醫用低溫保存箱 青島海爾特種電器有限公司;SP-650 型全自動干熱滅菌箱 日本ASVANTEC;ND100-1 干式氮吹儀 南京肯凡電子科技有限公司;Technologies 6850 氣相色譜 上海安捷倫科技(有限)公司;DSM5000 CS 顯微鏡 德國萊卡;細胞破碎儀VCX750 美國Sonics。
1.2 實驗方法
1.2.1 溶液配制[15]凍干保護劑:蒸餾水82 mL、脫脂乳 10.0 g、蔗糖 8.0 g、L-谷氨酸鈉 0.1 g,115 ℃滅菌7 min,滅菌完成后置于冰水混合物中快速冷卻,4 ℃保存備用;MRS 液體培養基:葡萄糖 20.0 g、大豆蛋白胨 10.0 g、牛肉膏 10.0 g、酵母粉 5.0 g、無水乙酸鈉 5.0 g、無水磷酸氫二鉀 2.0 g、檸檬酸鈉2.0 g、七水硫酸鎂 0.2 g、五水硫酸錳 0.05 g、吐溫?80 1 mL。加蒸餾水 1000 mL,121 ℃滅菌 15 min;MRS 固體培養基:液體培養基的基礎上額外添加瓊脂12 g/L,121 ℃滅菌15 min。
1.2.2 菌株活化[15]將貯藏于?80 ℃冰箱中的植物乳桿菌LIP-1 融化,以2%接菌量接種于液體MRS 培養基,于37 ℃培養箱中培養18 h,在4 ℃中保存備用。
1.2.3 鈣離子對植物乳桿菌生長的影響 將MRS培養基中菌株以2%接菌量分別接種于外加0(對照組)、0.25、0.5、0.75、1、1.5、2 mmol/L 氯化鈣的液體MRS 培養基中,培養18 h 后進行稀釋平板計數(以后均簡稱計數)。
1.2.4 鈣離子培養后菌株的干燥[15]將預凍于?80 ℃冰箱中6 h 后,添加了保護劑的菌泥,置于真空冷凍干燥機中進行凍干,凍干條件為:冷阱溫度?48 ℃,20 Pa,18 h。
1.2.4.1 鈣離子培養后菌株的真空冷凍干燥活菌數[15]將不同培養方式培養出的菌株,凍前計數后,加入2 mL 冷凍干燥保護劑,并充分混勻,預凍6 h,后凍干,凍干后計數。

1.2.5 電鏡觀察 對(MRS)對照組與添加0.5 mmol/L鈣離子的實驗組使用光學顯微鏡拍攝照片,該顯微鏡配有100 倍HCX PL APO 物鏡。為了更好地觀察細胞,細胞使用結晶紫染色。顯微鏡拍攝后,使用Image J 對菌株進行長度統計。
1.2.6 Na+K+-ATP 酶活力的測定[16]將冷凍干燥樣品復水離心棄上清,菌泥用 0.85% NaCl 溶液清洗2 次后,加入2 mL 酶提取液,后進行超聲波破碎(超聲3 s,間隔10 s,7 min);4 ℃,15000 r/min,離心10 min 取上清,用于后續相關酶活測定。Na+K+-ATP 酶試劑盒分別對組樣品進行相關酶活的3 次重復測定,酶活的單位用U/g 表示。
1.2.7 堿性磷酸酶活檢測[16]取菌泥0.1 g,加入0.05 mL 甲苯輕搖15 min;堿性磷酸酶試劑盒分別對樣品進行3 次重復酶活測定,酶活的單位用U/g 表示。
1.2.8 細胞膜脂肪酸的提取及含量測定
1.2.8.1 細胞膜脂肪酸的提取 參考陳境[15]的提取方式。首先,用無菌去離子水對凍前實驗組與對照組反復離心洗滌三次(4000 r/min,4 ℃,5 min)。棄上清液后,稱取菌泥0.5 g,向其中加入1.9 mL 氯仿-甲醇溶液(氯仿:甲醇為1:2 制備溶液,V/V),振蕩15 min。加入0.625 mL 氯仿及0.625 mL 無菌去離子水,振蕩15 min,離心10 min(4 ℃,8000 r/min)。吸取下層液相,移至無菌離心管。氮吹30 min 吹干,加入1 mL 甲醇鈉-甲醇(1 moL/L),冰浴后振蕩5 min。最后加入0.625 mL 正己烷,離心5 min(4 ℃,8000 r/min),吸取上清液后經有機過濾器移入氣象瓶中。
1.2.8.2 細胞膜脂肪酸含量的測定 同1.2.8.1 參考陳境[15]的測定方式。氣相色譜條件:DB-WAX 毛細管色譜柱(60 m×0.25 μm×0.25 mm);氮氣,分流比5:1,流速1 mL/min;進樣口250 ℃;檢測口260 ℃;柱溫程序:初始溫度80 ℃,升溫速率6.5 ℃/min;170 ℃,升溫速率27.5 ℃/min;215 ℃保持2 min;升溫速率40 ℃/min,230 ℃保持2 min。進樣量3 μL。脂肪酸含量計算采用面積歸一法。
1.2.9 菌株的貯藏穩定性 菌株經真空凍凍干燥后,置于25 ℃恒溫箱中避光貯藏,每隔一周取出計數。
1.3 數據處理
氣相數據為儀器記錄數據導出后經Excel 處理得出。數據均為3 組平行實驗得到,應用SPSS26.0軟件進行顯著性分析,P<0.05 為顯著性水平,并使用Origin 2018 與Excel 進行繪圖。
2 結果與分析
2.1 不同鈣離子濃度對LIP-1 真空冷凍干燥存活率的影響
如圖1 所示,對照組(普通MRS 培養基)中,植物乳桿菌LIP-1 凍前生長量為(3.30±0.54)×109CFU/mL;鈣離子濃度低于1 mmol/L 時,其冷凍干燥存活率逐步提升。但當鈣離子濃度為0.75 mmol/L時,菌株冷凍干燥前,培養基已經對菌株的生長出現了抑制作用,造成了冷凍干燥前菌株生長量降低,即使存活率高于其他組,但實際活菌數僅為(3.50±0.33)×109CFU/mL。鈣離子濃度為0.5 mmol/L 時,凍前菌株生長量達到了(4.02±0.38)×109CFU/mL,凍干后菌株存活數相較對照組增長了69.63%,為(3.08±0.27)×109CFU/mL,其冷干前后活菌數均高于其他組,且冷凍干燥存活率(76.67%±5.00%)相較未添加鈣離子的對照組(55.15%±1.50%)顯著提高(P<0.05),菌株擁有較高的冷凍干燥抗性,因此選擇鈣離子濃度為0.5 mmoL/L 進行下一步試驗。

圖1 不同Ca2+濃度(mmol/L)對LIP-1 真空冷凍干燥存活率的影響Fig.1 The effect of different concentrations of Ca2+ on the survival rate of LIP-1 vacuum freeze-drying
2.2 鈣離子對植物乳桿菌LIP-1 細胞形態的影響
如圖2 所示為植物乳桿菌LIP-1 在不同培養條件下的顯微電鏡下的長度分布圖。由圖2 可知,對照組(普通MRS 培養基)培養下植物乳桿菌LIP-1 的長度范圍集中在1.1 ~1.7 μm 之間,而添加了0.5 mmoL/L 鈣離子培養出的植物乳桿菌LIP-1 則集中分布于0.8~1.4 μm 之間。經含有鈣離子的MRS培養基(對照組)培養出的植物乳桿菌LIP-1 平均長度相較于普通MRS(實驗組)培養基培養出的植物乳桿菌LIP-1 長度縮短了約0.4 μm,這一實驗結果與張鈺[1]研究相同。相關文獻表明,短桿相較于長桿更具穩定性[10],因此當植物乳桿菌LIP-1 加入0.5 mmoL/L的鈣離子后具有較高的冷凍干燥抗性。

圖2 對照組(MRS)與實驗組(添加0.5 mmoL/L 鈣離子的MRS)的長度分布圖Fig.2 Experimental group (MRS with 0.5 mmoL/L calcium ion) and control group (MRS) length distribution diagram
2.3 細胞壁損傷評價
如圖3 所示為植物乳桿菌LIP-1 在不同培養條件下,經真空冷凍干燥前后菌株的堿性磷酸酶變化。堿性磷酸酶(AKP)存在于細胞壁和細胞膜之間,正常情況下細菌培養液中只能檢測到少量的AKP,只有當細胞壁通透性增大或損壞時,指示液中AKP 含量才會增加,所以可以通過檢測AKP 活性來反映細胞壁損傷的情況[16]。由圖3 可知,冷凍干燥處理前對照組和實驗組AKP 的酶活無顯著差異(P>0.05)。經冷凍干燥處理后,對照組與實驗組AKP 的含量均顯著增加(P<0.05),說明菌體經凍干處理后,菌體的細胞壁受到損傷,且對照組AKP 的含量(595.45±3.55)U/g 顯著高于實驗組(543.75±2.50)U/g(P<0.05)。結果表明,適當的添加鈣離子可提高菌體細胞壁的穩定性。

圖3 真空冷凍干燥前后LIP-1 的堿性磷酸酶變化Fig.3 Changes of alkaline phosphatase of LIP-1 before and after vacuum freeze-drying
2.4 細胞膜損傷評價
如圖4 所示為植物乳桿菌LIP-1 在不同培養條件下,經真空冷凍干燥前后菌株的Na+K+-ATP 酶活性變化。Na+K+-ATP 酶是一種生物膜酶,存在細胞膜的磷脂雙分子層中,通過催化ATP 水解提供能量,驅動Na+向細胞外和K+向膜內進行運輸,維持細胞膜兩側的膜電位及乳酸菌菌體細胞的正常生理功能。所以Na+K+-ATP 酶可以在一定程度上反映細胞膜的通透性[16]。在真空冷凍干燥前實驗組與對照組酶活性無顯著差異,分別為(19.32±0.12) U/g 與(19.41±0.22)U/g。經冷凍干燥后對照組與實驗組出現了顯著差異(P<0.05),對照組酶活為(10.65±0.15)U/g,實驗組是(16.85±0.26)U/g,這說明經實驗組培養出的菌株相較于對照組(普通MRS 組)有效的提升了菌株的抗冷凍干燥性。
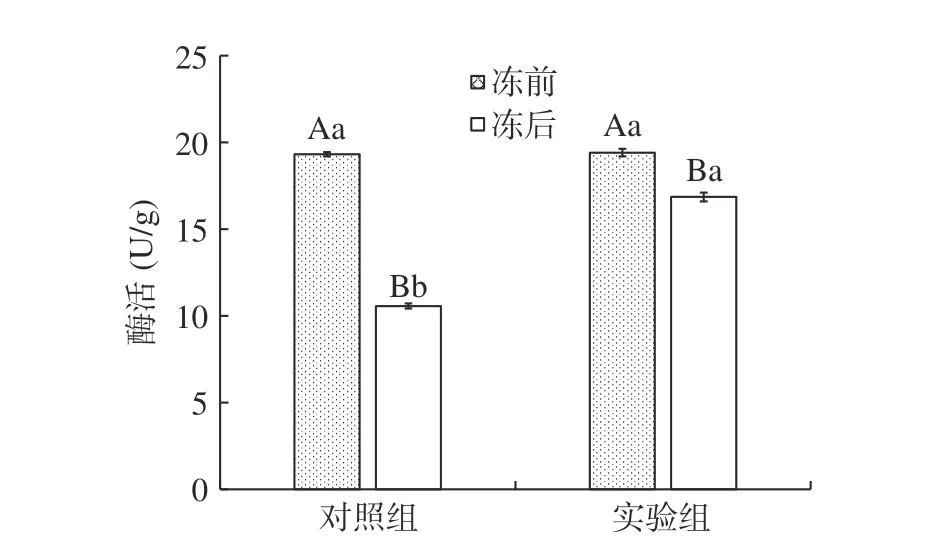
圖4 真空冷凍干燥前后菌株的Na+K+-ATP 酶活性變Fig.4 Changes of Na+K+-ATPase activity of strains before and after vacuum freeze-drying
2.5 鈣離子對植物乳桿菌LIP-1 細胞膜脂肪酸的影響
細胞膜脂肪酸組成成分是影響菌株抗冷凍干燥性能的重要指標。在冷凍干燥過程中,乳酸菌可以通過脂肪酸脫氫酶調節飽和/不飽和脂肪酸的比例。飽和/不飽和脂肪酸的比例決定了細胞膜的流動性和完整性,不飽和脂肪酸相對含量高的菌株具有較好的細胞膜流動性和完整性,從而提高菌體對凍干的抵抗能力[5,13]。通過對細胞膜脂肪酸的測定發現(如圖5所示),細胞膜中主要包含8 種細胞膜脂肪酸,分別為月桂酸(C12:0)、肉蔻豆酸(C14:0)、棕櫚酸(C16:0)、棕 櫚 油 酸( C16:1) 、 硬 脂 酸( C18:0) 、 油 酸(C18:1w9c)、亞油酸(C18:2)及環丙烷脂肪酸(19cyc9,10);實驗組與對照組脂肪酸的相對含量存在顯著性差異,其中,棕櫚酸(C16:0)和肉蔻豆酸(C14:0)兩種飽和脂肪酸占總脂肪酸比例顯著降低(P<0.05),而油酸(C18:1w9c)、環丙烷脂肪酸(19cyc)以及亞油酸(C18:2)占比卻顯著提升(P<0.05)。并且實驗組中不飽和度(U/S)為0.6312 明顯高于對照組(0.5587)。因此,在培養基中適當的添加Ca2+可使細胞膜的不飽和脂肪酸含量增加,不飽和度(U/S)的比值升高,提高了細胞膜的流動性和完整性,從而明顯提高了菌體的冷凍干燥抗性。
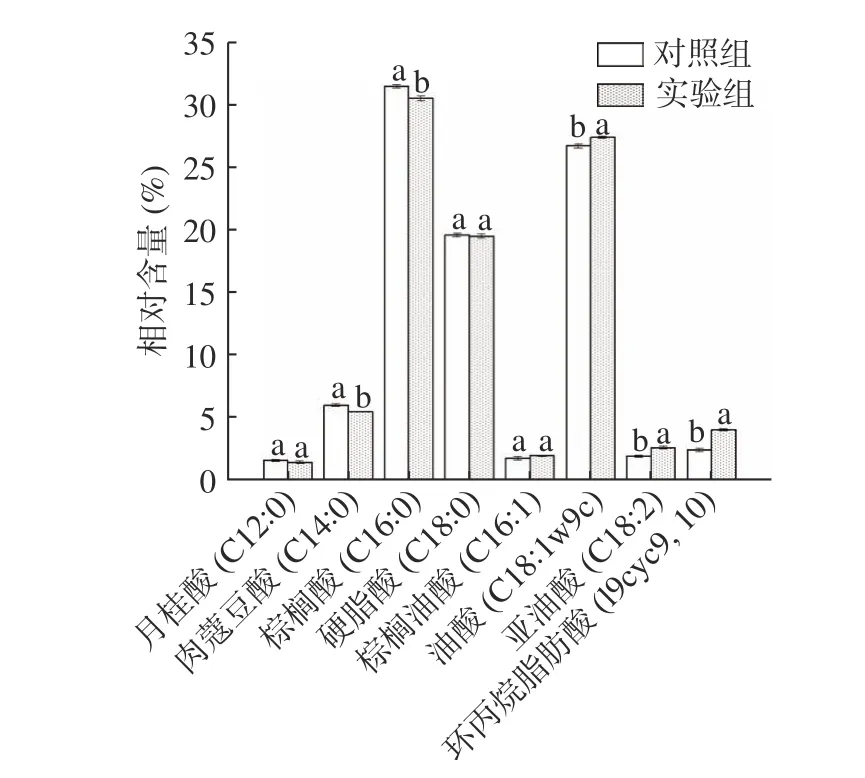
圖5 普通MRS(對照組)與添加0.5 mmoL/L Ca2+(實驗組)的細胞膜脂肪酸組成Fig.5 Proportion of main fatty acids of LIP-1 cultured by ordinary MRS (control group) and 0.5 mmoL/L Ca2+(experimental group)
有研究報道,細胞中蛋白酶、脂肪酶、ATP 酶等多種酶,均與鈣離子的作用相關[17]。Heibrunn 等[18]報道,Ca2+具有影響酶活性、調節細胞膜的透性、控制代謝等功能[19]。由此我們推測Ca2+可能通過調節脂肪酸脫氫酶的活性從而調節細胞膜飽和/不飽和脂肪酸的比例,進而提高了菌株的冷凍干燥抗性。
2.6 不同濃度鈣離子對菌株冷凍干燥后常溫貯藏穩定性的影響
如圖6、圖7 所示,本研究通過檢測真空冷凍干燥后植物乳桿菌LIP-1 在25 ℃環境下貯藏8 周的活菌數反映其貯藏穩定性,同時通過存活率變化評價其下降幅度。由圖6 可知,菌株在貯藏2~8 周時,在培養基中添加了鈣離子可顯著提升菌株活菌數且存活率降幅較小,從而提高了菌株的貯藏穩定性(P<0.05)。隨著鈣離子濃度的增加,菌株貯藏穩定性提高。由于當鈣離子濃度過高時菌株生長會受到抑制,影響了貯藏初始菌株密度,從而造成了第8 周時2 mmoL/L 鈣離子雖然擁有較高的存活率,但是實際活菌數僅為(8.7±0.11)×108CFU/mL,低于添加鈣離子培養基的其他組。這表明,鈣離子的加入可以有效地提高植物乳桿菌LIP-1 的貯藏穩定性,并且隨著鈣離子濃度升高,貯藏穩定性隨之升高[20]。鈣離子對細胞壁、細胞膜的保護作用[13]可提高菌株的冷凍干燥抗性及貯藏穩定性。普通MRS 培養基中,初始菌濃度為(2.31±0.18)×109CFU/mL,當貯藏8 周后,活菌數為(1.9±0.14)×108CFU/mL,存活率僅為8.06%。綜上所述,當鈣離子濃度為0.5 mmoL/L 時,菌株生長情況良好,8 周內貯藏穩定性較高,經8 周貯藏后的活菌數仍有(1.09±0.11)×109CFU/mL。
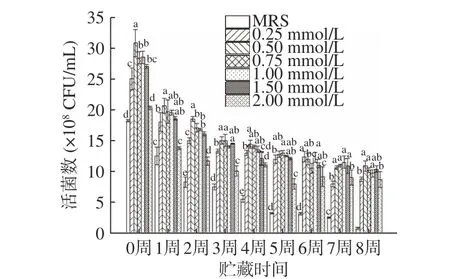
圖6 LIP-1 經不同濃度Ca2+培養后的常溫貯藏活菌數Fig.6 The number of viable bacteria stored at room temperature after LIP-1 was cultured with different concentrations of Ca2+
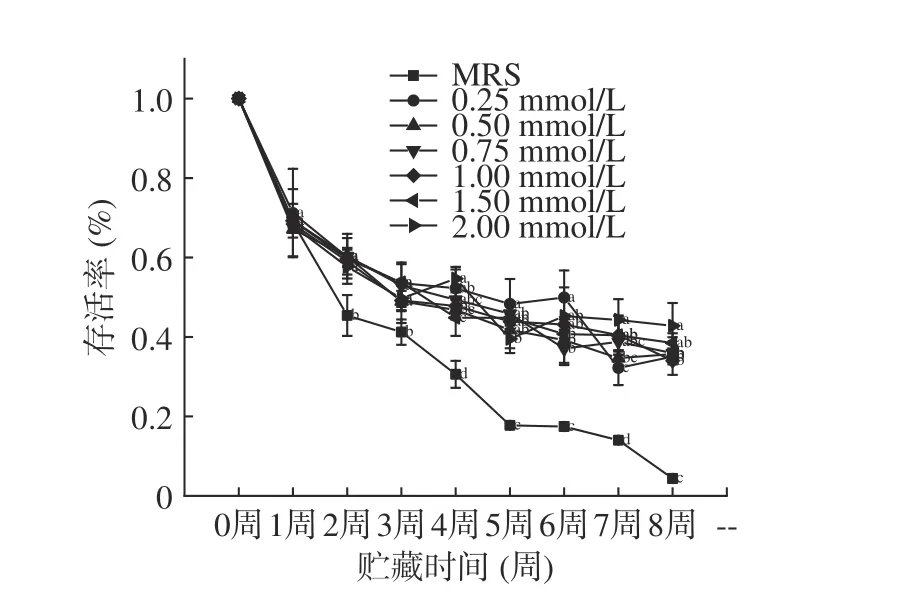
圖7 LIP-1 經不同濃度Ca2+培養后的常溫貯藏存活率Fig.7 The survival rate of LIP-1 after being cultured with different concentrations of Ca2+
3 討論
不同培養基成分會造成菌株形態和生理上的改變,進而導致了其對外界不良環境的抗性不同。首先從形態上,在培養基中添加例如豬源蛋白胨[21]和鈣離子[22?23]等會縮短菌株形態,此時菌體表面積減小,在冷凍過程中形成的冰晶對其細胞膜的機械損傷減少,從而菌體的冷凍干燥抗性提高。在本實驗中,當培養基中添加0.5 mmoL/L 的鈣離子時,菌株形態由長桿轉變為短桿,且菌株的生長量由(3.3±0.54)×109CFU/mL 增加到(4.02±0.38)×109CFU/mL,凍干存活率提高了21.52%,這一結果再次驗證在凍干過程中,鈣離子可以通過改變菌株形態減少其在冷凍過程中所受到的損傷。
對于細菌而言,細胞壁與細胞膜至關重要。其中,細胞壁是位于細胞膜外的一層較厚、較堅韌并略具彈性的結構,使細菌既能適應多變的環境,又能維持細菌的結構[11]。本研究通過對AKP 酶的泄漏量的測定來評估細胞壁的損傷程度,發現鈣離子的加入有效保護了植物乳桿菌LIP-1 的細胞壁完整性,降低了其在冷凍干燥中受到的損傷,這是由于鈣離子可通過電荷作用來維持細胞壁的完整性[24]。
細胞膜可以使菌體與外部環境隔離,是保護乳酸菌的主要屏障。在冷凍干燥過程中,細胞膜受損也是導致細菌死亡的主要原因之一[25]。Na+K+-ATP 酶可以使橫跨膜產生電勢,從而起到維持細胞內外pH 動態平衡的作用。冷凍干燥過程會使得Na+K+-ATP 酶活性降低甚至失活[26],從而細胞膜完整性受損,細菌的凍干存活率降低。因此可以通過測定Na+K+-ATP 酶活性來評價細胞膜的損傷程度。本研究發現鈣離子的加入有效保護了植物乳桿菌LIP-1 的細胞膜,降低了其在冷凍干燥中受到的損傷。這與細胞膜脂肪酸成分的改變有密切聯系。菌株在冷凍干燥后,其細胞膜結構受損,其中的不飽和脂肪酸相對含量是評估冷凍干燥過程細胞膜流動性與完整性的重要指標[27]。Li 等[28]發現不飽和脂肪酸含量高的菌株,在冷凍干燥過程中會有更大的存活率。并且,適當改變培養基成分可使細胞膜上飽和脂肪酸向不飽和脂肪酸轉變速率加快,從而有助于保持膜在凍干過程中的流動性[29]。但目前關于添加鈣離子對經凍干處理后菌株細胞膜的變化尚未報道。本研究通過對Na+K+-ATP 酶活性以及脂肪酸含量變化的檢測,評價了鈣離子對細胞膜的保護作用。結果表明,鈣離子的加入提高了Na+K+-ATP 酶的活性,進而更好地維持了細胞膜的通透性,降低了細胞膜的損傷程度;同時,細胞膜中不飽和脂肪酸的含量升高,U/S 變大,細胞膜流動性增強,提高了菌株的冷凍干燥存活率。綜上所述,在培養基中添加鈣離子可有效保護菌株的細胞壁、細胞膜,提高了細胞膜的流動性,從而使菌株具有較強的冷凍干燥抗性及貯藏穩定性。但本研究并未結合基因組學,蛋白組學,代謝組學等對細胞的變化進行深入探討,只是基于表觀特征初步的探討了鈣離子對菌株的影響,還需進一步研究。
4 結論
在培養基中添加適當濃度的鈣離子(0.5 mmoL/L),可以促進植物乳桿菌LIP-1 的生長量,相較于未添加鈣離子的培養基活菌數增長了0.717×109CFU/mL,并且顯著提高其冷凍干燥存活率。經電鏡實驗發現添加鈣離子使菌株形態由長桿向短桿轉變,平均長度縮短0.4 μm;通過關鍵酶活的檢測發現實驗組有效的保護了菌株的細胞壁與細胞膜;通過對其脂肪酸成分的測定發現細胞膜中不飽和脂肪酸的含量升高,U/S 變大(實驗組(0.6312)明顯高于對照組(0.5587)),致使細胞膜流動性增強,進而顯著的增加了植物乳桿菌LIP-1 的冷凍干燥存活率。

