雙菌微囊化發酵耦合泡沫分離強化乳鏈菌肽生產的工藝
周靜萍,劉 偉,楊春燕,殷 昊,盧 珂
(河北工業大學化工學院,天津 300131)
隨著食品安全問題的日益加劇,天然、安全的生物防腐劑備受人們的青睞。乳鏈菌肽(C143H228N42O37S7,Nisin),是由乳酸鏈球菌亞種(Lactococcus lactissubsp.lactis)中某些菌株分泌的一種羊毛硫細菌素,是目前聯合國糧食和農業組織/世界衛生組織(FAO/WHO)唯一批準使用的天然食品防腐劑[1]。Nisin 能夠強烈抑制革蘭氏陽性菌的生長,并有效阻止孢子萌發及毒素的形成[2]。但由于Nisin 的發酵生產存在產能不足、產率低、碳源成本高等問題,嚴重制約了Nisin 的工業應用[3]。
近年來,國內外研究者在Nisin 高產菌株選育[4]、培養基優化[5]、發酵條件控制[6]及發酵方式開發[7]等方面進行了大量研究。例如:高艷飛等[8]以葡萄糖部分替代蔗糖優化Nisin 發酵培養基,大幅降低碳源成本的同時,Nisin 效價達到了以蔗糖為單一碳源的水平。Subha 等[9]將乳酸鏈球菌包埋于海藻酸鈉膠粒中,并將其用于連續發酵,Nisin 產量較分批發酵提高了4 倍。然而,以上研究并沒有解決發酵過程中Nisin 對產生菌生長及自身合成的反饋抑制問題[10]。酸性條件下,Nisin 分子通過靜電作用吸附在產生菌細胞膜表面,其疏水側鏈插入到膜內并與磷脂結合,使細胞膜發生去極化,小分子代謝物(如氨基酸、ATP 等)快速外泄造成膜內外能差消失,引起細胞自溶[11]。因此,發酵過程中及時移除Nisin 對于進一步提高產量具有重要意義。
Nisin 的分離方法主要有鹽析法、凝膠過濾色譜法、樹脂吸附法和水相兩相法[12?15]等。但上述方法很難與發酵過程耦合,實現原位分離Nisin。泡沫分離是一種以氣泡為介質的界面吸附分離技術,具有設備簡單、操作條件溫和、易放大和環境友好等優點。近年來,泡沫分離技術與微生物發酵過程耦合強化生物表面活性素(如鼠李糖脂和脂肽)生產引起了研究者們的廣泛興趣[16?17]。但發酵-泡沫分離耦合技術應用于工業生產Nisin 面臨著以下技術瓶頸:(1)泡沫分離能夠有效富集Nisin,但副產物乳酸的大量積累導致發酵液pH 降低,酸脅迫會增強H+-ATPase 活性,從而抑制菌體細胞的生長和繁殖[18];(2)泡沫對菌體細胞具有夾帶作用,且氣泡聚并產生的剪切力會引起細胞損傷,不利于高密度發酵[19]。
Nisin 的工業生產通常采用補料分批發酵和pH 控制發酵方式,將發酵液中乳酸的濃度維持在毒性水平以下[20?21]。但由于高滲透壓和酸性陰離子的存在,這些方法的生產效率較低。雖然雙水相體系和樹脂吸附法能夠從發酵液中原位回收乳酸,但是有機試劑會對菌體細胞造成不可逆損害[22?23]。基于微生物群體感應效應,在培養基中共培養特定菌株來改善發酵環境的研究受到人們的廣泛關注[24]。Hamedi 等[25]提出將解脂耶氏酵母(以乳酸為碳源)和乳酸鏈球菌混合發酵來提高Nisin 產量,但解脂耶氏酵母會大量分泌有機酸,發酵液依然存在酸化問題。為了避免泡沫夾帶菌體細胞,Cui 等[26]設計了一種新型發酵-泡沫分離耦合裝置,利用0.45 μm的混合纖維膜來阻斷菌體細胞與氣泡的接觸,但Nisin 的分離效率較低。細胞固定化是通過化學或物理方法把游離態細胞定位在一個固定的區域內,并有效保持細胞活性的技術[27]。Gao 等[28]以κ-卡拉膠為包埋載體,制備了乳酸鏈球菌固芯凝膠顆粒,并將其負載于絲瓜絡的孔道結構中,進行發酵-泡沫分離耦合連續生產Nisin。由于凝膠顆粒的空間位阻限制了細胞生長和物質擴散,有害代謝產物會加速菌體細胞衰老或自溶,Nisin 的單批次產量遠遠低于游離細胞發酵。微膠囊是一種新興的細胞固定化方法,其內部液芯環境可以為細胞提供生長空間,并且囊膜允許雙向擴散營養物質和代謝產物,有助于實現高密度發酵[29]。微膠囊固定細胞的關鍵在于選擇適宜的制備材料,其應符合以下條件:(1)成膜材料中至少有一種聚合物;(2)聚合物帶有電荷或通過調節pH 而帶有電荷,以便發生凝聚成膜反應;(3)成膜材料應具有良好的生物相容性;(4)材料易得,生物穩定性好,界面反應條件溫和,界面凝聚反應迅速[30]。海藻酸鹽、殼聚糖、淀粉和瓊脂等天然多糖是常用的囊材。
基于以上研究,本文擬采用能夠代謝乳酸的釀酒酵母為輔助菌與乳酸鏈球菌進行共培養,并對雙菌進行微膠囊固定化,構建發酵與泡沫分離耦合系統強化Nisin 生產。首先,建立乳酸鏈球菌與釀酒酵母共培養發酵體系,并對發酵條件進行優化。隨后,優化了海藻酸鈉-殼聚糖-海藻酸鈉(ACA)液芯微膠囊制備條件。最后,以富集比、回收率和Nisin 總效價為評價指標,研究發酵和泡沫分離耦合時間,氣泡尺寸及氣體體積流率對Nisin 回收效率的影響。
1 材料與方法
1.1 材料與儀器
乳酸鏈球菌(Lactococcus lactissubsp.lactisATCC 11454)、釀酒酵母(Saccharomyces cerevisiaeW303-1A)、和藤黃八疊球菌(Micrococcus luteusNCIB 8166) 均由河北工業大學生物工程系菌種保藏室提供,并于4 ℃進行低溫保存;蛋白胨生物試劑、酵母浸粉生物試劑 北京奧博星生物技術有限公司;乳糖、蔗糖、葡萄糖 分析純,天津市風船化學試劑廠科技有限公司;殼聚糖、海藻酸鈉、檸檬酸鈉、KH2PO4、NaCl、MgSO4·7H2O、Na2HPO4分析純,天津市登峰化學試劑廠。
752N 紫外可見光分光光度計 上海精密科學儀器有限公司;BKQ-Z30I 高壓蒸汽滅菌鍋 山東博科生物產業有限公司;Agilent 1100 高效液相色譜儀美國安捷倫科技有限公司。
1.2 實驗方法
1.2.1 培養基的制備 釀酒酵母種子培養基:蛋白胨2.0 g/L,酵母浸粉1.0 g/L,葡萄糖2.0 g/L,自然pH。121 ℃下高壓蒸汽滅菌20 min[31]。
乳酸鏈球菌種子培養基:蛋白胨15 g/L,酵母浸粉15 g/L,蔗糖15 g/L,NaH2PO420 g/L,NaCl 2.0 g/L,MgSO4·7H2O 0.2 g/L,pH 為6.9。121 ℃下高壓蒸汽滅菌20 min[32]。
共培養發酵培養基:蛋白胨15.0 g/L,酵母浸粉15.0 g/L,KH2PO415.0 g/L,NaCl 2.0 g/L,MgSO4·7H2O 0.2 g/L,4.0%碳源;初始pH 為6.9。121 ℃下高壓蒸汽滅菌20 min。
效價檢測SI 培養基:葡萄糖5.0 g/L,胰蛋白胨8.0 g/L,NaCl 5.0 g/L,酵母浸粉3.0 g/L,Na2HPO42.0 g/L,Tween 20 5.0 mL/L,瓊脂10.0 g/L,pH 為7.2。121 ℃下高壓蒸汽滅菌20 min[32]。
1.2.2 共培養可行性探究實驗
1.2.2.1 共培養發酵和純培養發酵 將乳酸鏈球菌種子液和釀酒酵母種子液分別以3%(v/v)的接種量轉接至發酵培養基中,于150 r/min,30 ℃條件下進行共培養發酵,分別以相同接種量的乳酸鏈球菌和釀酒酵母的純培養(單一菌體)發酵液作為對照組;每3 h 取樣一次,并于600 nm 條件下測定發酵液吸光值。
1.2.2.2 生物量檢測 采用分光光度法于600 nm 處測量樣品的吸光值(OD600),通過繪制出乳酸鏈球菌和釀酒酵母純培養和共培養發酵的生長曲線,來確定菌體生物量。采用平板計數法測定乳酸鏈球菌和釀酒酵母的活細胞濃度[33],分別取乳酸鏈球菌和釀酒酵母單一培養種子液,通過磷酸鹽緩沖溶液進行梯度稀釋,每個梯度均稀釋10 倍,隨后分別添加5 mg/L環己酰亞胺(抑制釀酒酵母生長)和5 mg/L 鏈霉素(抑制乳酸鏈球菌生長)的選擇性培養基上進行均勻涂布,30 ℃培養36 h,分別測定乳酸鏈球菌種子液和釀酒酵母種子液的活細胞濃度(CFU/mL)。
1.2.3 共培養發酵條件的選擇
1.2.3.1 碳源篩選 為了研究碳源對乳酸鏈球菌與釀酒酵母共培養發酵生產Nisin 的影響,將乳酸鏈球菌種子液和釀酒酵母種子液分別按照3%(v/v)的接種量轉接入不同碳源(4%葡萄糖、4%乳糖和4%蔗糖)的乳酸鏈球菌發酵培養基中進行分批培養,并于30 ℃、150 r/min 下共培養發酵24 h,分別測定發酵液的Nisin 效價和pH。
1.2.3.2 接種比例的篩選 選定乳酸鏈球菌與釀酒酵 母 的 初 始 接 種 比 例 為10?1:1、100:1、101:1、102:1、103:1、104:1,固定釀酒酵母的接種量為3%,于150 r/min,30 ℃條件下培養24 h。發酵結束后,分別取樣測定發酵液的Nisin 效價。
1.2.3.3 Nisin 效價測定 本研究采用改良的雙劑量瓊脂擴散法測定Nisin 效價[30]。將含檢測菌的SI 培養基倒入無菌培養皿中,并于4 ℃儲藏30 min,然后用7 mm 的無菌空心打孔器在凝固的瓊脂上打孔。將Nisin 標準液和樣品注入孔中(每孔135 μL),置于生化培養箱中35 ℃培養24 h,用計算機輔助設計軟件(Auto CAD)測量抑菌區直徑,并根據抑菌區直徑和Nisin 標準品的效價計算出樣品溶液的效價。
1.2.4 ACA 液芯微膠囊細胞固定化條件選擇
1.2.4.1 固定化工藝 取乳酸鏈球菌種子液和釀酒酵母種子液按照一定接種比例混合,于6000 r/min和4 ℃條件下離心10 min,保留菌泥。隨后,將乳酸鏈球菌與釀酒酵母的菌懸液按照體積比10:1 與海藻酸鈉溶液均勻混合。以5.0 mL/min 速率將該混合溶液滴加到20.0 g/L CaCl2溶液中,固化2 h,用無菌水反復沖洗,得到雙菌共固定的海藻酸鈣凝膠珠。將其置于殼聚糖溶液(pH 5.5)中覆蓋殼聚糖膜,制得雙菌共固定的海藻酸鈣-殼聚糖固芯微膠囊。海藻酸鈣與殼聚糖的靜電聚合反應如圖1 所示。在0.05%海藻酸鈉溶液在微膠囊表面覆膜一定時間后,用0.50 g/L 檸檬酸鈉溶液對固芯微膠囊進行液化,制得雙菌共固定化的海藻酸鈉-殼聚糖-海藻酸鈣液芯微膠囊。

圖1 海藻酸鈣的羧基與殼聚糖的氨基靜電作用示意圖Fig.1 Electrostatic interaction between the carboxyl of sodium alginate and amino of chitosan
1.2.4.2 海藻酸鈉濃度的選擇 為了探究海藻酸鈉濃度對雙菌共固定微膠囊的影響,分別用9、12、15、18、21 g/L 的海藻酸鈉溶液制備ACA液芯微膠囊,并以Nisin 效價和發酵液菌體濃度為指標對微膠囊性能進行評價。
1.2.4.3 殼聚糖濃度的選擇 分別用4.5、5.0、5.5、6.0、6.5 g/L 的殼聚糖溶液對海藻酸鈣凝膠珠進行覆膜,制備雙菌共固定ACA 液芯微膠囊,并以Nisin 效價和發酵液菌體濃度為指標對微膠囊性能進行評價。
1.2.5 微膠囊固定細胞發酵耦合泡沫分離生產Nisin條件選擇
1.2.5.1 生產工藝 微膠囊固定細胞發酵-泡沫分離耦合裝置如圖2 所示,泡沫分離塔由高度600 mm、內徑40 mm 的有機玻璃管制成,與1.5 L 的發酵罐銜接在一起。在塔底安裝燒結玻璃制成的氣體分布器,氣體體積流率通過氣體轉子流量計進行調節。首先,將800 mL 滅菌后的發酵培養基裝入發酵罐。隨后,乳酸鏈球菌和釀酒酵母按一定比例接種到共培養發酵培養基中,30 ℃條件下培養一段時間。發酵-泡沫分離耦合操作開始后,將無菌空氣泵入泡沫分離塔產生氣泡。泡沫通過塔頂的倒L 形末端流入收集器中,并采用機械攪拌進行消泡。

圖2 固定化微囊發酵-泡沫分離耦合裝置Fig.2 Immobilized fermentation-foam fractionation containing microcapsules coupling device
1.2.5.2 耦合時間的篩選 發酵溫度為30 ℃、分布器孔徑為180 μm、氣體體積流率為60 mL/min,以富集比、回收率為評價指標,在發酵18~27 h 期間,探究耦合時間對Nisin 分離效率的影響。
1.2.5.3 分布器孔徑的篩選 發酵溫度為30 ℃、耦合時間為發酵24 h、氣體體積流率為60 mL/min,以富集比、回收率為評價指標,探究分布器孔徑(125、150、180、250 和425 μm)對發酵液中Nisin 分離效率的影響。
1.2.5.4 氣體體積流率的篩選 發酵溫度為30 ℃、耦合時間為發酵24 h、分布器為180 μm,以富集比、回收率為評價指標,探究氣體體積流率(20~120 mL/min)對發酵液中Nisin 分離效率的影響。
1.2.5.5 評價指標的測定 Nisin 的分離效率可通過富集比(E)和回收率(R,%)來評價,如式(1)和式(2)所示。

式中,Cf和Ce分別為消泡液和殘余發酵液中Nisin 的效價,IU/mL;Vf和Ve分別為消泡液和殘余發酵液的體積,mL。
1.3 數據分析
每組實驗重復3 次,并通過Origin 和Auto CAD軟件進行數據處理和分析。
2 結果與分析
2.1 乳酸鏈球菌與釀酒酵母共培養的可行性研究
如圖3 所示,乳酸鏈球菌與釀酒酵母共培養發酵液的生物量明顯高于這兩種菌的純培養。純培養發酵條件下,乳酸鏈球菌生長迅速,快速進入指數期,但20 h 后生物量呈現下降趨勢;而釀酒酵母生長較為緩慢,20 h 后開始進入指數期。發酵液初始pH 明顯高于釀酒酵母的最適pH4.0[34],所以在純培養發酵過程中釀酒酵母生長緩慢。共培養發酵條件下,乳酸鏈球菌分泌的有機酸會引起發酵液酸化,從而為釀酒酵母的生長提供了條件[35]。此外,已有研究表明乳酸菌和酵母菌之間存在營養促進作用,乳酸菌會刺激酵母菌生長并分泌氨基酸(如纈氨酸、亮氨酸)和維生素B6,進一步促進乳酸菌的生長繁殖和代謝過程[36],所以共培養發酵液的生物量明顯高于乳酸鏈球菌的純培養,且穩定期延長。因此,乳酸鏈球菌與釀酒酵母之間存在互利共生作用,可以進行共培養發酵。

圖3 乳酸鏈球菌和釀酒酵母的共培養和純培養生長曲線Fig.3 The growth curves of Lactococcu slactiss ubsp.lactis and Saccharomyces cerevisiae in pure cultivation and co-cultivation
2.2 共培養碳源篩選
由圖4 可知,以4%乳糖為碳源時,Nisin 效價和發酵液pH 均為最高,分別為3162.3 IU/mL 和5.27;以4%蔗糖和4%葡萄糖為碳源時,Nisin 效價十分接近。釀酒酵母不能代謝乳糖,僅能夠以乳酸鏈球菌代謝的副產物乳酸為碳源[37],從而解除乳酸鏈球菌發酵的pH 抑制,促進其生長代謝和Nisin 合成,因此乳糖培養基中Nisin 效價和pH 最高。然而,釀酒酵母和乳酸鏈球菌均可代謝葡萄糖和蔗糖生成乳酸,導致發酵液的pH 迅速降低,從而抑制Nisin 的生物合成。所以,4%葡萄糖發酵液和4%蔗糖發酵液的Nisin 效價和pH 明顯低于4%乳糖發酵液。因此,為了提高Nisin 產量,本研究選擇4%乳糖作為共培養發酵的底物碳源。

圖4 碳源類型對Nisin 效價和發酵液pH 的影響Fig.4 Effects of carbon source type on Nisin titer and pH of fermentation broth
2.3 乳酸鏈球菌與釀酒酵母的最佳接種比例
如圖5 所示,隨著乳酸鏈球菌與釀酒酵母接種比例的升高,Nisin 效價呈現先增加后降低的變化趨勢,pH 呈現逐漸降低的趨勢。隨著乳酸鏈球菌與釀酒酵母初始接種比例從10?1:1 增加到102:1 時,乳酸鏈球菌接種的初始細胞濃度逐漸增加,細胞生長和代謝速度加快,促進了Nisin 的快速合成。乳酸鏈球菌與釀酒酵母初始接種比例從102:1 增加到104:1 時,由于乳酸鏈球菌初始接種的細胞濃度較高,釀酒酵母不能完全吸收其分泌的有機酸,培養基酸化降低了乳酸鏈球菌細胞內酶的活性及其對營養物質的利用速率,從而降低了Nisin 的合成速率。因此,本研究中乳酸鏈球菌與釀酒酵母的最佳接種比例為102:1。

圖5 乳酸鏈球菌與釀酒酵母接種比例對Nisin 效價的影響Fig.5 Effects of inoculation ratio of L. lactis and S. cerevisiae on Nisin titer
2.4 ACA 液芯微膠囊細胞固定化條件優化
2.4.1 海藻酸鈉濃度的確定 如圖6 所示,海藻酸鈉濃度從9 g/L 增加到15 g/L 時,Nisin 效價緩慢降低;而海藻酸鈉濃度從15 g/L 增加到21 g/L 時,Nisin效價迅速下降。海藻酸鈉濃度從9 g/L 增加到15 g/L時,發酵液中菌體生物量明顯下降;海藻酸鈉濃度從15 g/L 增加到21 g/L 時,發酵液中菌體生物量平緩下降。海藻酸鈉濃度從9 g/L 增加到15 g/L 時,海藻酸鈉的-COO-和Ca2+逐漸結合充分,微膠囊壁膜的致密性和機械強度增加,發酵過程中剪切作用導致囊膜破裂,菌體細胞泄漏情況減少[38],因此,發酵液中的菌體生物量明顯下降,Nisin 效價緩慢降低。當海藻酸鈉濃度高于15 g/L 時,過高的海藻酸鈉濃度會引起溶液粘度增加,阻礙Ca2+的移動,限制其與-COO-的結合,造成微膠囊內所含活菌數下降,進一步影響Nisin 的合成與傳質,因此,發酵液中的菌體生物量降低,Nisin 效價變化明顯。綜合考慮微囊固定化效果和Nisin 效價,選擇15 g/L 的海藻酸鈉濃度制作乳酸鏈球菌與釀酒酵母的固定化微膠囊。
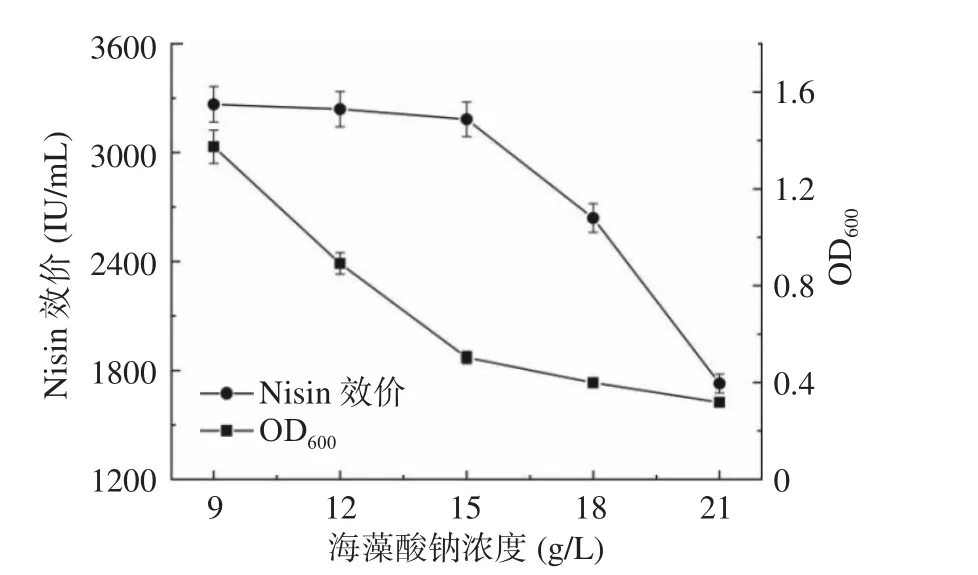
圖6 海藻酸鈉濃度對Nisin 效價和生物量的影響Fig.6 Effect of sodium alginate concentration on Nisin titer and biomass
2.4.2 殼聚糖濃度的確定 如圖7 所示,殼聚糖濃度從4.5 g/L 增加到5.5 g/L,Nisin 效價緩慢下降,發酵液中菌體生物量迅速下降。這是因為殼聚糖濃度越高,溶液中活潑氨基的數量越大,與海藻酸鈉分子中的-COO-發生交聯反應形成的半透膜致密程度越高,微膠囊壁膜的穩定性和支撐作用越高[10],對Nisin 的傳質效果影響較小。殼聚糖濃度從5.5 g/L 增加到6.5 g/L,Nisin 效價下降速度增加,發酵液中菌體生物量緩慢降低。這是由于過高的殼聚糖濃度會引起半透膜的滲透性降低,直接影響到營養物質和發酵產物在囊膜兩側的傳遞,不利于菌體細胞的生長和代謝。綜合考慮微膠囊傳質性能和Nisin 效價,選擇5.5 g/L的殼聚糖濃度制作乳酸鏈球菌與釀酒酵母的固定化液芯微膠囊。

圖7 殼聚糖濃度對Nisin 效價和生物量的影響Fig.7 Effects of chitosan concentration on Nisin titer and biomass
2.5 發酵-泡沫分離耦合生產Nisin 的工藝研究
2.5.1 耦合時間對Nisin 分離效率的影響 如圖8(A)所示,隨著耦合時間從18 h 增加到27 h,發酵液中Nisin 的效價呈現先增加后降低的趨勢,在耦合24 h 效價最高。隨著泡沫分離耦合微膠囊固定細胞耦合的起始時間越晚,Nisin 富集比先從4.7 下降到3.2,隨后增加至3.8;而其回收率先從61.2%增加至78.9%,然后下降到65.3 %。這是由于氣體鼓入發酵罐后,發酵液中Nisin 效價越高,Nisin 在氣泡表面的表面過剩越高,增加了氣泡表面液膜厚度和持液能力,從而提高泡沫的持液率和穩定性[39]。泡沫夾帶大量間隙液進入消泡液,Nisin 的富集比降低,回收率增加。

圖8 發酵-泡沫分離耦合時間對Nisin 的富集比/回收率和總效價的影響Fig.8 Effects of initial coupling time of fermentation and foam fractionationon enrichment ratio and recovery percentage of Nisin and total titer of Nisin
由圖8(B)所示,在任意耦合時間條件下,微膠囊固定細胞發酵-泡沫分離耦合操作Nisin 總效價均高于非耦合操作。并且在發酵21 h 后進行泡沫分離耦合操作時,發酵液中Nisin 總效價最高,為3824.7 IU/mL。當泡沫分離較早耦合于微膠囊固定細胞發酵時,氣泡會將大量營養物質帶離培養基,導致菌體細胞對底物基質的利用率降低,Nisin 的合成速率緩慢[40]。當泡沫分離耦合于微膠囊固定細胞發酵的起始時間較晚時,Nisin 在發酵液中的積累會對菌體細胞產生產物抑制,抑制其自身的合成。綜合以上分析,可在微膠囊固定細胞發酵21 h 進行發酵-泡沫分離耦合操作回收Nisin。
2.5.2 分布器孔徑對Nisin 分離效率的影響 如圖9所示,隨著氣體分布器孔徑從125 μm 增大到425 μm,Nisin 富集比由4.3 增大至6.9,其回收率由79.1%下降到48.9%;Nisin 總效價由3452.1 IU/mL 增加到4113.2 IU/mL。氣體分布器的孔徑越大,液相中氣泡的初始尺寸越大[41]。小尺寸氣泡在液相中上升速度慢,有利于Nisin 分子吸附在氣泡表面,增大氣泡周圍液膜的厚度,所形成的泡沫穩定性越強,將大量發酵液夾帶出發酵體系,不利于菌體細胞的生長代謝。與小氣泡相比,大氣泡界面能更低,氣泡之間聚結和歧化作用會降低泡沫穩定性,導致發酵液夾帶能力差,營養物質損失少。因此,隨著氣體分布器孔徑的增加,Nisin 的富集比增加,回收率降低,總效價增加。綜合考慮Nisin 的富集比、回收率以及總效價,選擇孔徑為180 μm 的氣體分布器進行發酵-泡沫分離耦合操作。

圖9 氣體分布器孔徑對Nisin 的富集比、回收率和總效價的影響Fig.9 Effects of pore diameter of gas distributor on enrichment ratio andrecovery percentage of Nisin, and total titer of Nisin
2.5.3 氣體體積流率對Nisin 分離效率的影響 如圖10 所示,隨著氣體體積流率從20 mL/min 升高到120 mL/min,Nisin 富集比由6.5 下降到3.8,而其回收率由52.1%增加到83.7%。同時,發酵液中Nisin 總效價由4083.1 IU/mL 降至3469.8 IU/mL。隨著氣體體積流率的增加,溶液中氣泡的生成速度加快,氣泡在分離塔內的停留時間縮短,且泡沫的迅速堆積增加了plateau 邊界通道數量,阻礙了夾帶溶液的回流[42]。泡沫的持液率較高,導致發酵液中營養物質的大幅度減少。因此,隨著氣體體積流率的增加,Nisin 的回收率增加,富集比下降。此外,氣體體積流率越大,發酵液的氣含率越高,氣泡運動對液芯微膠囊膜造成的剪切破壞越強。綜合考慮Nisin 的富集比、回收率以及總效價,選擇40 mL/min 作為發酵-泡沫分離耦合操作的最適氣體體積流率。

圖10 氣體體積流率對Nisin 的富集比、回收率和總效價的影響Fig.10 Effects of volumetric air flow rate on enrichment ratio andrecovery percentage of Nisin, and total titer of Nisin
綜上,利用微膠囊固定細胞發酵耦合泡沫分離生產Nisin,在耦合時間為21 h,分布器孔徑180 μm,氣體體積流率40 mL/min 條件下,Nisin 的富集比和回收率分別為5.8 和63.1 %,總效價為3973.2 IU/mL。
3 結論
本文開發了一種乳酸鏈球菌與釀酒酵母雙菌微囊化發酵與泡沫分離耦合強化Nisin 生產的新工藝,并對操作參數進行優化。實驗結果表明,以4%乳糖為底物碳源,乳酸鏈球菌與釀酒酵母的初始接種比例為102:1 時,共培養發酵液中Nisin 效價較乳酸鏈球菌純培養顯著提高。采用ACA 液芯微膠囊包埋乳酸鏈球菌與釀酒酵母,其制備條件為海藻酸鈉濃度15 g/L 和殼聚糖濃度5.5 g/L。利用微膠囊固定細胞發酵耦合泡沫分離生產Nisin,在耦合時間為21 h,分布器孔徑180 μm,氣體體積流率40 mL/min 條件下,Nisin 的富集比和回收率分別為5.8 和63.1 %,總效價為3973.2 IU/mL。

