1-MCP 處理期不同成熟度‘霞暉8 號’桃果實貯藏中品質和生理生化特性的影響
侯佳迪,朱麗娟,王軍萍,劉少偉,郁志芳
(南京農業大學食品科技學院,江蘇南京 210095)
水蜜桃是我國桃果實的主要類型,在我國中南部地區栽培廣泛。其果實汁液豐富、甜度高、口感好;富含多種維生素,其中以維生素C 含量最高,其蛋白質和鐵含量也比蘋果高3~5 倍;除此之外,水蜜桃還具有美膚、清胃、祛痰潤肺等功效,深受消費者喜愛,尤其是中晚熟品種[1]。水蜜桃采收期間高溫、雨水多,易受到外界微生物侵染[2],進而影響果實的商品性和貯藏時間。
水蜜桃作為一種成熟期短且貯藏困難的水果,采用適當的保鮮技術和方法以延緩果實的衰老、延長貨架期十分必要。目前,關于水蜜桃貯藏保鮮技術已有較多研究,如Zhao 等[3]使用熱空氣和瓜氏畢赤酵母處理桃果實,發現二者單獨處理均可以在不同程度上改善桃果實質量指標,在聯合處理后能夠明顯提高總酚含量并減少了谷胱甘肽含量,抑制丙二醛和相對電導率的上升。Zhu 等[4]則提出一氧化氮可能與ACC 氧化酶結合形成ACC 氧化酶-NO 復合物,該復合物經過與ACC 螯合,阻斷乙烯生成通路,減少乙烯釋放量。Liu 等[5]初步研究結果顯示,5 μL/L 1-MCP 可以有效地延遲桃果實中陽性酚類化合物峰值的出現并抑制總抗氧化活性。李軍等[6]研究提出,采用1.0 μL/L 1-MCP 熏蒸12 h 結合0.02 mm MAP包裝處理‘湖景蜜露’可有效維持貯藏期間果實琥珀酸脫氫酶和細胞色素氧化酶的活性,減弱細胞呼吸代謝,延緩果實采后后熟及衰老進程。目前,對水蜜桃貯藏保鮮技術的探索多采用成熟度較高的果實為對象,對于成熟度稍低的果實研究較少。本實驗以‘霞暉8 號’為實驗材料,深入探究1-MCP 處理對不同成熟度水蜜桃果實常溫貯藏期間品質和生理生化特性的影響,為1-MCP 高效應用于采后水蜜桃保鮮技術的開發提供實踐依據。
1 材料與方法
1.1 材料與儀器
‘霞暉8 號’水蜜桃 于2019 年7 月30 日采自江蘇省溧水市北山桃園,果實采收后以空調運輸車2 h內送至實驗室,20 ℃條件下選取無病蟲害、無機械傷、大小均勻果實用于實驗,果實根據硬度分為低成熟度和高成熟度兩組。三氯乙酸 分析純,上海凌峰化學試劑有限公司;2-硫代巴比妥酸(生化試劑)、愈創木酚(化學純)、30%過氧化氫溶液(分析純) 上海滬試化工有限公司;氮藍四唑 含量>98%,上海瑞永生物科技有限公司;L-甲硫氨酸 含量>98%,上海瑞永生物科技有限公司;核黃素 中國惠興生化試劑有限公司;二硫代硝基苯甲酸、無水乙醇 分析純,廣東光華科技股份有限公司;L-抗壞血酸 含量>99.99%,麥克林;Ttiton X-100 化學純,上海源葉生物科技有限公司;碘 分析純,國藥集團化學試劑有限公司;硫代硫酸鈉 分析純,南京壽德試驗器材有限公司;可溶性淀粉 西隴科學股份有限公司;其余所有試劑 均為分析純。
FE30 電 導 率 儀 METTLER TOLEDO 公 司;PAL-1G 迷你電子數顯折光儀 ATAGO 公司;GY-4 果實硬度計 深圳市朗普電子科技有限公司;6890N 氣相色譜儀(配有氫火焰離子檢測器和聯機工作臺)、19095P-S23 氣相色譜毛細柱(30 m×0.53 mm)
安捷倫科技(中國)有限公司;Checkmate 3 二氧化碳呼吸測定儀 Dansensor 公司;H1750R 臺式高速冷凍離心機 湖南湘儀實驗室儀器開發有限公司;Alpha-1860A 紫外可見分光光度計(配有石英比色皿和玻璃比色皿) 上海譜元儀器有限公司;XW-80A 微型旋渦混合儀 上海滬西分析儀器廠有限公司。
1.2 實驗方法
1.2.1 材料及處理方法 將低成熟度和高成熟度的‘霞暉8 號’桃果實分別隨機分為兩組,一組用于1-MCP 處理,一組為對照。分組的果實放入泡沫箱中,以10 μL/L 的1-MCP 處理并保持密閉12 h,處理結束后將果實放入塑料袋中并置于塑料筐在(20.0±1.0)℃貯藏;以同樣方式操作但不進行1-MCP 處理為對照(CK)。貯藏期間分別于0、2、4 和6 d 測定果實的品質和生理生化指標。測定每樣品20 個果實,每處理3 個平行樣品。
1.2.2 硬度和可溶性固形物的測定 硬度測定根據Denoya 等[7]的方法并稍作修改,使用GY-4-J 水果硬度計,用直徑為8.0 mm 的錐形探針頭在10 mm最終穿透深度處固定的紋理分析儀來測定桃果實的硬度。去除1 mm 果皮的每個水果赤道的對側進行了兩次測量,結果用牛頓(N)表示。可溶性固形物使用ATAGO 迷你數顯折射計測定,測定結果根據當前室溫進行校正,結果以%表示。
1.2.3 呼吸速率和乙烯釋放量的測定 呼吸速率采用呼吸儀法進行測定,取800 g 左右完整桃果實(約4 個)放入密封的呼吸罐中,于20 ℃下放置1 h。各處理及三個平行樣品的質量相近。呼吸速率直接用呼吸測定儀測定,結果表示為 CO2mg·kg?1·h?1,計算公式如下
呼吸強度(CO2μg/ kg·h)=(1.96×1000×V×A%)/(t×m)
式中:CO2密度為1.96×103g/L,A%為呼吸儀數值,m 為樣品重量,kg,t 為測定時間,h。
乙烯釋放量使用安捷倫6890N 氣相色譜儀測定,抽取1 ml 上述放置1 h 后呼吸罐中的氣體,注射入備有火焰離子化檢測器的氣相色譜儀中檢測,采用外標法定量,結果表示為μL?1·kg?1·h?1。
GC 條件 色譜柱:19095P-S23 石英毛細柱(30 m×0.53 mm,0.25 μm);后進樣口:120 ℃;后檢測口250 ℃;保留時間4 min;氫氣流速30 mL/min,空氣流速260 mL/min,尾吹氣(氮氣)流速30 mL/min;柱箱溫度100 ℃,進樣量1 mL。

丙二醛(MDA)測定參照Shah 等[8]的實驗方法并稍做修改。取2 g 桃果實樣品用5 mL 5%的三氯乙酸在冰浴上研磨勻漿,勻漿液以10000 r/min 的轉速在4 ℃下離心10 min,取上清液即為MDA 提取液,再取2 mL 提取液,于100 ℃水浴保溫30 min,靜置放涼后于波長450、532 和600 nm 下測定OD 值,最終結果表示為μmol·g?1FW。
MDA(μmol/L)=6.45×(A532?A600)?0.56×A450
1.2.5 超氧化物歧化酶(SOD)和過氧化物酶(POD)活性的測定 用NBT 熒光法測定SOD 活性,取2 g桃果實加入6 mL 預冷的磷酸緩沖液(pH 7.8,50 mmol/L)在冰浴上研磨成漿,10000 r/min 轉速4 ℃下離心20 min,取上清液按加入反應試劑。暗中對照管加入核黃素后立即用錫箔紙裹住遮光,全部試劑加完后搖勻。將其余6 管放在4000 Lx 日光燈下顯色反應45 min。反應結束后用黑布遮蓋終止反應。以暗中對照管作為空白(調零),在560 nm 處抑制NBT 光還原的50%為1 個酶活性單位(U),最終結果表示為 U·g?1FW。
SOD( U·g?1FW) =( OD對照?OD樣品) ×V/(50%×OD對照×Vs×m×t)
式中:SOD 總活性以鮮重酶單位每克表示;比活力單位以酶單位每毫克蛋白表示;OD 對照為光照對照管的吸光度;OD 樣品為樣品管的吸光度;V 為樣品液總體積,mL;Vs 為測定時樣品用量,0.1 mL;t 為反應時間(h),min;m 為樣品質量,g。
POD 活性測定方法參照張玉敏[9]的方法并稍作修改,稱取2 g 桃果實樣品于研缽中,加入6 mL 磷酸緩沖液(pH 7.8,50 mmol/L)在冰浴上研磨成漿,勻漿液于4 ℃ 12000 r/min 轉速離心30 min,取上清液進行后續測定。再吸取1 mL 上清液,加入0.3%愈創木酚溶液2.2 mL,再加入0.3% H2O20.6 mL,每隔1 min 記錄吸光值A470的讀數,連續記錄3~5 min。POD 以每分鐘內吸光度A470變化0.001 所需的酶量為1 個酶活力單位,結果表示為U·min?1·g?1FW。
1.2.6 還原型抗壞血酸(RASA)和還原型谷胱甘肽(RGSH)含量的測定 RASA 測定方法根據紅菲羅啉比色法并略作修改,稱取5 g 樣品加入10 mL 50 g/L TCA 溶液,在冰浴條件下研磨成漿狀,4 ℃ 12000 r/min 條件下離心10 min,取1 mL 上清液加入1 mL 50 g/L TCA 溶液,于534 nm 處根據吸光值和標準曲線計算含量,結果表示為μg·g?1FW。RGSH 含量測定參照Wang 等[10]的實驗方法并稍作修改,取2 g樣品加入4 mL 4 ℃預冷的50 g/L TCA,冰浴研磨勻漿,勻漿液于4 ℃ 12000 r/min 條件下離心20 min,取1 mL 上清液,加入1 mL pH 7.8 0.1 mol / L PBS、0.5 mL 4 mmol / L 二硫代硝基苯甲酸,充分混勻后在412 nm 處根據吸光值和標準曲線計算含量,結果表示為 μg·g?1FW。
1.2.7 原果膠和聚半乳糖醛酸酶(polygalacturonase,PG)的測定 原果膠測定采用咔唑法[11]。稱取樣品5 g 研磨呈勻漿,加入50 mL 95%的乙醇,于沸水浴上加熱30 min,重復3 次。過濾,濾渣放入三角瓶中,加40 mL 水,60 ℃水浴上加熱30 min。過濾并洗滌濾紙和濾渣,濾渣放入三角瓶中,加50 mL 0.5 mL/L 硫酸,沸水浴加熱1 h,過濾,洗滌濾渣,合并洗滌液冷卻后移入100 mL 容量瓶中定容。吸取定容后測定液1 mL,沿試管壁緩慢加入6 mL 濃硫酸,混勻后沸水浴上加熱20 min,冷卻至室溫,加入0.2 mL 0.15%咔唑溶液,搖勻后于暗處放置2 h,于530 nm 波長處測定吸光度值,根據標準曲線計算原果膠含量。聚半乳糖醛酸酶測定方法參考莊青[12]的實驗方法并稍作修改。稱取50 g 桃組織樣品,勻漿后過濾待測,取3~5 mL 加入10 mL 1%果膠溶液(pH 3.5)和5 mL 水(調到pH 3.5),置于50 ℃水浴中保溫2 h。取出后煮沸,冷卻至室溫待測。吸取5 mL 上述反應液,注入150 mL 的碘量瓶中,加1 mL 1 mol/L Na2CO3溶液和5 mL 0.1 mol/L 碘溶液,搖勻塞緊,室溫下靜置20 min(加入2 mL 1 mol/L H2SO4溶液,用0.05 mol/L Na2S2O3標準液滴定于淡黃色,加0.5%淀粉指示劑1 mL 繼續滴定至藍色消失為止,以不加酶液作空白)。上述條件下,每小時催化果膠分解生成1 mg 游離半乳糖醛酸定為一個酶活力單位。
1.2.8 琥珀酸脫氫酶(SDH)和細胞色素氧化酶(CCO)的測定 桃組織樣品線粒體提取參照Palou 等[13]的方法,按1:4 的比例稱取樣品,加入4 ℃預冷的提取液(提取液包括50 mmol/L pH 7.5 Tris-HCl、1 mmol/L EDTA、0.1% BSA、0.5% PVP、0.1%
半胱氨酸、0.25 mol/L 蔗糖、0.3 mol/L 甘露醇)、勻漿3 次,每次15 s,用4 層紗布過濾,濾液4 ℃3000 r/min 離心20 min,取上清液4 ℃ 14000 r/min離心20 min,沉淀用80 mL 洗滌液(含1 mmol/L EDTA、0.1% BSA、10 mmol/L pH 7.2 Tris-HCl、0.25 mol/L 蔗糖、0.3 mol/L 甘露醇)洗滌,4 ℃14000 r/min 離心20 min,重復洗滌步驟,得到沉淀即為粗線粒體。用4 mL 懸浮液(內含10 mmol/L pH 7.2 Tris-HCl、0.25 mol/L 蔗糖、0.3 mol/L 甘露醇、1 mmol/L EDTA)懸浮粗線粒體沉淀,懸浮液即為線粒體制備液,用于SDH 和CCO 活性的測定。
SDH 活性測定參照Ackrell 等[14]方法并稍作修改。反應混合液包括0.5 mL 0.2 mmol/L pH 7.4 磷酸鉀緩沖液、0.5 mL 0.2 mol/L pH 7.4 琥珀酸鈉、0.2 mL 0.9 mmol/L 2,6-二氯酚靛酚鈉(DCPIP)和蒸餾水。置于30 ℃條件下保溫5 min,然后加1.0 mL線粒體制備液混勻,測定時加0.5 mL 0.33%甲硫酚嗪(PMS)搖勻,于600 nm 處測定吸光值的變化。CCO 活性測定參照Errede 等[15]的方法并稍作修改。反應系統包括:1.75 mL 200 mmol/L pH 7.4 磷酸鉀緩沖液、0.5 mL 蒸餾水、0.5 mL 2% Triton X-100 和1 mL 線粒體制備液。放置在30 ℃條件下保溫2 min,加入0.5 mL 20 mol/L 還原型細胞色素C,立即測定550 nm 處吸光值的變化。
1.3 數據處理
試驗重復3 次,每組3 個平行,所有數據均為平行樣品的平均值,以±s 表示。數據使用Excel 2019 處 理, SAS V8.0 進 行 ANOVA 分 析, 用Duncan’s 方差分析進行差異顯著性檢驗,其中P<0.05 為顯著差異水平。
2 結果與分析
2.1 1-MCP 處理對桃果實硬度和可溶性固形物含量變化的影響
果實硬度是最主要的品質指標之一,其變化可用于判斷貯藏期間果實品質的改變大小。圖1 顯示,貯藏期間‘霞暉8 號’桃果實的硬度均發生不同程度的下降,且前兩天下降明顯,低成熟度果實的硬度在貯藏期間的各測定時間均顯著高于高成熟度;貯藏6 d 后果實硬度大小為低成熟度1-MCP>低成熟度CK>高成熟度1-MCP>高成熟度CK,1-MCP 處理低成熟度和高成熟度果實的硬度分別為25.93 N和4.99 N,均顯著高于兩種成熟度對照果實同時間測定的8.42 N 和3.41 N,表明1-MCP 對延緩低成熟度果實的硬度下降更有效。
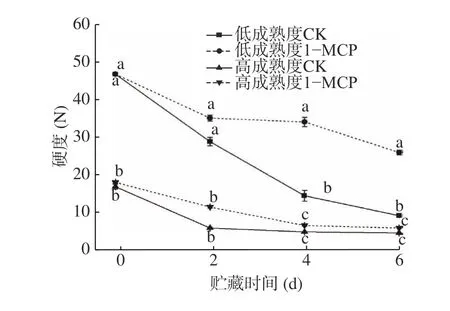
圖1 1-MCP 處理對兩種不同成熟度果實硬度變化的影響Fig.1 Effect of 1-MCP treatment on firmness change of peach fruits harvested at two maturity
可溶性固形物是果實風味的主要物質基礎,‘霞暉8 號’桃果實貯藏期間可溶性固形物的變化如圖2 顯示。貯藏6 d 期間,對照和1-MCP 處理的兩種成熟度果實的可溶性固形物均有下降,低成熟度果實的對照和處理果實間可溶性固形物貯藏期間變化差異不顯著,高成熟度對照和處理果實的可溶性固形物除第4 d 外都有顯著差異,但從圖2 看出,1-MCP不論對成熟度高低的桃果實處理與否,可溶性固形物總體下降規律變化不大,說明1-MCP 處理對桃果實在貯藏期間可溶性固形物的變化影響不大。
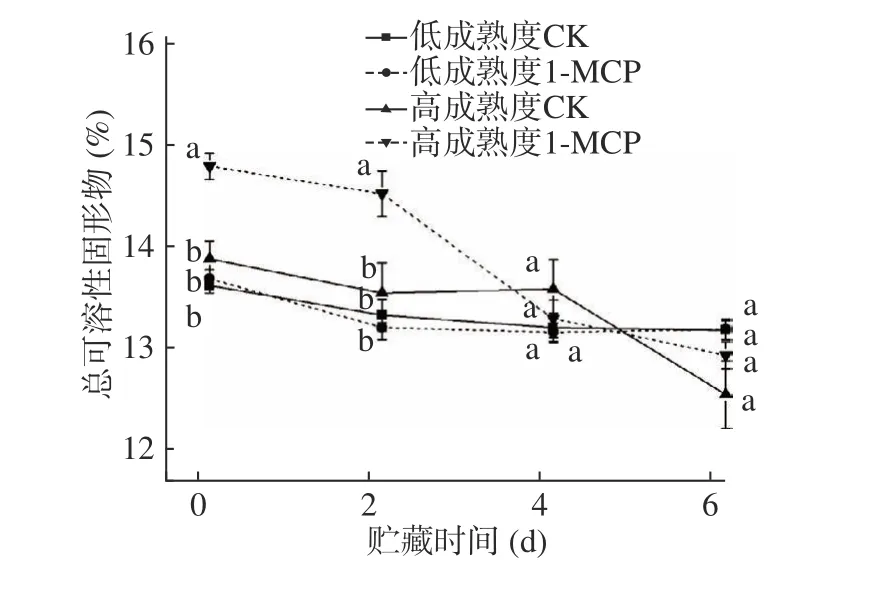
圖2 1-MCP 處理對兩種不同成熟度果實總可溶性固形物變化的影響Fig.2 Effect of 1-MCP treatment on total soluble solid change of peach fruits harvested at two maturity
2.2 1-MCP 處理對桃果實乙烯釋放量和呼吸速率的影響
桃果實屬呼吸躍變型果實,呼吸強度變化可反映果實的衰老進程[16];乙烯在果實貯藏過程中起到調控成熟的關鍵作用,內源乙烯的合成及信號傳導直接關系到果實的成熟速率。圖3 顯示,高成熟度對照果實第2 d 出現乙烯最大值,而1-MCP 處理的高成熟度果實和低成熟度果實乙烯高峰出現在貯藏第4 d,且對于高成熟度果實,1-MCP 處理延遲了乙烯高峰,顯著減少了乙烯釋放量,峰值較對照降低了15.88%。以上結果表明,1-MCP 能有效抑制不同成熟度果實乙烯釋放,在延緩果實成熟衰老方面有顯著效果。
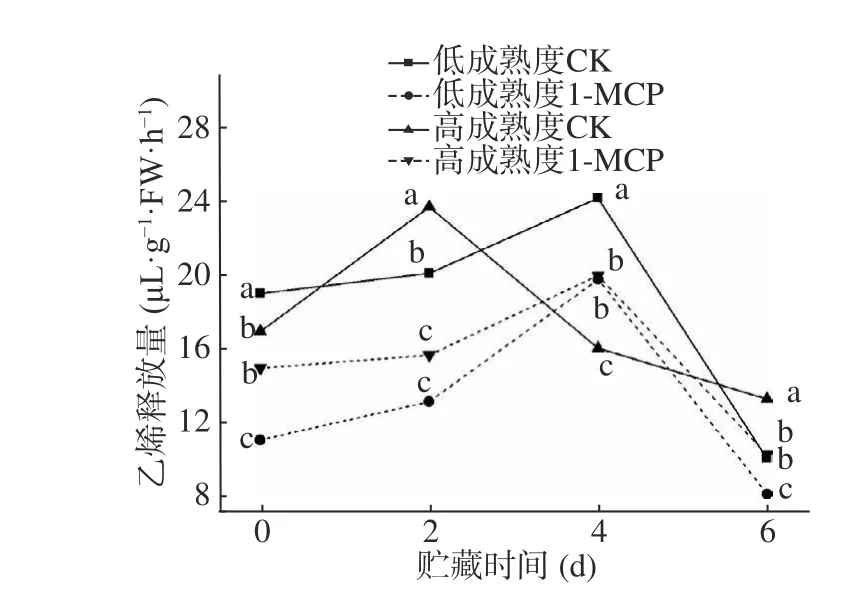
圖3 1-MCP 處理對兩種不同成熟度果實乙烯釋放量變化的影響Fig.3 Effect of 1-MCP treatment on ethylene release change ofpeach fruits harvested at two maturity
兩種成熟度的‘霞暉8 號’果實經1-MCP 處理后,貯藏期間呼吸強度均顯著低于同時間的對照果實,高成熟度果實整體呼吸強度顯著高于低成熟度果實(圖4)。躍變型果實成熟期間,乙烯生物合成與呼吸作用存在相關,比較1-MCP 處理對兩種成熟度‘霞暉8 號’果實乙烯釋放和呼吸速率影響可見,作用效果是一致的,符合1-MCP 作用機制的研究結果[17]。值得注意的是,四組桃果實的呼吸高峰出現時間均晚于乙烯高峰,當乙烯釋放量達到峰值時,果實呼吸速率恰好處于初步上升階段,原因是乙烯高峰的出現加速果實成熟進程,促進代謝消耗,進而提高了果實的呼吸速率[18?19]。

圖4 1-MCP 處理對兩種不同成熟度果實呼吸速率變化的影響Fig.4 Effect of 1-MCP treatment on breathing rate change of peach fruits harvested at two maturity
2.3 1-MCP 處理對桃果實相對電導率和丙二醛(MDA)含量的影響
電導率的變化可以判斷果實細胞的受損程度[20]。由圖5 可知,不論是低成熟度組還是高成熟度組,在貯藏全過程中電導率均呈上升趨勢,低成熟度果實電導率整體低于同期高成熟度果實。兩種不同成熟度果實初始電導率分別在40%和55%左右,1-MCP 處理可以顯著抑制貯藏期間電導率的上升,其中貯藏前期,對照組和處理組相對電導率差異較小,隨著貯藏的推進,兩者的差異逐漸增大,在貯藏后期(第6 d),兩成熟度對照組和處理組相對電導率均存在顯著差異(P<0.05)。結果表明,1-MCP 能有效維持細胞膜完整性,防止細胞破裂受損,避免果實細胞液過度流失,且對于低成熟度果實貯藏中后期作用效果更明顯。MDA 含量常用于評價植物膜脂過氧化強弱和果實成熟衰老的指標[21]。由圖6 可知,兩種成熟度果實MDA 含量隨貯藏時間的延長而增加,且以1-MCP 處理果實中MDA 含量較同成熟度同時間對照果實為低,相較于高成熟度組,1-MCP 在抑制低成熟度果實貯藏后期MDA 的升高具有更顯著的效果,對照和處理果實第6 d 的MDA 含量分別為2.54 μmol·g?1FW 和2.35 μmol·g?1FW,達到顯著差異,推測是因為貯藏后期組織細胞更易受到氧化影響,1-MCP 可以降低細胞膜脂受氧化程度,進而對MDA 增加有一定的抑制作用,表明1-MCP 對于維持桃果實組織完整性,延長商業貨架期具有重要意義。

圖5 1-MCP 處理對兩種不同成熟度果實相對電導率變化的影響Fig.5 Effect of 1-MCP treatment on relative conductivity change of peach fruits harvested at two maturity
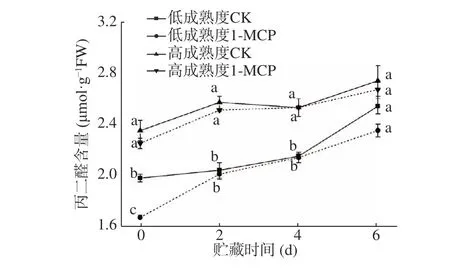
圖6 1-MCP 處理對兩種不同成熟度果實丙二醛變化的影響Fig.6 Effect of 1-MCP treatment on MDA change of peach fruits harvested at two maturity
值得注意的是,無論低或高成熟度果實還是1-MCP 處理與否,貯藏期間桃果實中的MDA 含量和電導率變化保持一致,表明膜脂過氧化與細胞膜通透性存在相關性,與Huan 等[22]的研究結果一致,且1-MCP 處理果實在保持低成熟度果實細胞正常形態方面具有更好的效果。
2.4 1-MCP 處理對桃果實超氧化物歧化酶(SOD)和過氧化物酶(POD)活性的影響
SOD 活性可以直觀地反映果實受到氧化的程度[23]。由圖7 可知,貯藏期間四組果實SOD 活性均有不同程度的上升。低成熟度處理組相較于其對照組明顯延后并減緩了SOD 活性的升高,在整個貯藏期間呈現先下降后上升的趨勢;高成熟度桃果實中,對照和處理果實SOD 活性在整個貯藏期間無顯著差異(P>0.05),貯藏第6 d 兩組果實SOD 活性分別為0.95 U·g?1FW 和0.92 U·g?1FW。表明1-MCP 對低成熟度桃果實SOD 活性影響顯著,而對高成熟度果實貯藏全過程影響較小。
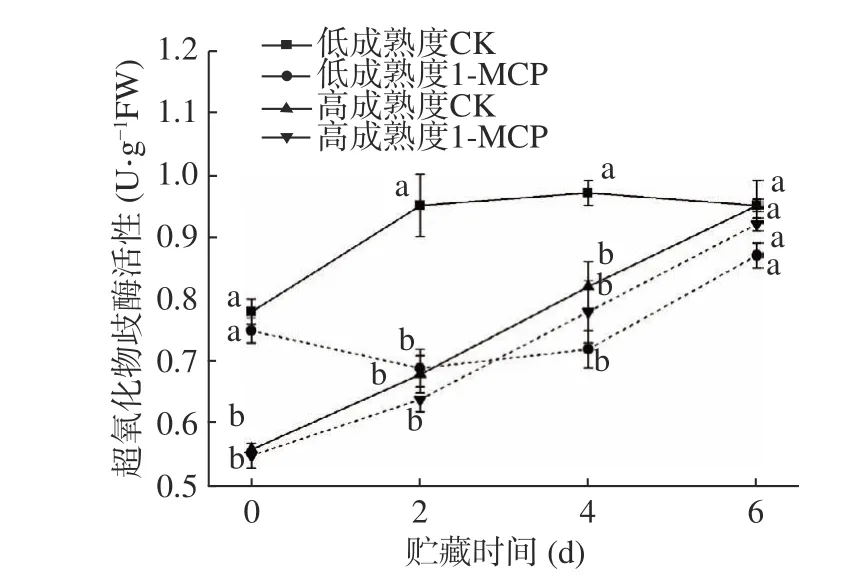
圖7 1-MCP 處理對兩種不同成熟度果實超氧化物歧化酶活性變化的影響Fig.7 Effect of 1-MCP treatment on SOD activity change of peach fruits harvested at two maturity
植物體中含有大量活性較高的過氧化物酶,其與植物的呼吸作用、光合作用及生長素的代謝等都有密切關系,可作為組織成熟衰老的一個重要指標[24]。圖8 顯示,貯藏前期四組果實POD 活性均處于較低水平,隨著貯藏的推進,各組POD 活性上升,在貯藏第6 d,兩成熟度處理組果實POD 活性均顯著低于各自對照組,但兩處理組之間活性并未出現顯著差異。
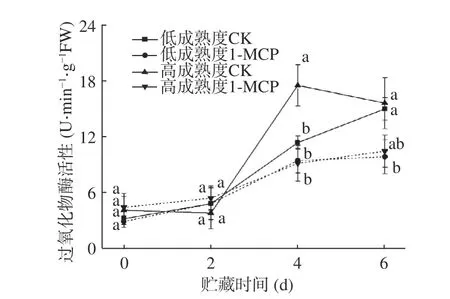
圖8 1-MCP 處理對兩種不同成熟度果實過氧化物酶活性變化的影響Fig.8 Effect of 1-MCP treatment on POD activity change of peach fruits harvested at two maturity
氧化酶系活性變化在植物成熟衰老期間起到非常最重要的作用,隨著貯藏的進行,SOD 和POD 活性總體呈上升趨勢,1-MCP 可以減緩低成熟度果實在貯藏前期氧化酶活快速上升,說明1-MCP 處理可以降低果實受氧化程度,延緩果實衰老。
2.5 1-MCP 處理對桃果實還原型抗壞血酸(RASA)和還原性谷胱甘肽(RGSH)含量的影響
果實中抗壞血酸的氧化型和還原型含量多少及比例可反映果實成熟衰老過程中被氧化的程度。由圖9 得知,除貯藏前兩天的低成熟度果實,RASA 含量總體呈下降趨勢,RASA 積累速度大于氧化分解速度,貯藏第2 d,對照果實和處理果實RASA 含量達到最大值。貯藏中后期,果實逐步走向衰老,內部生理代謝與外界環境加速RASA 的氧化分解;高成熟度桃果實中,兩組果實的RASA 含量在整個貯藏過程呈下降趨勢,且至貯藏后期含量無顯著差異(P>0.05)。以上結果表明,1-MCP 能夠有效延緩桃果實RASA 含量的下降,以貯藏前期作用效果更為顯著。
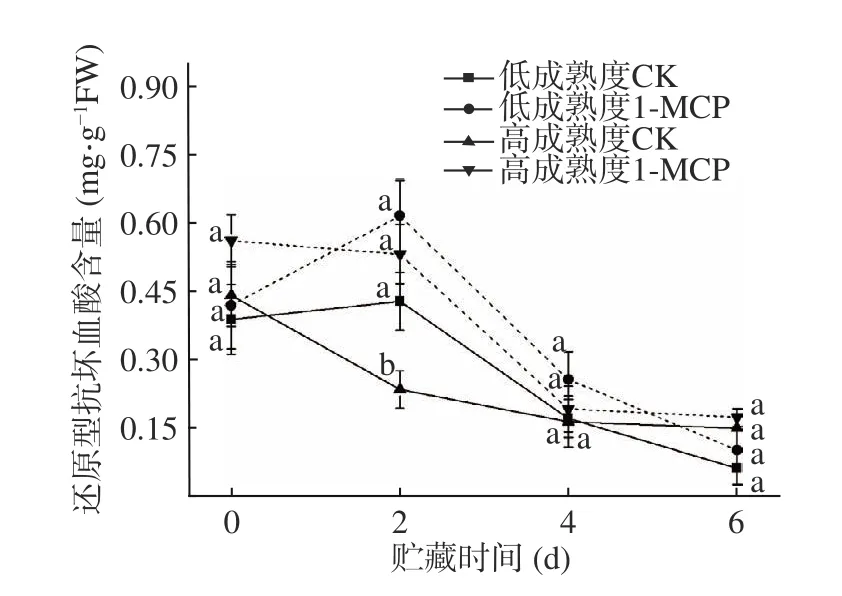
圖9 1-MCP 處理對兩種不同成熟度果實還原型抗壞血酸變化的影響Fig.9 Effect of 1-MCP treatment on ASA change of peach fruits harvested at two maturity
與抗壞血酸類似,谷胱甘肽在果實內部存在的兩種形態也會進行轉化。兩成熟度桃果實RGSH 變化趨勢與RASA 相似(圖10),其中低成熟度果實RGSH 第2 d 出現最大值,且以1-MCP 處理的為高(28.71 μg·g?1FW,比對照多61.80%),貯藏后期明顯降低;兩組高成熟度桃果實貯藏期間RGSH 含量呈下降趨勢,貯藏前中期下降幅度較大,后期逐漸趨于穩定。不管是低還是高成熟度果實,1-MCP 處理都能使桃果實保持較高的RGSH 含量[25]。
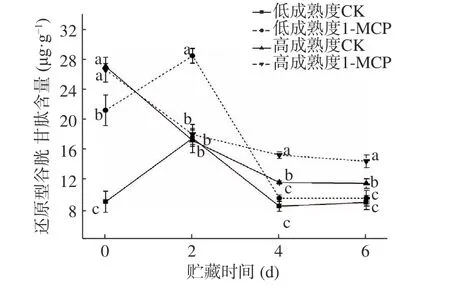
圖10 1-MCP 處理對兩種不同成熟度果實還原型谷胱甘肽變化的影響Fig.10 Effect of 1-MCP treatment on GSH change of peach fruits harvested at two maturity
1-MCP 處理可以有效保持桃果實的還原型RGSH 含量,表明1-MCP 能調節氧化還原代謝,維持細胞正常代謝,進而調節果實成熟衰老進程,這與1-MCP 作用當前研究結果相符[26]。
2.6 1-MCP 處理對桃果實原果膠和聚半乳糖醛酸酶(PG)活性的影響
原果膠在貯藏期間受到果膠酶、果膠甲酯酶和纖維素酶的共同作用,轉變為可溶性果膠,是導致果實成熟期硬度下降的主要原因[27]。如圖11 所示,貯藏期間兩種成熟度果實原果膠含量變化趨勢一致,在貯藏中期,PG 活性增強,原果膠含量快速下降,表現為果實硬度急劇降低;貯藏第6 d 時,兩種成熟度處理果實原果膠含量分別為同期對照組的1.88 倍和1.14 倍。結果表明,1-MCP 對果膠成分的轉變具有抑制效果,可以減緩原果膠向可溶性果膠的轉變,其中以低成熟度果實作用效果更為明顯。
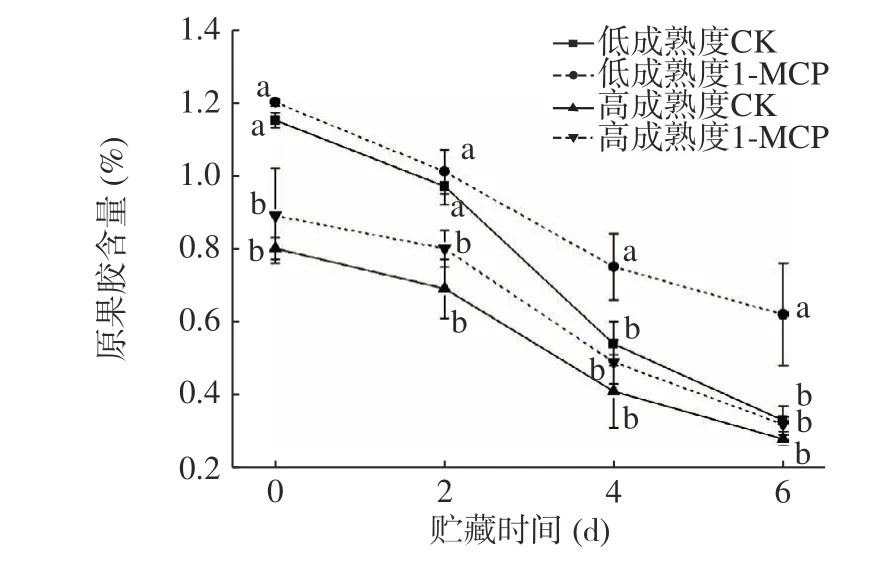
圖11 1-MCP 處理對兩種不同成熟度果實原果膠變化的影響Fig.11 Effect of 1-MCP treatment on protopectin change of peach fruits harvested at two maturity
果膠水解過程中,聚半乳糖醛酸酶可以催化果膠中的聚甲基半乳糖醛酸殘基水解,將細胞間層和細胞壁中的原果膠轉變為可溶性果膠。從圖12 可以看出,果實貯藏前期PG 活性較低;隨著貯藏進行,PG 活性出現最大值,兩處理組在第4 d PG 活性較同期對照組分別降低了25.75%和7.44%。可以得出,PG 對桃果實內果膠的水解作用主要發生在貯藏中后期,與本實驗中原果膠含量下降速率變化保持一致,其中1-MCP 處理低成熟度果實抑制PG 活性效果明顯好于高成熟度果實。
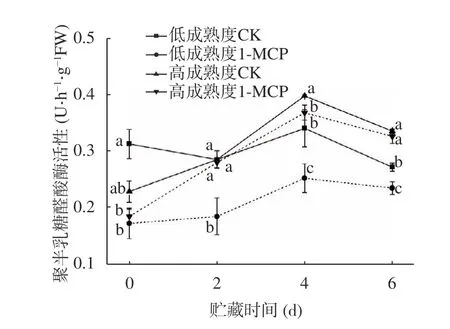
圖12 1-MCP 處理對兩種不同成熟度果實聚半乳糖醛酸酶活性變化的影響Fig.12 Effect of 1-MCP treatment on PG activity change of peach fruits harvested at two maturity
在果實成熟衰老過程中,果膠形態的轉變與果實硬度存在密切關聯,對比1-MCP 對兩種成熟度桃果實貯藏期間原果膠、PG 活性和硬度的變化影響可知,其作用效果保持一致,且以處理低成熟度果實效果為佳。1-MCP 對于果實貯藏期間原果膠向可溶性果膠的轉變具有延緩作用,同時可以抑制PG 活性的提升,對于維持桃果實硬度和組織細胞完整性存在關鍵作用[28]。
2.7 1-MCP 處理對桃果實琥珀酸脫氫酶(SDH)和細胞色素氧化酶(CCO)活性的影響
位于線粒體內膜、連接電子傳遞和氧化磷酸化的SDH 是反映細胞呼吸功能的一種標志酶,其活性可作為TCA 循環進行程度的重要指標[29]。由圖13可知,不論是低成熟度還是高成熟度桃果實,SDH 活性均呈下降趨勢,1-MCP 處理果實在貯藏前中期SDH 活性顯著高于對照組,而在貯藏末期,處理和對照組低成熟度果實SDH 活性無顯著差異(P>0.05)。結果顯示,1-MCP 可以通過維持胞內高水平SDH 活性,穩定呼吸鏈的電子傳遞,更好地保持TCA 循環效率,其中以高成熟度果實處理效果更顯著。

圖13 1-MCP 處理對兩種不同成熟度果實琥珀酸脫氫酶活性變化的影響Fig.13 Effect of 1-MCP treatment on SDH activity change of peach fruits harvested at two maturity
CCO 處于電子傳遞鏈末端,具有質子泵的作用,與ATP 合成具有密切聯系,較高的CCO 活性有利于ATP 生成[30]。圖14 顯示,兩種成熟度桃果實CCO活性在前期快速下降,并在后續貯藏過程中相對穩定。值得注意的是,1-MCP 處理過后的CCO 活性多高于對照,且1-MCP 對于高成熟度桃果實CCO 活性的保持具有更明顯的效果,尤其是在貯藏后期,果實CCO 活性增強,有利于TCA 循環ATP 的生成。

圖14 1-MCP 處理對兩種不同成熟度果實細胞色素氧化酶活性變化的影響Fig.14 Effect of 1-MCP treatment on CCO activity change of peach fruits harvested at two maturity
TCA 循環是高等植物呼吸過程中的主要階段,也是植物能量獲取的重要來源。SDH 將琥珀酸催化成延胡索酸,釋放H+的同時生成ATP,而CCO 能夠通過電子傳遞,為氧化磷酸化提供能量。SDH 和CCO 活性直接影響呼吸鏈和TCA 循環的順利進行,在貯藏后期,低成熟度1-MCP 處理桃果實SDH 活性下降得到延緩,CCO 活性上升,細胞防御能力增強,能量生成和呼吸鏈效率得到提高,與本實驗研究貯藏后期呼吸速率出現高峰相符。表明1-MCP 處理可以促進呼吸高峰產生,對于細胞電子傳遞和能量代謝的正常進行具有重要推動作用[31]。
3 討論與結論
1-MCP 是一種競爭性乙烯結合受體,其能夠抑制乙烯與其受體的正常結合,達到阻斷乙烯信號傳導的效果,而采后果實的成熟衰老,與其自身釋放的內源乙烯作用密切相關[32]。乙烯信號的正常傳遞與否,決定果實硬度、色澤、香氣等表觀特性;細胞呼吸鏈效率和氧化酶系活性以及營養成分的積累,從而影響果實的貯藏時間和生理品質[33]。
由于果實的成熟衰老,桃果實組織細胞膜脂受到氧化,磷脂雙分子層通透性提高,果膠酶活性上升,胞間原果膠被逐步水解為可溶性果膠,導致細胞粘合程度降低,整體結構松散,果實硬度急劇下降,大量研究顯示[34?35],經1-MCP 處理后較高成熟度桃果實在硬度、PG 活性等方面具有更顯著的保鮮效果。同時,細胞膜受到氧化破壞導致細胞外液中電解質含量提高,果實原本正常代謝平衡受到打破,致使EL 和MDA 含量在果實貯藏后期提高,呈現一致快速上升趨勢。本實驗結果表明,1-MCP 對于細胞膜結構具有一定的維持作用,可以明顯降低兩種成熟度桃果實貯藏后期EL 水平以及低成熟度MDA 含量,與Wang 等[36]研究結果一致。除此之外,果實自身氧化程度的加深不僅會對細胞膜結構產生改變,還會影響抗壞血酸、谷胱甘肽等營養物質從還原態向氧化態發生轉變,而營養物質形態的轉變,一般要早于細胞膜結構的氧化,往往在果實成熟初期就開始發生。在本研究中發現,使用1-MCP 處理能夠顯著延緩兩種成熟度果實還原型營養物質在貯藏前中期的快速降低,延緩細胞膜脂的氧化,降低果實自身代謝有害物質的積累,為不同成熟度水蜜桃果實貯藏期間營養成分的保持提供理論依據,從營養價值角度維持了果實的商品性,并證明1-MCP 對桃果實貯藏保鮮有積極調控效果。
10 μL/L 1-MCP 對兩種成熟度‘霞暉8 號’桃果實品質和生理生化特性變化影響的結果顯示:1-MCP 處理桃果實作用大小與成熟度有關,以低成熟度果實作用更為明顯;1-MCP 對桃果實品質和生理生化特性變化的影響指標間存在差異,以硬度和原果膠含量影響顯著。1-MCP 處理延緩桃果實成熟主要表現在降低了果實MDA 含量、減少了電導率增加、抑制了乙烯釋放和呼吸作用、維持了果實硬度和原果膠含量、降低了多聚半乳糖醛酸酶活性、抑制了氧化酶系SOD 和POD 活性、保持了較高的還原型ASA 和GSH 含量、延緩了呼吸鏈中SDH 和CCO活性的降低等方面;整體上看,1-MCP 處理‘霞暉8 號’桃果實以較低成熟度效果更好。以上的研究結果對1-MCP 應用于桃果實的保鮮具有參考作用。

