小麥肽的抗氧化與抗疲勞作用的研究
王倩倩,杜 鵑,陳 鳴,馮鳳琴,*
(1.浙江大學生物系統工程與食品科學學院,浙江杭州 310012;2.杭州康源食品科技有限公司,浙江杭州 310012)
近年來,隨著生活節奏的加快和社會壓力的增大,大部分人都處于亞健康的狀態,因此越來越多人開始通過各種運動方式來提升自己的身體機能。在正常情況下,合理的體育鍛煉有助于身體更好的發揮功能。但由于自身條件的不同以及運動量的不合理,人們經常會因為過度的運動導致身體的不適,引起身體的疲勞,從而影響工作效率,甚至造成各種運動性損傷,危及損害身體健康[1]。關于運動性疲勞的機制有幾種學說,包括耗竭學說、阻塞學說、自由基學說、內環境失調學說、保護性抑制學說和突變學說[2]。其中自由基學說認為機體在高強度或長時間運動時會產生過量的自由基,如羥基自由基和超氧陰離子自由基,過多的自由基會破壞體內氧化和抗氧化平衡,引起肝臟和骨骼肌線粒體的脂質過氧化損傷,最終導致疲勞[3]。因此保護機體不受氧化傷害是預防疲勞的有效方法[4?5]。外源性抗氧化物質能與內源性自由基相互作用,減少機體氧化損傷、增強機體抗氧化防御能力、減少疲勞產生。近年來,營養干預特別是多肽類營養保健品受到越來越多研究者的關注,大量研究表明多肽在緩解疲勞方面是安全有效的[6?8]。與蛋白質相比,多肽類補充劑能夠被機體更快更好地吸收,且能夠加快氨基酸、蛋白質和葡萄糖的利用速率[9]。
小麥肽是小麥蛋白經過酶解得到的結構片段,其氨基酸含量均衡,具有多種功能活性,如抗氧化[10?11]、解酒[12]、免疫調節[13?14]、降血糖[15]、保護腸粘膜[16]、促進胃粘膜修復[17]等。研究表明酶解產物的氨基酸組成可能與其生物活性有關[18]。小麥肽氨基酸組成中谷氨酸的含量最高,而谷氨酸中谷氨酰胺含量豐富[19]。谷氨酸對神經系統具有積極的作用并且在運動過程中是有用的[20],谷氨酰胺是谷胱甘肽合成的重要底物,在機體的抗氧化體系中具有重要作用。運動性疲勞的產生和氧化應激之間存在著很大的關系,已經成為抗疲勞領域研究的熱點。但目前關于小麥肽的功能活性研究主要集中在小麥肽的體外抗氧化方面,而對體內抗疲勞的研究較少。另外小麥肽作為一種新的食品原料來源尚未得到廣泛應用。因此,本實驗以小麥肽為研究對象,利用H2O2誘導小鼠成纖維細胞L929 氧化損傷,從細胞水平評價小麥肽的體外抗氧化活性,然后通過給予小鼠灌胃小麥肽30 d,測定小鼠力竭游泳時間和與疲勞相關的生化指標,探討小麥肽的抗疲勞作用,并探求體內抗氧化活性和抗疲勞作用之間的相關性,從氧化應激的角度來解釋小麥肽的抗疲勞機制,以期為小麥肽作為功能性食品基料提供數據支持。
1 材料與方法
1.1 材料與儀器
小鼠成纖維細胞L929 購買于中科院上海細胞庫,L929 細胞用RPMI1640 培養基,含10%胎牛血清和1%雙抗,在37 ℃、5% CO2的條件下培養,當細胞融合至80%以上后,進行傳代;SPF 級ICR雄性小鼠 64 只,體重約(20±2)g,實驗動物許可證編號為SYXK(浙)2018-0012,由浙江中醫藥大學實驗動物中心提供和飼養,自由進食標準顆粒飼料及飲水,保持環境溫度(25±2)℃,光照周期12 h:12 h 條件下適應性飼養一周后使用;乳清蛋白粉 購于市場;胎牛血清 浙江天杭生物科技股份有限公司;RPMI-1640 培養基、雙抗(青霉素、鏈霉素)、0.25%胰酶上海源培生物科技股份有限公司;乳酸(LA)、尿素氮(BUN)、肌糖原(MG)、超氧化物歧化酶(SOD)、谷胱甘肽過氧化物酶(GSH-Px)、丙二醛(MDA)和乳酸脫氫酶(LDH)試劑盒 南京建成生物工程研究所;其余化學試劑 均為國產分析純。
HH-6 數顯恒溫水浴鍋 常州澳華儀器有限公司;PB-10 pH 計、BSA224S 電子分析天平 賽多利斯科學儀器有限公司;752 型紫外-可見分光光度計上海光譜儀器有限公司;Ultimate 3000 高效液相色譜儀 美國賽默飛世爾科技有限公司;HC-3018R 高速冷凍離心機 安徽中佳科學儀器有限公司;Infinite M200 Pro 酶標儀 瑞士帝肯集團公司;MCO-170AICUVDL-PC CO2細胞培養箱 日本松下電器產業株式會社;DM500 光學顯微鏡 徠卡顯微系統貿易有限公司。
1.2 實驗方法
1.2.1 小麥肽的制備 參考趙源等的制備方法[21],并做略微的改變。稱取一定量的谷朊粉,調節料液的pH 至8.0,添加0.4%蛋白酶,于50 ℃下酶解1.5 h后置于沸水浴中滅酶30 min,經濃縮、噴霧干燥制得小麥肽,置于?20 ℃儲存備用。
1.2.2 小麥肽特性的測定
1.2.2.1 氨基酸組成 采用異硫氰酸苯酯柱前衍生化反相高效液相色譜法[22]測定小麥肽的氨基酸組成。樣品溶解于6 mol/L HCl,然后于110 ℃水解24 h 后冷卻,取6 μL 水解液置于離心管中,氮氣吹干后加入10 μL 再干燥液,吹干后加入20 μL 衍生溶液混勻,室溫靜置20 min 后再次氮氣吹干,加入50 μL 流動相B,混勻后加入450 μL 流動相A,過膜上機。色譜條件:色譜柱為Welch AQ-C18(4.6 mm×250 mm,5 μm);流動相A 為0.1 mol/L 乙酸鈉溶液(含3%乙腈和0.1%三乙胺),流動相B 為80%乙腈;流速1.0 mL/min;柱溫38 ℃;進樣量20 μL;檢測波長254 nm。
1.2.2.2 相對分子質量分布 采用凝膠過濾色譜測定小麥肽的相對分子質量分布[23]。色譜條件:色譜柱為TSKgel G2000SWXL(300 mm×7.8 mm,5 μm);流動相為乙腈-超純水-三氟乙酸(體積比45:55:0.1);流速0.5 mL/min;柱溫30 ℃;進樣量20 μL;檢測波長220 nm。
1.2.3 體外抗氧化活性的測定
1.2.3.1 細胞損傷模型的建立 選擇對數生長期的L929 細胞,稀釋細胞個數為5×104個/mL,接種于96 孔板中,每孔接種100 μL,置于37 ℃、5% CO2培養箱中培養。24 h 后,棄去舊培養基,然后進行分組:空白組不加細胞,只加培養基;對照組加入不含H2O2的培養基,實驗組加入不同濃度的H2O2(40、80、120、160、200、250、300、350 μmol/L)。24 h后,用CCK-8 法檢測細胞存活情況,通過公式(1)計算細胞存活率。

1.2.3.2 小麥肽對L929 細胞生長的影響 選擇對數生長期的L929 細胞,稀釋細胞個數為5×104個/mL,接種于96 孔板中,每孔接種100 μL,置于37 ℃、5% CO2培養箱中培養24 h。24 h 后,棄去舊培養基,然后進行分組:空白組不加細胞,只加培養基;對照組加入不含樣品的培養基,實驗組加入不同濃度的小麥肽(0.2、0.4、0.8、1.6 mg/mL)。24 h 后,用CCK-8 法檢測細胞存活情況,通過公式(1)計算細胞存活率。
1.2.3.3 小麥肽對H2O2誘導L929 細胞損傷的保護作用 選擇對數生長期的L929 細胞,稀釋細胞個數為5×104個/mL,接種于96 孔板中,每孔接種100 μL,置于37 ℃、5% CO2培養箱中培養。24 h 后,棄去舊培養基,然后進行分組:實驗組加入不同濃度的小麥肽(0.2、0.4、0.6、0.8 mg/mL);正常對照組和H2O2損傷組加入不含樣品的培養基。培養 24 h 后棄去舊培養基,H2O2損傷組和樣品組加入300 μmol/L的H2O2,正常組加入不含H2O2的完全培養基,作用24 h 后,用CCK-8 法檢測細胞存活情況,通過公式(1)計算細胞存活率[24]。
1.2.3.4 抗氧化指標測定 選擇對數生長期的L929細胞,稀釋細胞個數為5×104個/mL,接種于6 孔板中,每孔接種2 mL。培養24 h 后進行分組:正常對照組、H2O2模型組、不同濃度小麥肽組(0.4、0.6、0.8 mg/mL)。細胞經過不同樣品和H2O2處理后,收集細胞和培養液進行各指標的測定。分別用試劑盒提供的方法測定上清液中LDH 活力,細胞內SOD活力、GSH-Px 活力和MDA 含量。
1.2.4 抗疲勞實驗
1.2.4.1 動物分組及給藥 雄性ICR 小鼠64 只,體重約(20±2)g,按照體重隨機分為4 組,分別為對照組(蒸餾水,同等劑量)、陽性組(乳清蛋白,2 mg/g/d)、小麥肽低劑量組(2 mg/g/d)、小麥肽高劑量組(8 mg/g/d),每組16 只,根據小鼠重量給予不同劑量的受試物,灌胃量按0.1 mL/10 g,每日1 次,連續30 d,灌胃期間自由取食和飲水。灌胃30 d 后,將每組的16 只小鼠隨機分為2 個亞組(每個亞組8 只小鼠),即A 組和B 組,A 組小鼠用于力竭游泳實驗,B 組小鼠用于自由泳實驗測定抗疲勞相關生化指標。具體的動物實驗設計如表1 所示。
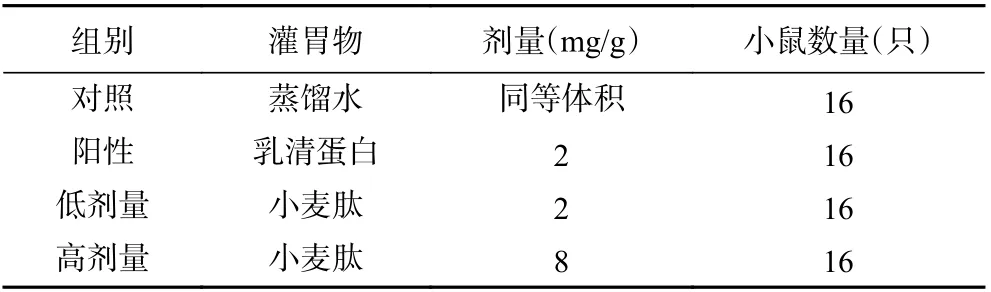
表1 動物實驗設計Table 1 Experimental design of animals
1.2.4.2 力竭游泳實驗 末次灌胃30 min 后,將每組中的A 組小鼠用肥皂水洗去其體表油脂,然后在小鼠尾根部負荷5%體重的鉛絲,放入水溫25 ℃、水深約30 cm 的游泳箱中游泳。游泳期間若有躬腰停止、懸浮休息者,用玻璃棒攪動附近水流迫使其不停運動。用秒表記錄自游泳開始至小鼠頭部全部沉入水中7 s 不能浮出水面的時間,該時間作為小鼠的力竭游泳時間。
1.2.4.3 疲勞相關生化指標測定 末次灌胃30 min后,將每個實驗組中的B 組小鼠眼球取血,靜置15 min后,離心取上清液,?80 ℃保存備用。然后將采血后的小鼠立即處死,取出肝臟和后腿肌肉,按照1:9 的比例加入相應體積的生理鹽水,磨勻漿后得到10%的組織勻漿液,?80 ℃保存備用。分別用試劑盒提供的方法測定小鼠血清中LA 和BUN 含量、肌肉中MG 含量、肝臟中MDA 含量、SOD 和GSHPx 活力。
1.3 數據處理
采用SPSS19.0 軟件進行統計學處理,采用單因素方差分析比較組間差異,結果以均值±標準差表示,數據圖表用GraphPad Prism 8.0 軟件制作。
2 結果與分析
2.1 小麥肽的氨基酸組成和相對分子質量分布
肽的生物活性與其氨基酸組成相關。由表2 可知,小麥肽含有18 種氨基酸,總量為76.66%,表明小麥肽含有豐富的氨基酸組成。其中谷氨酰胺和脯氨酸是最主要的氨基酸,含量分別為22.91%和9.92%。谷氨酰胺是一種重要的具有特殊營養作用的條件性必需氨基酸及腸道必需氨基酸,它在保護細胞膜的完整性、維持細胞活力及降低細胞氧化損傷方面具有積極的作用[25]。半胱氨酸含有可電離的硫醇基團,能夠清除自由基并結合金屬離子[26];組氨酸結構上含有咪唑環,可以與金屬離子和活性氧結合[27];甲硫氨酸含有硫醚基團,對特定氧化劑有反應[28];酪氨酸含有酚羥基,通過提供氫原子來清除活性氧[29]。因此,以上4 種氨基酸被普遍認為具有抗氧化活性[30]。另外,亮氨酸、異亮氨酸和纈氨酸這類支鏈氨基酸不僅可以明顯改善運動能力,延緩運動過程中肌肉蛋白質的分解代謝,而且還能減少運動后乳酸的積累,從而延緩血乳酸引起的疲勞。由表2 可知,小麥肽中具有抗氧化活性的半胱氨酸、組氨酸、甲硫氨酸和酪氨酸這4 種氨基酸含量為6.31%。同時,小麥肽中亮氨酸、異亮氨酸和纈氨酸這3 種支鏈氨基酸的含量較高為13.22%。因此,小麥肽富含抗氧化與抗疲勞活性的氨基酸,推測其可能具有一定的抗氧化與抗疲勞的潛能。除了氨基酸組成,肽的生物活性也取決于其相對分子質量的分布,分子量小于3000 Da 的肽被認為比分子量大于3000 Da 的肽具有更好的抗氧化活性,這種較好的活性可能是由于分子量小的肽段具有高活性、易吸收和低毒性[31]。由圖1 和表3 可知,小麥肽相對分子質量小于3000 Da 的部分占70.56%,推測其具有一定的抗氧化效果。
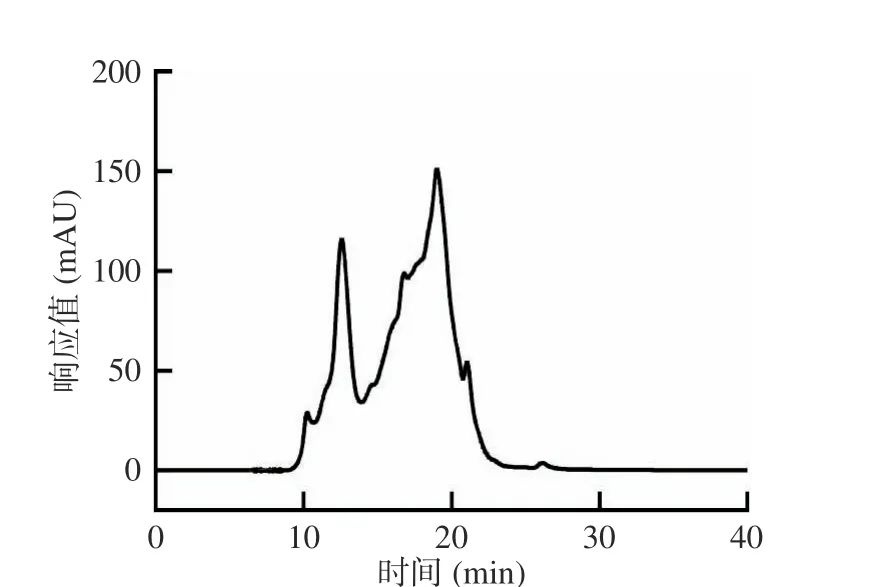
圖1 小麥肽的相對分子質量分布Fig.1 Relative molecular weight distribution of wheat peptides

表3 小麥肽的相對分子質量分布Table 3 Relative molecular weight distribution of wheat peptides
2.2 小麥肽的體外抗氧化性
2.2.1 小麥肽對H2O2誘導L929 細胞損傷的保護作用 通過H2O2處理小鼠成纖維細胞L929 制備氧化應激損傷模型,來探討小麥肽的體外抗氧化活性。如圖2A 所示,與對照組相比,當H2O2濃度為300 μmol/L 作用24 h 時,細胞存活率為52.39%,因此選擇該濃度的H2O2進行下一步實驗。如圖2B所示,與對照組相比,濃度在0.2~0.8 mg/mL 范圍內的小麥肽對L929 細胞均具有增殖作用,濃度為0.4 mg/mL 時對細胞的增殖作用最強,且差異極顯著(P<0.01)。當濃度大于0.8 mg/mL 時,小麥肽對L929 細胞的增殖有一定的抑制作用。因此選擇濃度為0.2~0.8 mg/mL 的小麥肽進行下一步實驗。小麥肽對L929 細胞氧化損傷的保護作用結果如圖2C 所示。與模型組相比,在H2O2損傷前24 h 加入0.2~0.8 mg/mL 的小麥肽均能提高L929 細胞的存活率,且隨著濃度的升高,細胞存活率隨之增加。當小麥肽濃度為0.6 mg/mL 時,對L929 細胞的保護作用最顯著(P<0.01),此時細胞存活率比模型組提高了45.62%。綜合兩組實驗結果,小麥肽濃度為0.4~0.8 mg/mL 時對H2O2誘導L929 細胞氧化損傷的保護作用較顯著(P<0.01)。
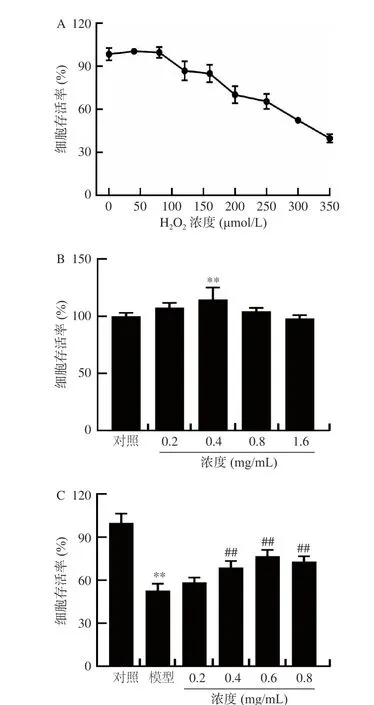
圖2 小麥肽對L929 細胞氧化損傷的保護作用Fig.2 Protective effect of wheat peptides against H2O2 induced oxidative damage in L929 cells
2.2.2 小麥肽對H2O2誘導L929 細胞損傷的抗氧化水平的影響 正常細胞經由H2O2處理后,細胞膜被破壞從而導致細胞內的LDH 釋放。因此,上清液LDH 活力的高低可反映出細胞的損傷程度。由圖3A可知,L929 細胞經H2O2損傷后細胞培養液中LDH 活力極顯著升高了53.10%(P<0.01),說明模型建立成功。與模型組相比,小麥肽濃度為0.4、0.6和0.8 mg/mL 時LDH 的活力分別減少了7.20%、20.79%和19.67%,且濃度在0.6 和0.8 mg/mL 時差異達到顯著(P<0.05)。SOD 和GSH-Px 是機體內主要的抗氧化酶,SOD 催化活性氧分解生成H2O2和O2,GSH-Px 催化H2O2分解生成H2O 和O2,它們能直接反應機體的抗氧化水平。而MDA 是自由基引起脂質過氧化的主要產物之一,可間接顯示機體清除氧化產物能力和抗氧化活性[32]。由圖3B 和圖3C可知,與模型組相比,小麥肽濃度為0.4、0.6 和0.8 mg/mL 時SOD 活力提高了23.55%、83.21%和95.91%,且在濃度為0.6 和0.8 mg/mL 時差異達到顯著(P<0.05)和極顯著(P<0.01);同時GSH-Px 活力提高了11.38%、28.69%和32.14%,但差異均不顯著(P>0.05)。由圖3D 可知,3 個濃度的小麥肽使得細胞內的MDA 含量降低了10.52%、25.91%和26.99%,且在濃度為0.6 和0.8 mg/mL 時差異達到顯著(P<0.05)。體外抗氧化實驗表明,小麥肽可以通過提高細胞內SOD 和GSH-Px 活力,降低LDH 活力和MDA 含量,在機體中發揮抗氧化作用。這與張羽等發現的麥胚清蛋白肽可抑制由H2O2誘導的肝細胞損傷的氧化應激狀態來發揮抗氧化作用的研究結果相一致[33]。
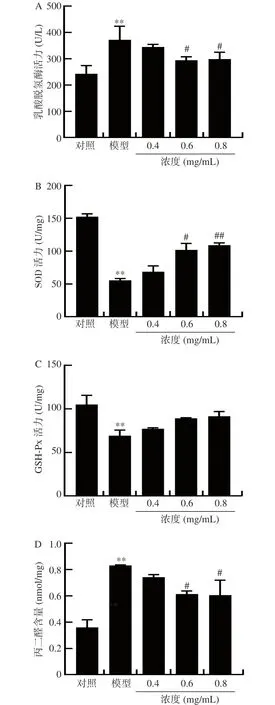
圖3 小麥肽對L929 細胞氧化損傷LDH、SOD、GSH-Px 和MDA 水平的影響Fig.3 Effects of wheat peptides against H2O2 induced oxidative damage in L929 cells on the SOD, GSH-Px, MDA and LDH
2.3 抗疲勞
2.3.1 體重變化 由表4 可知,在實驗期間,各樣品組與對照組小鼠的體重均有所增加,但體重變化無顯著性差異。灌胃期間,小鼠無不良反應,體質量增加正常,精神狀態良好,未發現異常或者死亡現象,表明灌胃小麥肽并不會影響小鼠的正常生長,對小鼠無毒副作用。
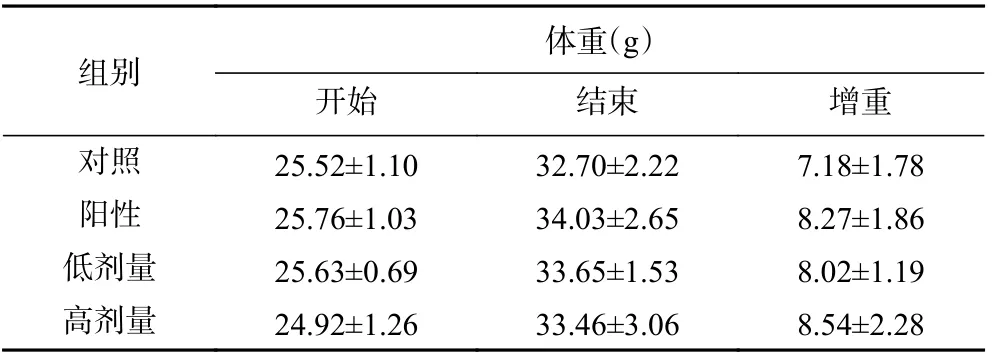
表4 小麥肽對小鼠體重的影響Table 4 Effect of wheat peptides on body weight in mice
2.3.2 小麥肽對小鼠力竭游泳時間和抗疲勞指標的影響 力竭游泳時間是評價抗疲勞能力的一種實驗模型,它能夠很好地評價小鼠的疲勞耐受能力,再現性較高[34]。由圖4A 可知,小麥肽低劑量組、高劑量組和乳清蛋白組小鼠的力竭游泳時間較對照組均有極顯著差異(P<0.01),分別延長了72.93%、91.73%和64.66%。Zheng 等[14]人的研究結果同樣也證明了補充小麥肽可以有效提高小鼠運動耐力。另外,隨著小麥肽劑量的增加,其力竭游泳時間也隨著延長,表明在一定范圍內,小鼠力竭游泳時間呈劑量依賴性。
長時間的劇烈運動會增加肌肉的氧氣消耗,導致機體相對缺氧,此時肌肉中的糖原會被分解產生乳酸,為機體提供能量。但大量的乳酸的產生則會影響機體內環境的酸堿平衡,引起肌肉酸痛,導致肌肉運動能力的下降。同時為了滿足能量需求,蛋白質的代謝顯著增加,使肝臟中的尿素水平明顯增加,過量的尿素會在體內積累并對機體造成危害。BUN 的含量在一定程度上可以反映機體的疲勞程度[35?36]。糖原是體內儲存能量的主要形式之一,能夠與糖在機體內進行轉化作用,肌糖原通過無氧酵解的途徑直接將能量供給肌肉組織[37]。由圖4B 和4C 可知,與對照組相比,小麥肽低劑量和高劑量組均使得小鼠肝臟中的LA 含量極顯著降低了24.65%(P<0.01)、25.16%(P<0.01),同時BUN 含量較對照組也極顯著和顯著降低了19.74%(P<0.01)、17.78%(P<0.05)。由圖4D可知,小麥肽低劑量和高劑量組MG 含量比對照組極顯著提高了48.63%(P<0.01)、56.85%(P<0.01)。相似地,Liu 等的研究通過證明核桃小分子肽降低LA 和BUN 含量,并提高MG 含量,從而緩解機體的疲勞狀態[8]。綜合以上結果表明,小麥肽能夠通過增強小鼠的耐力,減少代謝產物的堆積和體內蛋白質和氨基酸的分解代謝,減少運動引起的肌糖原消耗來發揮抗疲勞作用。
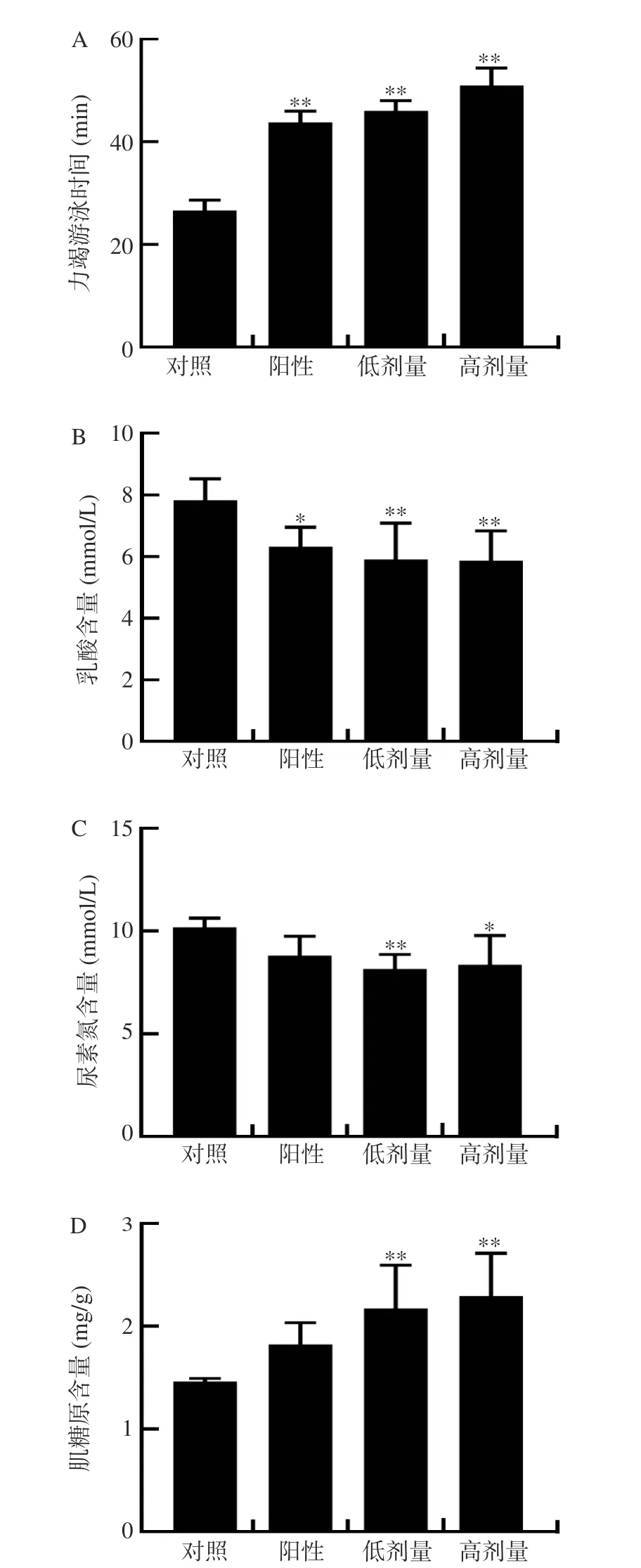
圖4 小麥肽對小鼠力竭游泳時間、乳酸、尿素氮和肌糖原水平的影響Fig.4 Effect of wheat peptides on the exhaustive swimming time, LA, BUN and MG
2.3.3 小麥肽對小鼠肝臟抗氧化水平的影響 以往的研究表明,劇烈運動過程中消耗大量的能量,會使氧化系統和抗氧化系統失去平衡,產生過多的活性氧,如羥基自由基和超氧陰離子自由基,這些自由基極易引起骨骼肌與肝臟線粒體的脂質過氧化損傷,從而削弱抗氧化能力。在劇烈運動中,人體對氧氣的需求會增加,骨骼肌的血流量也會改變。這些變化導致自由基的產生和肌肉穩態的紊亂,導致骨骼肌的氧化損傷,隨后的炎癥反應和細胞因子的產生,進一步導致肌肉疲勞[38]。因此,清除活性氧可能是緩解肌肉疲勞的主要機制之一。由圖5A 和5B 可知,與對照組相比,小麥肽低劑量和高劑量組均使得小鼠肝臟中的SOD 活力極顯著提高了20.54%(P<0.01)、25.19%(P<0.01),同時GSH-Px 活力較對照組也極顯著提高了29.79%(P<0.01)、35.77%(P<0.01);由圖5C 可知,與對照組相比,小麥肽低劑量和高劑量組均使得小鼠肝臟中的MDA 含量極顯著降低了23.08%(P<0.01)、21.46%(P<0.01)。與本文的研究結果相似,Li 等[39]發現,當給與小鼠灌胃人參小分子肽后,疲勞小鼠體內的氧化應激狀態得到抑制,從而緩解了機體的疲勞狀態。結果表明,小麥肽能夠提高小鼠體內抗氧化酶的活力,清除因運動而產生的自由基,緩解疲勞,具有較強的體內抗氧化能力。
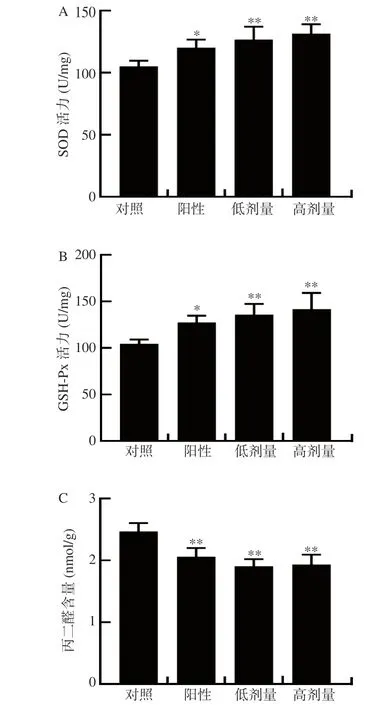
圖5 小麥肽對小鼠SOD、GSH-Px 和MDA 水平的影響Fig.5 Effect of wheat peptides on the SOD, GSH-Px and MDA
2.3.4 體內抗氧化和抗疲勞的相關性分析 本文將體內抗氧化指標和抗疲勞指標進行Pearson 相關性分析[40],得到結果如表5 所示。從表中可以看到,各個處理組的SOD 活力與小鼠力竭游泳時間、MG 含量呈顯著正相關(P<0.05);GSH-Px 活力與小鼠力竭游泳時間、MG 含量分別呈極顯著(P<0.01)和顯著正相關(P<0.05);SOD、GSH-Px 活力與LA 含量、BUN 含量呈顯著負相關(P<0.05);MDA含量與小鼠力竭游泳時間呈顯著負相關(P<0.05),與LA 含量、BUN 含量呈極顯著正相關(P<0.01)。結果表明,小麥肽的抗疲勞活性與其抗氧化活性高度相關。

表5 體內抗氧化活性與緩解疲勞作用的Pearson 相關系數Table 5 Pearson correlation analysis between antioxidant activity and anti-fatigue activities in vivo
3 結論
本研究通過H2O2處理小鼠成纖維細胞L929制備氧化應激損傷模型,從細胞水平評價小麥肽的體外抗氧化活性,然后通過給予小鼠灌胃小麥肽30 d,測定小鼠力竭游泳時間和與疲勞相關的生化指標,探討小麥肽的抗疲勞作用,并探求體內抗氧化活性和抗疲勞作用之間的相關性。體外抗氧化結果表明,H2O2損傷導致L929 細胞存活率降低,細胞上清液中LDH 漏出量增多,且能夠造成細胞內抗氧化酶SOD 和GSH-Px 活性降低及細胞脂質過氧化產物MDA 增加。但當提前加入小麥肽對樣品進行預保護后,可通過提高細胞內SOD 和GSH-Px 活性、減少MDA 含量,發揮其抗氧化作用。體內抗疲勞結果表明小麥肽通過延長小鼠力竭游泳時間,降低運動后LA 及BUN 的水平,增加MG 的含量,提高內源性抗氧化酶體系的活力,減緩疲勞的發生。通過體內抗氧化和抗疲勞相關性分析可知,抗氧化活性與抗疲勞能力高度正相關,因此后續可進行與氧化應激相關的信號通路進行驗證。

