膠原蛋白的提取、性質(zhì)及其應(yīng)用的研究進(jìn)展
◎ 梁健華
(陽江市檢測檢驗中心,廣東 陽江 529500)
膠原蛋白是哺乳動物組織中細(xì)胞外基質(zhì)的關(guān)鍵蛋白質(zhì)之一,約占全身蛋白質(zhì)的25%~35%,主要存在于纖維組織中,如筋腱、韌帶、軟骨和皮膚等。膠原蛋白由成纖維細(xì)胞合成,分子量約為300 kDa,具有三股螺旋結(jié)構(gòu)。目前已知的膠原蛋白有29種,其中I型膠原蛋白的含量最高,約占人體內(nèi)膠原蛋白的90%以上,廣泛存在于皮膚、骨骼和肌腱中。
目前,從動物組織中提取是膠原蛋白的主要來源之一,如來源于豬、牛、羊、鼠等陸生動物的皮、筋腱和骨骼等。此外,水產(chǎn)加工中的下腳料如魚皮、魚翅、魚鱗和魚骨等也是膠原蛋白的重要來源之一。然而,不同來源的膠原蛋白,其制備工藝和結(jié)構(gòu)性質(zhì)存在差異。本文基于膠原蛋白的提取制備工藝、對膠原蛋白性質(zhì)的影響因素及膠原蛋白的應(yīng)用進(jìn)行了總結(jié)介紹。
1 膠原蛋白的提取制備
動物組織中膠原纖維的分布、纖維間結(jié)合的緊密程度、組織中的其他成分(如黏多糖、礦物質(zhì))與膠原纖維的交聯(lián)程度等的差異,均影響著組織中膠原蛋白提取的難易程度、提取率、純度和膠原蛋白結(jié)構(gòu)的完整性。綜合目前的研究報道,從動物組織中提取膠原蛋白通常包括原材料的除雜處理和膠原蛋白的提取純化這兩個步驟。
1.1 原材料的除雜處理
為使膠原蛋白能滿足不同領(lǐng)域的要求,在膠原蛋白提取前需對原料進(jìn)行除雜處理。原材料的雜質(zhì)通常是雜蛋白、黏多糖、脂肪和礦物質(zhì)等。雜蛋白的混入會增加膠原蛋白基產(chǎn)品的免疫原性的風(fēng)險,一般可使用稀堿溶液除去這些雜蛋白。LIU等[1]研究了在4 ℃、10 ℃、15 ℃和20 ℃下,不同濃度(0.05 mol·L-1、0.10 mol·L-1、0.20 mol·L-1和 0.50 mol·L-1)的 NaOH 溶液對草魚魚皮中雜蛋白的除去效率和效果的影響,結(jié)果發(fā)現(xiàn),NaOH的濃度對雜蛋白的除去效率沒有顯著影響,而當(dāng) NaOH 的濃度 為 0.20 mol·L-1和 0.50 mol·L-1時,膠原蛋白的的共價鍵部分被破壞,導(dǎo)致膠原蛋白的損失。梁健華等[2]研究了超聲波輔助0.01 mol·L-1的NaOH溶液去除羅非魚皮中的雜蛋白的條件,超聲處理60 min,魚皮中雜蛋白的溶出量約為37.37 mg·g-1,膠原蛋白的遷出量為0.63 mg·g-1,且超聲處理能使魚皮中的膠原纖維充分伸展,利于后續(xù)膠原蛋白的提取。為了獲得無色無味的膠原液,組織中的色素一般采用H2O2溶液或者0.1 mol·L-1的NaOH溶液除去。此外,原材料中的脂肪極易氧化產(chǎn)生臭味,且脂肪的存在會阻礙膠原蛋白的溶出,使膠原蛋白溶液變渾濁,因此在提取前需去除組織中的脂肪,通常使用有機(jī)溶劑,如乙醇。
1.2 膠原蛋白的提取純化
膠原蛋白分子中的三螺旋結(jié)構(gòu)在縱向和雙側(cè)排列成具有周期性的纖維結(jié)構(gòu),4~8個膠原分子通過共價鍵連接形成膠原微纖維,而后逐漸形成直徑為10~500 nm的膠原纖維,纖維結(jié)構(gòu)的致密性使膠原蛋白難溶于溶液中。近年來,使用中性鹽、堿法、酸法和酶法提取分離不同來源和組織中不同類型的膠原蛋白已有很多報道,如表1所示。酸酶結(jié)合提取法通常是首選的方法,稀酸溶液能有效作用于膠原蛋白分子間的氫鍵,使膠原纖維膨脹展開,利于后續(xù)膠原蛋白的提取;但酸溶液不能切斷膠原分子端肽間的共價鍵,使得膠原蛋白不能有效溶出。基于酶解的方法可將膠原分子端肽間的共價鍵切除,促進(jìn)膠原蛋白的溶出,常用的酶有胃蛋白酶、糜蛋白酶、胰蛋白酶和木瓜蛋白酶等,使用這些酶的原因有如下幾點:①酶能水解組織中的非膠原蛋白,以便于后續(xù)的鹽純化和透析除去這部分雜蛋白,提高膠原蛋白的純度。②在膠原蛋白分子沒有展開、融化或破壞時,這些酶主要切割膠原蛋白的N-端和C-端,極大地提高了膠原蛋白的提取效率。③經(jīng)酶提取后的膠原蛋白,由于大部分端肽已被切除,極大地降低了其免疫原性,利于后續(xù)的應(yīng)用。
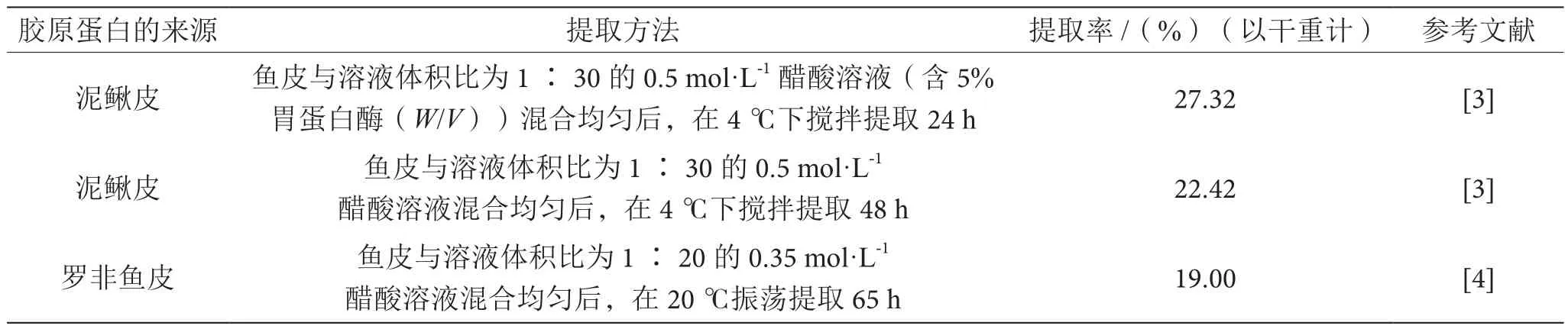
表1 膠原蛋白的提取方法及提取率表
此外,提取后的膠原蛋白需經(jīng)過純化處理,以盡可能的去除膠原液中的雜質(zhì),包括部分變性的膠原蛋白。可溶性膠原蛋白通常使用鹽或聚電解質(zhì)沉淀,經(jīng)后續(xù)的離心和透析可獲得純化的膠原蛋白。提取后的膠原蛋白溶液可冷凍干燥或者冷凍保存。
2 影響膠原蛋白性質(zhì)的因素
膠原蛋白的性質(zhì)決定了其應(yīng)用的領(lǐng)域。在食品領(lǐng)域上,膠原蛋白最重要的特性是凝膠強(qiáng)度、粘彈性、凝膠化作用和熔融點。而在生物醫(yī)學(xué)應(yīng)用上,膠原蛋白最重要的特性是成纖維的能力、熱穩(wěn)定性和降解性能等。影響膠原蛋白性質(zhì)的因素有很多,例如分子量、羥脯氨酸(Hyp)的含量、共價交聯(lián)的程度等。其中,膠原蛋白的來源和種類決定了其內(nèi)在的化學(xué)和物理性質(zhì),此外,膠原蛋白的制備工藝也是影響其性質(zhì)的主要原因。
2.1 膠原蛋白的來源對其性質(zhì)的影響
不同來源的膠原蛋白在各應(yīng)用領(lǐng)域上都依賴于其熱穩(wěn)定性。膠原蛋白的熱穩(wěn)定性主要與分子內(nèi)的脯氨酸(Pro)和Hyp形成的吡咯烷環(huán)、Hyp的羥基形成的氫鍵有關(guān)[5]。由于交聯(lián)密度的增大,較高含量的Hyp和Pro可提高膠原蛋白的熱穩(wěn)定性。表2列舉了幾種不同來源膠原蛋白氨基酸含量及其熱變性溫度。一般而言,陸生哺乳動物來源的膠原蛋白的熱穩(wěn)定性較水產(chǎn)膠原蛋白的高,如來自羊骨、牛皮、豬皮和鼠尾肌腱的膠原蛋白的熱變性溫度均高于水產(chǎn)膠原蛋白(羅非魚皮膠原蛋白除外)。而動物的棲息溫度[6]也影響著膠原蛋白的熱穩(wěn)定性。
結(jié)合表2可知,熱水和溫水來源的魚的膠原蛋白的熱變性溫度較冷水和冰水來源的魚的膠原蛋白的高。如羅非魚皮膠原蛋白的熱變性溫度明顯高于深海紅鮭魚皮膠原蛋白。此外,由于氨基酸的組成也與動物組織的部位有關(guān),因此不同組織部位的膠原蛋白其熱穩(wěn)定性也存在微小的差異。對于鳙魚來說,來自內(nèi)部組織(魚鰾和骨頭)的膠原蛋白的Hyp和Pro含量高于來自外部組織(魚鰭、鱗片和魚皮)的膠原蛋白[7]。MUYONGA等[8]在對尼羅河鱸魚皮膠原蛋白的研究中發(fā)現(xiàn),處于成熟階段的魚的膠原蛋白其Hyp和Pro的含量與非成熟階段的魚無顯著性差異。
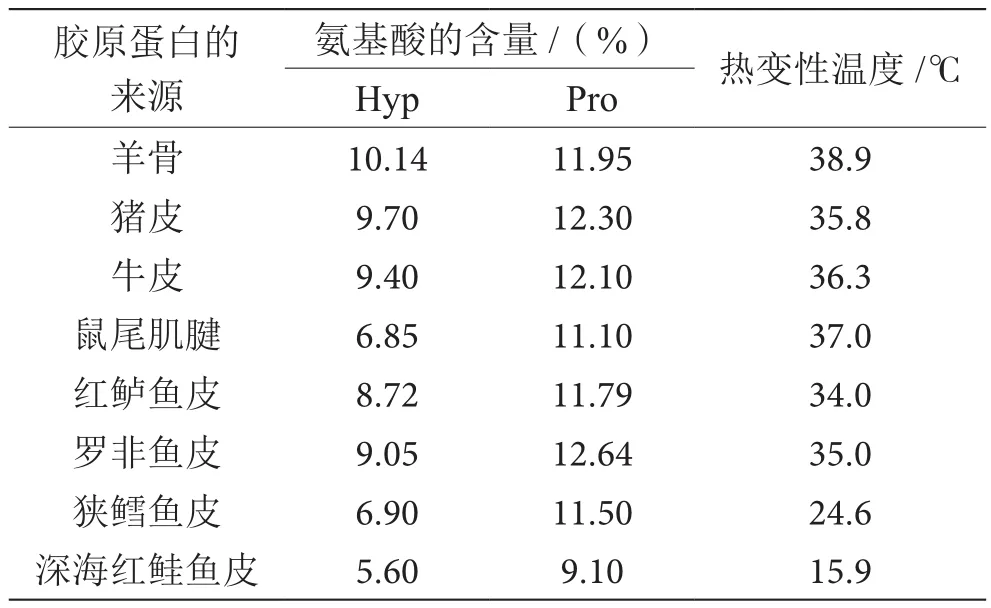
表2 不同來源膠原蛋白的Hyp、Pro含量和熱變性溫度表
2.2 膠原蛋白的制備工藝對其性質(zhì)的影響
膠原蛋白的性質(zhì)不僅與來源有關(guān),與其制備工藝也密切相關(guān),主要包括提取工藝和改性工藝兩方面。
2.2.1 提取工藝對膠原蛋白性質(zhì)的影響
膠原蛋白的提取步驟為:①長時間(>12 h)堿液浸泡除雜蛋白處理。②長時間(>24 h)酸或酸酶液攪拌提取。③鹽析、長時間透析純化處理。這使得膠原蛋白需長時間暴露于化學(xué)試劑(堿、酸、鹽等)中,而這些條件有可能會改變膠原蛋白的化學(xué)性質(zhì)。
LIN等[9]報道了隨著提取時間的延長,鳥爪膠原蛋白的成纖維能力逐漸減低,且長時間(24 h、48 h和72 h)提取的膠原蛋白的熱變性溫度明顯低于短時間(4 h、12 h和18 h)提取的膠原蛋白。ZEUGOLIS等[10]報道了經(jīng)醋酸提取的牛跟腱膠原蛋白的黏度顯著(P<0.002)高于胃蛋白酶提取的膠原蛋白,而胃蛋白提取的牛跟腱膠原蛋白在酸性pH下的溶解度約為酸溶液提取的10倍。YOSHIMURA等[11]發(fā)現(xiàn),堿溶液會破壞膠原蛋白分子端肽部分的共價鍵,減少膠原蛋白分子間的共價交聯(lián),從而降低其熱穩(wěn)定性。
由此可見,膠原蛋白的提取工藝條件(如溫度、pH、提取時間等)均會影響它的結(jié)構(gòu)性質(zhì),因此,為了使膠原蛋白保持其天然的結(jié)構(gòu)特性,提取溫度通常為低溫,且盡可能減少膠原蛋白暴露于化學(xué)試劑中的時間。
2.2.2 改性工藝對膠原蛋白性質(zhì)的影響
為了提高膠原蛋白的熱穩(wěn)定性、成纖維能力、力學(xué)性能和降解性能等,通常使用物理或化學(xué)方法對其進(jìn)行改性,以滿足實際生產(chǎn)應(yīng)用的需要。表3列舉了膠原蛋白的一些改性方法及改性后膠原蛋白的結(jié)構(gòu)性質(zhì)的差異。

表3 膠原蛋白部分改性方法表
KANTH等[12]使用雙醛纖維素對鼠尾肌腱膠原蛋白進(jìn)行改性,改性后膠原蛋白的交聯(lián)度達(dá)到94.06%,且收縮溫度由62.5 ℃提高到80.5 ℃,對膠原蛋白酶的耐受性提高了13.68倍。當(dāng)使用丙二酸對鼠尾肌腱膠原蛋白進(jìn)行改性時[13],膠原蛋白的機(jī)械性能有所提升,拉伸強(qiáng)度可達(dá)7.9 MPa,斷裂伸長率提高了11.8%。此外,由于膠原蛋白是一類聚合電解質(zhì),其等電點接近生理的pH,這使得膠原蛋白在中性pH的溶液的溶解度較小,限制了膠原蛋白在保健品、化妝品和注射用生物材料中的應(yīng)用。ZHANG等[14]研究了使用聚-N-羥基琥珀酰亞胺對膠原蛋白進(jìn)行改性,膠原蛋白的等電點由6.90降低到4.00,增大了其在中性pH溶液中的溶解度。
這些化學(xué)交聯(lián)的方法能明顯提高膠原蛋白的熱穩(wěn)定性和機(jī)械強(qiáng)度,但引入交聯(lián)的化學(xué)試劑可能導(dǎo)致潛在的毒副作用和不良的生物相容性,而物理交聯(lián)的方法則不會引入潛在的細(xì)胞毒性。
YUNOKI等[15]比較了真空熱交聯(lián)和紫外輻照交聯(lián)對大馬哈魚皮膠原蛋白改性的影響,結(jié)果發(fā)現(xiàn),真空熱交聯(lián)大馬哈魚皮膠原蛋白3 d(110 ℃),膠原蛋白熱變性溫度由19 ℃提高到87 ℃,且三螺旋結(jié)構(gòu)的破壞程度最小,但降低了其溶解性及對膠原酶的耐受性;使用15 J·cm-2的輻照劑量,膠原蛋白的熱變性溫度由19 ℃提高到102 ℃,溶解性和對膠原酶的耐受性也顯著降低。物理的方法雖然能提高膠原蛋白的熱穩(wěn)定性,但也會不同程度地破壞膠原蛋白的螺旋結(jié)構(gòu)。總體上,膠原蛋白的性質(zhì)由其結(jié)構(gòu)所決定,改性的方法雖然會不同程度的提高膠原蛋白的部分化學(xué)性質(zhì)(如機(jī)械強(qiáng)度、熱穩(wěn)定性等),但也會不可避免破壞膠原蛋白的三螺旋結(jié)構(gòu),降低膠原蛋白其他的功能性質(zhì)(如溶解性能、生物相容性等)。
3 膠原蛋白的應(yīng)用
3.1 膠原蛋白在食品保健品中的應(yīng)用
膠原蛋白中含有豐富的必需氨基酸和非必需氨基酸,可作為新型功能性食品中的營養(yǎng)成分,以提高不同食品產(chǎn)品的質(zhì)量。如由膠原蛋白原料制備的明膠,由于其具有優(yōu)越的凝膠化、成膜性和增稠性,通常作為提高膠體食品的凝膠及成膜的穩(wěn)定性和質(zhì)地的增強(qiáng)劑。果汁中添加適量的明膠可提高果汁的黏稠度,果凍中加入適量的明膠可增強(qiáng)果凍的膠體穩(wěn)定性,香腸中添加適量的明膠可提高香腸彈性。利用酶水解膠原蛋白得到的功能性肽也常用于保健食品中,這些功能性肽具有增加骨密度、降低血壓和抗氧化的作用。
在美國,膠原蛋白肽已廣泛用于保健食品領(lǐng)域中。WU等[16]報道了攝入膠原蛋白肽可減輕患者的膝關(guān)節(jié)疼痛癥狀;此外,口服膠原蛋白肽和鈣劑比單獨服用鈣劑對于緩解骨質(zhì)疏松的效果更好。SAIGA等[17]報道了膠原蛋白肽可降低原發(fā)性高血壓大鼠的血壓,且在8 h其血壓達(dá)到最低值。陳碩等[18]探討了豬骨頭膠原蛋白水解物對自發(fā)性高血壓大鼠血壓的影響,發(fā)現(xiàn)在30~70 mg·kg-1·d-1劑量范圍內(nèi),均具有明顯的長期穩(wěn)定的降血壓效果。此外,膠原蛋白還可作為天然抗氧化劑和變形劑,降低化學(xué)防腐劑的利用率,可以滿足消費者對安全和綠色食品的需求[19]。
3.2 膠原蛋白在生物醫(yī)藥中的應(yīng)用
目前膠原蛋白基的生物醫(yī)藥產(chǎn)品已有很多,例如外科植入物、止血劑、創(chuàng)面敷料、組織修復(fù)材料和口腔填充物等。膠原蛋白在生物醫(yī)藥中的應(yīng)用主要有3方面,分別為:①用作止血材料。②用作組織工程材料。③用于藥物釋放的媒介。膠原蛋白的三股螺旋結(jié)構(gòu)能誘導(dǎo)血小板的附著,激活凝血因子,起到良好的止血作用。此外,膠原蛋白還具有良好的滲水和吸水的能力,對止血有輔助作用。市面上膠原蛋白止血產(chǎn)品主要有膠原蛋白海綿和膠原微纖維粉末,可用于體內(nèi)如血管、器官、口腔等的止血,也可用于體外創(chuàng)面的止血。近年來膠原蛋白在組織工程中的應(yīng)用引起了學(xué)者的廣泛關(guān)注,如作為皮膚和骨骼的修復(fù)材料、支架材料、生物膜材料等。由于膠原蛋白具有良好的機(jī)械強(qiáng)度和生物相容性,重組的I型膠原蛋白可以直接替代受損的皮膚。例如,豬的全層皮膚切除傷口模型已用于研究膠原基植入物對肉芽組織的形成、傷口收縮和上皮化的影響。膠原蛋白在藥物釋放的臨床應(yīng)用形式有水凝膠、顆粒劑、海綿和薄膜等,用于低分子量化學(xué)物如抗生素和癌癥抑制劑等藥物的釋放。
3.3 膠原蛋白在化妝品中的應(yīng)用
皮膚中膠原蛋白的含量約占30%,膠原蛋白在皮膚中的含量和強(qiáng)度直接與皮膚的老化程度相關(guān)。隨著年齡的增長,皮膚中的膠原纖維逐漸受損,厚度變薄且強(qiáng)度下降。為了緩解這些問題,膠原蛋白被作為美容治療中的一種重要成分以促進(jìn)使用者皮膚恢復(fù)年輕和健康,在化妝品領(lǐng)域中的應(yīng)用劑型可以是霜類、營養(yǎng)補充劑和植入劑等。利用膠原蛋白含有較多的親水性氨基酸,如甘氨酸、羥脯胺酸、脯氨酸等,能與水分形成氫鍵,膠原蛋白常常制備成高保濕的凝膠霜,能夠提高皮膚的貯水能力,對皮膚進(jìn)行有效保濕。此外,膠原蛋白的修復(fù)作用常常被應(yīng)用于皮膚的抗衰老、抗皺、防紫外線輻照和傷口愈合中,膠原蛋白能于皮膚上形成薄膜,覆蓋于皮膚上,減少經(jīng)皮水分的流失,保護(hù)皮膚免受腐蝕性因素的侵害。
4 結(jié)語
據(jù)報道[20],截止至2017年底,全球膠原蛋白市場的規(guī)模約為37.1億美元,且在2018年持續(xù)增長,預(yù)計在2025年,達(dá)到66.3億美元的規(guī)模。這種增長歸因于膠原蛋白在食品保健品、化妝品和生物醫(yī)藥領(lǐng)域應(yīng)用中能滿足消費者的需要。在過去幾十年里,從各種原材料提取膠原蛋白已經(jīng)取得了重大的進(jìn)展,確定了膠原蛋白的溶劑、時間、溫度等加工條件以生產(chǎn)最佳產(chǎn)量和質(zhì)量(如維持其三螺旋結(jié)構(gòu))的膠原蛋白。但大規(guī)模短時間提取和生產(chǎn)膠原蛋白的最佳工藝和過程控制條件目前仍需繼續(xù)探討。
此外,膠原蛋白的改性,特別是熱穩(wěn)定性在目前也取得了較為重大的研究進(jìn)展。使用的化學(xué)方法或物理方法均能對膠原蛋白進(jìn)行改性,但是,這些方法都不可避免地會破壞膠原蛋白的螺旋結(jié)構(gòu),為了使膠原蛋白能滿足更多領(lǐng)域的需求,更多有效的改性方法仍需后續(xù)的深入研究。膠原蛋白如何與其他功能性物質(zhì)的配合使用發(fā)揮其功能特性也需后續(xù)研究。

