兩種國蘭C類花發(fā)育MADS基因的克隆與表達研究
田云芳, 王會魚,羅 青,李春閣,陳麗培,徐艷花
(1 鄭州師范學(xué)院 生命科學(xué)學(xué)院,鄭州 450044;2 鄭州市觀賞藥用特色資源植物重點實驗室,鄭州 450044)
國蘭是中國十大名花之一,有花中君子的美譽。《孔子家語》載道:“芝蘭生于深谷,不以無人而不芳;君子修道立德,不為困窮而改節(jié)。”國蘭栽培歷史悠久,香氣淡幽,花型奇特。花是被子植物重要的生殖器官,也是被子植物進化過程中變化最豐富的結(jié)構(gòu)。國蘭花器官一般是由3枚萼片,3枚花瓣(其中1枚為唇瓣)及1個合蕊柱(雌雄蕊合生結(jié)構(gòu))構(gòu)成(圖1,Ⅰ)。合蕊柱為蘭科植物花中最為獨特的生殖結(jié)構(gòu),也是蘭科植物的特征性器官。在ABCDE花發(fā)育基因模型(圖1,Ⅱ)中,就模式植物擬南芥而言,萼片的生長發(fā)育由功能基因A+E控制;花瓣由功能基因A+B+E控制;雄蕊由功能基因B+C+E控制;雌蕊由功能基因C+E控制[1]。C類基因主要進行調(diào)控心皮和雄蕊的生長發(fā)育[2]。AG基因是植物花發(fā)育的C類MIKC 型MADS-box 基因[3],所編碼的蛋白往往具有保守程度不同的M區(qū)(較為保守)和K區(qū)(相對保守),在花發(fā)育初級階段決定雄蕊和雌蕊的發(fā)育,與心皮、胚珠及果實等的生長發(fā)育緊密相關(guān),在花器官生長發(fā)育中起著重要的作用,而且在植物花發(fā)育、干細胞維持及發(fā)育進程結(jié)束的基因調(diào)控網(wǎng)絡(luò)中扮演著重要的角色[4]。
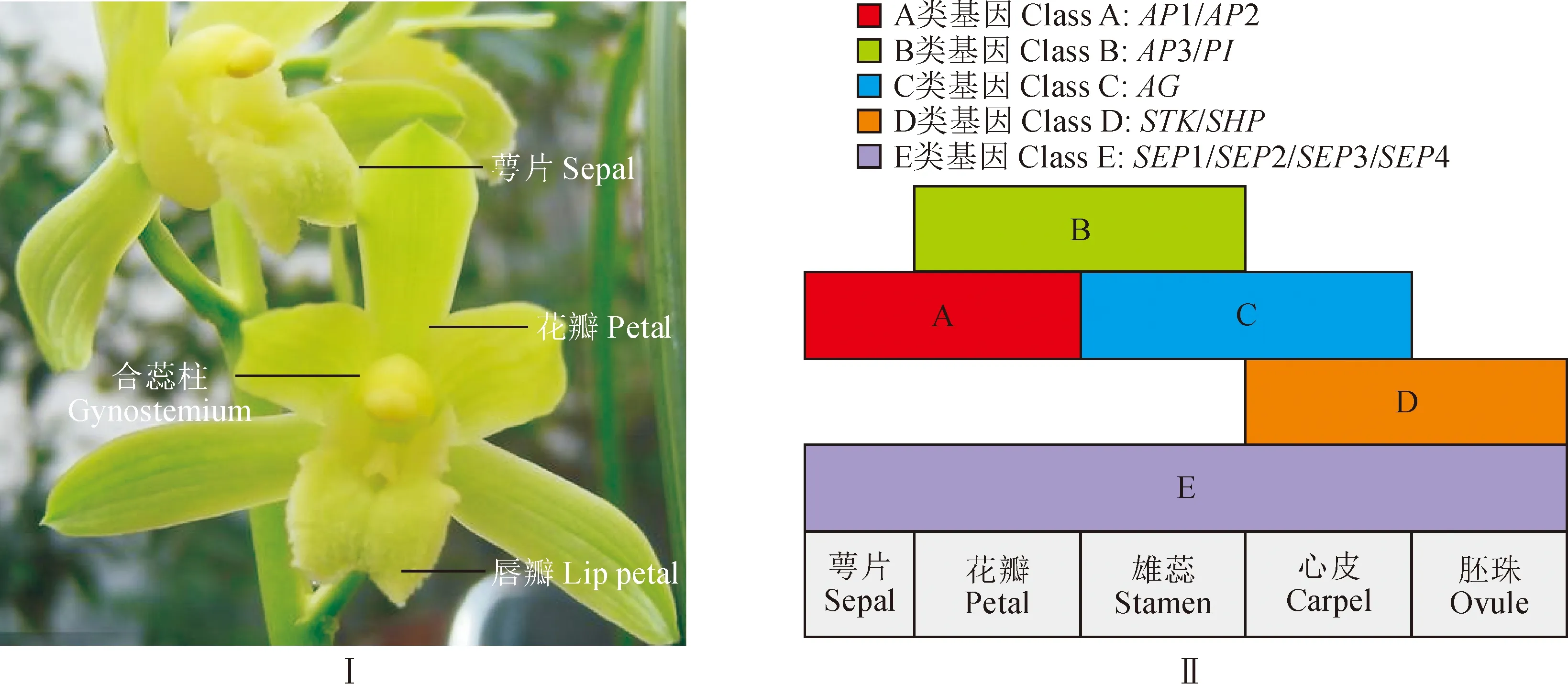
圖1 國蘭花型結(jié)構(gòu)圖(Ⅰ)及擬南芥花發(fā)育模型(Ⅱ)Fig.1 Flower type structure diagram of Chinese Cymbidium (Ⅰ) and flower development model of Arabidopsis thaliana (Ⅱ)
前人研究中,梅[5]、百合[6]的AG基因和紅花玉蘭的MAwuAG[7]基因主要表達于雌雄蕊;春蘭CygoAG1基因僅在3個部位表達,花粉團、合蕊柱和子房,子房最高,CygoAG2 基因在所有花被片、花粉團、合蕊柱和子房中均檢測到,合蕊柱最高[8];建蘭CeMADS1 和CeMADS2 的時空表達特性也明顯不同,分別主要參與子房、合蕊柱的生長發(fā)育[9];玫瑰RhAG基因在雄蕊中大量表達,其沉默致花瓣增多,RhAG主要影響雄蕊發(fā)育[10];楊樹AG基因功能較為保守,沉默后致花器變化,進而影響花器官的決定、胚珠的分化和種毛的發(fā)育[11]。
隨著分子生物學(xué)的發(fā)展,蘭花花發(fā)育基因的表達和功能也成為研究的熱點[12],深入探索國蘭C類花器官發(fā)生發(fā)育的AG同源基因的表達調(diào)控機制。為了明晰AG同源基因在國蘭花發(fā)育過程中的調(diào)控特征,本實驗采用同源基因克隆技術(shù)從蕙蘭和墨蘭中獲得了3 個AG基因,并分析了這3個基因在蕙蘭和墨蘭3個生長階段的根、葉、花被片、合蕊柱及子房等的組織表達特性,比較了該基因的表達對花器官形態(tài)發(fā)育的調(diào)控,以期在分子層面深入研究2種國蘭花發(fā)育的調(diào)控網(wǎng)絡(luò)和后期育種時的花型改良奠定研究基礎(chǔ)。為進一步闡明蘭科植物的遺傳進化與形態(tài)演變以及蘭花分子育種提供理論依據(jù)。
1 材料和方法
1.1 試驗材料
本研究材料蕙蘭和墨蘭取自鄭州師范學(xué)院蘭花工程研究中心,選取3個生長階段(成苗期、花蕾期和盛花期)的器官和組織。
1.2 方 法
1.2.1 總RNA 提取及cDNA 第一鏈的合成按照RNAprep pure 試劑盒的方法提取2種國蘭器官和組織的總RNA,分別吸取1 μL 所提取不同材料的RNA,在1.0%濃度(1g瓊脂糖+100 mLTAE緩沖液) 的瓊脂糖凝膠上進行電泳判斷RNA是否完整,利用微量紫外分光光度計分析濃度、質(zhì)量。以蕙蘭和墨蘭的子房總RNA 為模板,用M-MLV試劑盒完成反轉(zhuǎn)錄。
1.2.2AG基因克隆及分析根據(jù)GenBank 中已登錄擬南芥Arabidopsisthaliana(X53579.1)及蘭科植物建蘭Cymbidiumensifolium(JN613149.1)、球花石斛Dendrobiumthyrsiflorum(DQ017702.1)、蝴蝶蘭Phalaenopsishybrid cultivar(DQ534013.1)等的AG基因保守序列設(shè)計上下游引物(AG-F、AG-R,表1)。以蕙蘭和墨蘭子房總RNA反轉(zhuǎn)錄后的cDNA為模板進行RT-PCR,退火溫度為51.9 ℃,預(yù)期目的條帶獲得后切膠回收,再連接T載體進行TA 克隆,測序后分析。輸入正確的AG核苷酸序列在NCBI(http:// blast.ncbi.nlm.nih.gov/) 上通過Blastn檢索,并與其他物種AG核苷酸序列比對;通過Blastp比對所編碼蛋白并獲得其保守結(jié)構(gòu)域及功能域。
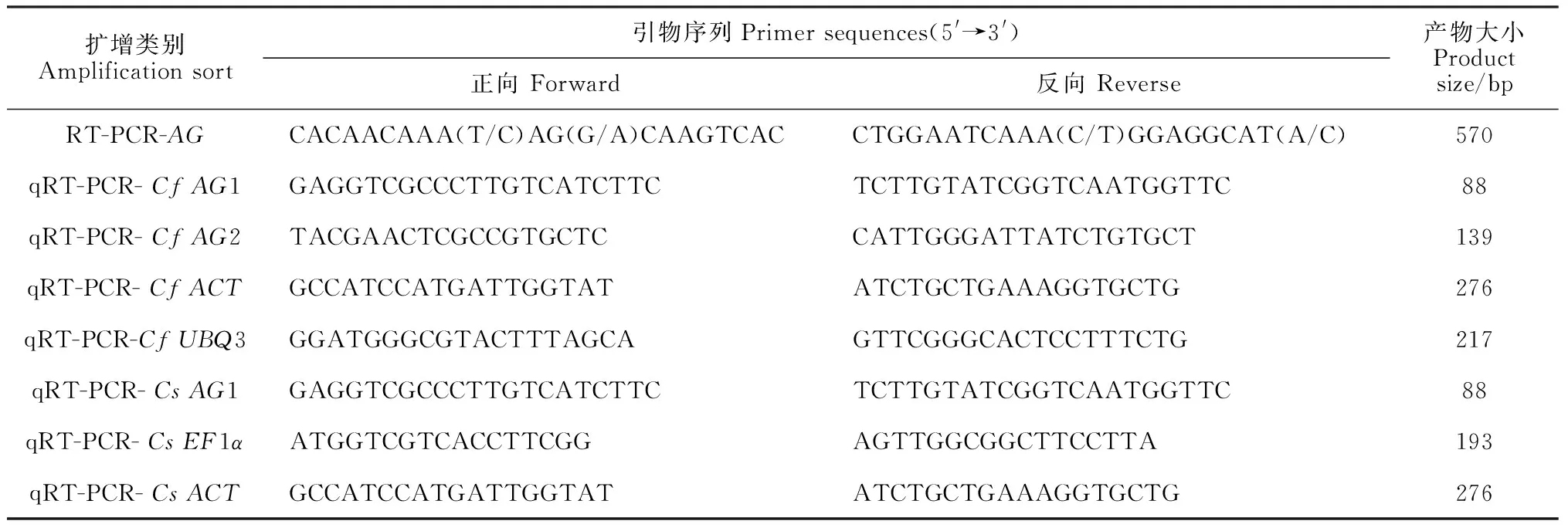
表1 本實驗所用的引物
1.2.3AG基因時空表達分析依據(jù)測序分析得到的AG核苷酸序列設(shè)計特異性引物以進行qRT-PCR實驗。參照SYBR Premix ExTaqTMⅡ 使用說明,用qRT-PCR 的方法檢測AG基因在蕙蘭和墨蘭不同組織的相對表達,采用ACT、UBQ3作為蕙蘭AG基因表達的內(nèi)參基因,EF1α、ACT作為墨蘭的內(nèi)參基因,試驗重復(fù)3次。Tm值設(shè)為58 ℃,利用蒸餾水為陰性對照,反應(yīng)體系20 μL,PCR儀程序設(shè)置為:95 ℃預(yù)變性30 s,95 ℃變性15 s,58 ℃退火15 s, 72 ℃延伸30 s,共設(shè)40 個循環(huán)。
1.3 數(shù)據(jù)處理
用 Excel 2007進行數(shù)據(jù)分析并制圖,采用SPSS25.0軟件進行方差分析及相關(guān)性分析。統(tǒng)計值以平均值±標準誤(mean±SE)表示。
2 結(jié)果與分析
2.1 AG基因cDNA序列克隆
分別以蕙蘭、墨蘭的子房cDNA為模板,結(jié)合AG-F、AG-R引物進行擴增,得到3條長度約為600 bp 的目的條帶(圖2),與預(yù)期結(jié)果一致,測序后長度分別為567、561和567 bp。將其核苷酸序列在NCBI上Blastn分析,發(fā)現(xiàn)蕙蘭的序列1與春蘭Cymbidiumgoeringii(MH917910.1) 的AG基因有99%的相似性;序列2與春蘭(MF462085.1) 有84%的相似性;分別將該基因命名為CfAG1和CfAG2,提交GenBank,登錄號為MW654188和MW654189。墨蘭的序列與建蘭Cymbidiumensifolium(JN613149.1) 的AG基因有99%的相似性,命名為CsAG1,登錄號為MW654190。
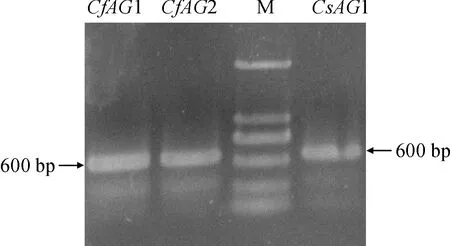
CfAG1. 蕙蘭AG1; CfAG2. 蕙蘭AG2; M.DL2000; CsAG1.墨蘭AG1圖2 蕙蘭和墨蘭AG基因的PCR產(chǎn)物CfAG1. C. faberi AG1; CfAG2. C. faberi AG2; M. DL2000; CsAG1. C. sinense AG1Fig.2 PCR product of AG gene from C. faberi and C. sinense
2.2 AG基因編碼的蛋白序列分析
將3條核苷酸序列對應(yīng)編碼的氨基酸在GenBank庫中通過Blastp檢索,比對發(fā)現(xiàn)3個蛋白均包含高度保守的MADS區(qū)和半保守的K區(qū),MADS蛋白結(jié)構(gòu)域能夠結(jié)合特定的DNA序列調(diào)控基因表達,是典型的MADS-box結(jié)構(gòu),調(diào)節(jié)蛋白質(zhì)間的彼此作用。3條核苷酸序列均屬于植物特有的C類MIKC型MADs-box基因(圖3~5)。

圖3 CfAG1基因核苷酸和推測的氨基酸序列及蛋白保守域Fig.3 Nucleotide acid and deduced amino sequences of CfAG1 and conservative protein domain structure

圖4 CfAG2 基因核苷酸和推測的氨基酸序列及蛋白保守域Fig.4 Nucleotide acid and deduced amino sequences of CfAG2 and conservative protein domain structure

圖5 CsAG1 基因核苷酸和推測的氨基酸序列及蛋白保守域Fig.5 Nucleotide acid and deduced amino sequences of CsAG1 and conservative protein domain structure
將蕙蘭AG1基因編碼的氨基酸進行同源分析表明,與建蘭AG(AEZ51868.1)相似性高達99%,與球花石斛(AAY86364.1)相似性為95%,蝴蝶蘭(ARX76299.1)相似性為94%,文心蘭Oncidiumhybrid cultivar(AIJ29176.1)相似性為94%,春蘭(QDF44721.1)相似性為85%,說明該基因進化保守。
蕙蘭AG2與鐵皮石斛Dendrobiumcatenatum(PKU76866.1)AG的相似性為90%,(AAZ95250.1)相似性為88%,建蘭(ADP00516.1)相似性為85%,春蘭(QDF44721.1)相似性為85%,說明該基因保守性較強。
墨蘭AG1與建蘭(AEZ51868.1)相似性為99%,球花石斛(AAY86364.1)相似性為95%,蝴蝶蘭(ARX76299.1)相似性為94%,文心蘭(AIJ29176.1)相似性為94%,小蘭嶼蝴蝶蘭Phalaenopsisequestris(XP_020582512.1)相似性為86%,保守性也比較強。
2.3 AG基因表達分析
2.3.1 蕙蘭為了確定AG基因在蕙蘭中的時空表達模式,在不同的組織、器官中進行了實時熒光定量qRT-PCR。結(jié)果表明(圖6),CfAG1在盛花期生殖器官合蕊柱中高豐度表達,在花蕾期花蕾和盛花期子房中中度表達;在苗期和花蕾期的營養(yǎng)器官中不表達,在盛花期的花被片和花葶中也幾乎不表達,在盛花期的葉片中有少量表達。CfAG2在盛花期生殖器官子房中高豐度表達,盛花期生殖器官合蕊柱中中度表達,花蕾期花蕾和盛花期花萼中少量表達;在苗期和花蕾期的營養(yǎng)器官中幾乎不表達,在盛花期的花瓣、葉片和花葶中也幾乎不表達(圖6)。
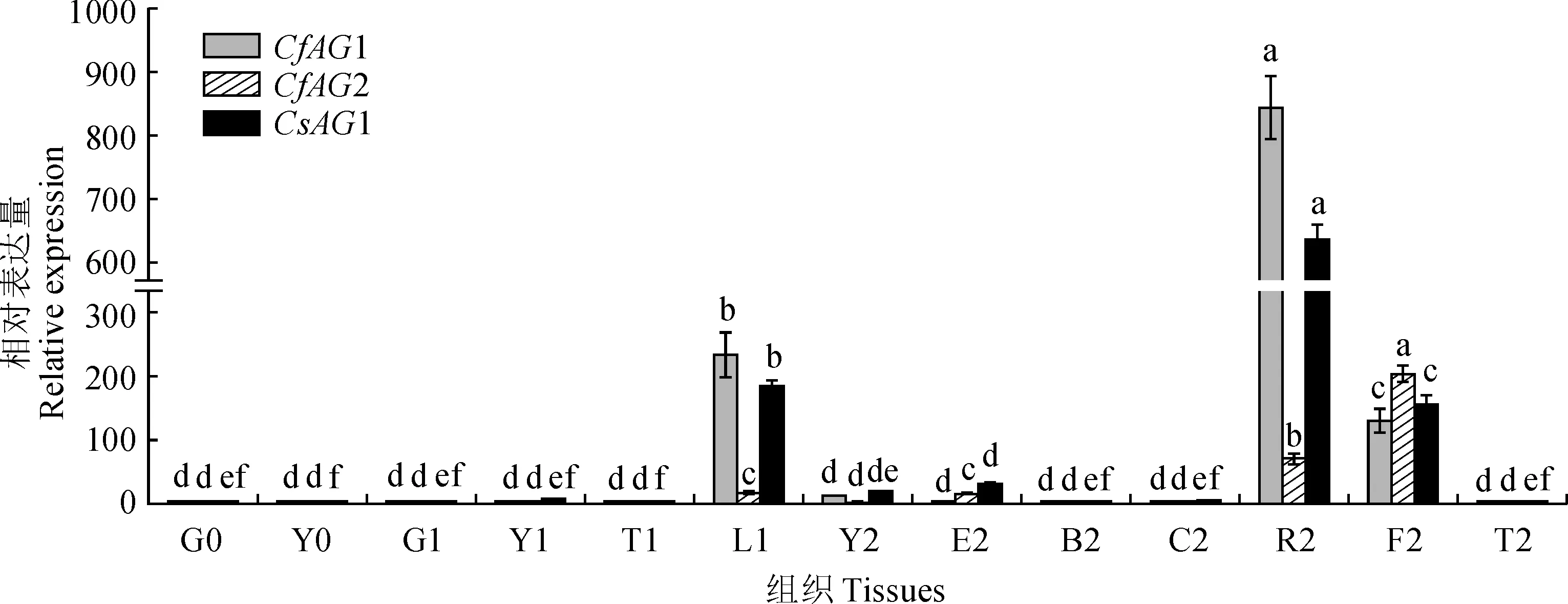
0. 成苗期;1.花蕾期;2.盛花期;G.根;Y.葉;T.花葶;L.花蕾;E.花萼;B.花瓣;C.唇瓣;R.合蕊柱;F.子房;不同小寫字母表示同一基因在不同組織的表達量有顯著性差異 (P<0.05)圖6 CfAG1、CfAG2和CsAG1基因在不同組織中的表達模式0. Adult seedling stage; 1. Bud stage; 2. Full-blossom stage; G. Root; Y. Leaf; T. Inflorescence rachis; L. Bud; E. Calyx; B. Petal; C. Lip petal; R. Gynostemium; F. Ovary. Different normal letters mean significant difference of the same gene in different tissues (P<0.05)Fig.6 Expression patterns of CfAG1,CfAG2 and CsAG1 in different tissues
2.3.2 墨蘭以墨蘭3個時期的根、葉、花等組織的總RNA為模板分析CsAG1基因的表達模式。結(jié)果表明(圖6),CsAG1基因表達量最高的部位是墨蘭盛花期合蕊柱,表達量次之的部位是花蕾期花蕾和盛花期子房,盛花期萼片和葉片中輕微表達;在合蕊柱、花蕾、子房中表達豐度分別約是盛花期葉片的 33 倍、10倍和8 倍;在苗期和花蕾期的營養(yǎng)器官中幾乎不表達,盛花期的花瓣、花葶中也幾乎不表達。從表達時期來看,2個基因的表達量依次為:盛花期>花蕾期>成苗期。
3 討 論
3.1 表達特性
多數(shù)MADS-box基因控制花器官的發(fā)育[13], 少見在花器官中不表達[14]。植物C 類花器官特征基因AG編碼的MADS 轉(zhuǎn)錄因子家族成員,主要調(diào)控決定花器官第三和第四輪[15]。本研究中所獲得的3個基因均具有保守的M區(qū)和相對保守的I區(qū),屬于MADS-box基因。3個基因在花瓣中均不表達,但在合蕊柱中高豐度表達,而且CfAG2、CsAG1在花萼中也有表達,這與梅AG基因在各器官中的表達一致[5],梅AG基因在萼片、雄蕊、雌蕊、果皮和種子均能檢測到,且表達量較高,但是在葉片以及花器官的花瓣中不表達,春蘭CygoAG2 基因在所有花被片、花粉團、合蕊柱和子房中也均檢測到[8],推斷CfAG2、CsAG1參與花萼的發(fā)育。CfAG1、CsAG1在花蕾和合蕊柱中突出表達也與萼脊蘭AG基因表達也較為一致[16],萼脊蘭AG基因在花蕾和蕊柱中表達量很高,很可能控制著雄蕊和雌蕊的發(fā)育,推斷CfAG1、CsAG1主要參與花蕾和合蕊柱的發(fā)育。RhAG作為玫瑰中AG同源基因的代表,在雄蕊發(fā)育中顯著高調(diào)表達,沉默玫瑰中AG的同源物RhAG可以導(dǎo)致其花瓣數(shù)量增加[10]。甜櫻桃PaMADS5在花的雄蕊和心皮中表達,可能參與調(diào)控雌蕊的發(fā)育[17]。小麥WAG-2基因與花器官發(fā)育,尤其是雌蕊、心皮、胚珠的發(fā)育密切相關(guān)[18]。這也進一步證明本實驗得到的3個基因很可能具有與其他植物類似的調(diào)控雄蕊、子房、花蕾、花萼等的發(fā)生發(fā)育的作用,為該基因的遺傳轉(zhuǎn)化及蘭屬植物新品種的培育提供了理論基礎(chǔ),下一步實驗可以通過模式植物驗證其基因功能。
3.2 兩種國蘭AG基因表達比較
蕙蘭CfAG1和墨蘭CsAG1表達特性相似,表達豐度最高的部位均是盛花期合蕊柱,其次是花蕾,接著是子房。二者與蕙蘭CfAG2的表達特性較為一致的是,合蕊柱、子房中的表達量均比較高;不太一致的是在蕙蘭中子房是CfAG2表達豐度最高的部位,花蕾中表達豐度相對較低。可以肯定的是這3個基因均能調(diào)控合蕊柱和子房的發(fā)育,推斷3個基因均屬于C功能基因;蕙蘭CfAG1和墨蘭CsAG1還調(diào)控花蕾的發(fā)育。二球懸鈴木PaAG2在整個果實的發(fā)育過程中的表達量較高,更特異地在果實中表達,與B類基因PlacPI2a以及E類基因PlacSEP1有強烈互作[19]。AG是引發(fā)植物生殖器官發(fā)育的調(diào)控基因之一,本實驗結(jié)果中合蕊柱、子房和花蕾中AG基因的高豐度表達很好地證實了AG基因與生殖器官發(fā)育引發(fā)的密切關(guān)系,也為蘭屬植物生殖器官尤其是蘭科植物的特征器官合蕊柱的發(fā)育研究提供了很好的支持。
3.3 AG與AP1對花器官的控制
C類基因和A類基因在自身調(diào)控表達的器官或組織內(nèi)彼此抑制[20]。在花發(fā)育進程中首先表達的是AP1和AP2兩種A類基因,作為一種花分生組織特異性表達基因的AP1早在器官特異性基因的被激活前已經(jīng)表達,比如CfAP11[21]和CfMADS1[22]的表達在蕙蘭成苗期的葉片中就已經(jīng)檢測到,萼脊蘭AP1-like也可能在調(diào)控植物由營養(yǎng)生長向生殖生長過渡階段起重要作用[23]。由于A、C兩類基因間的彼此抑制,一旦C類基因AG被激活表達后,即可在花器官的3、4輪對A類基因AP1抑制表達,比如在盛花期合蕊柱中CfAG1、CfAG2、CsAG1表達豐度高,而CfAP11和CfMADS1幾乎檢測不到[21-22],正好驗證了C類基因AG對A類基因AP1表達的抑制; 而在花器官1、2輪AG基因被A類基因AP2抑制表達,而不是AP1,AP1不抑制AG基因的表達,例如,有研究表明,AP1和AG基因被LEAFY(LFY) 直接靶向,AP1對AG基因的表達不抑制[24-25],而AP2和CURLYLEAF(CLF)、LEUNIG(LUG)、STERILEAPETALA(SAP)、ANTEGUMENTA(ANT) 和SEUSS(SEU) 5個基因抑制AG基因在第1輪和第2輪花器官中表達[26-27]。在我們的實驗中,在盛花期的花萼中CfAG2、CsAG1有一定量的表達,也證明了AG基因的表達不被AP1抑制。
維持及終止花分生組織干細胞的活性由C 類花器官特征基因AG調(diào)控[4]。同一器官或組織的不同發(fā)育時期,CfAG1、CfAG2和CsAG1基因的表達特性有所區(qū)別,進一步表明該基因參與了蕙蘭和墨蘭的花發(fā)育過程,然而3個基因的功能還需要遺傳轉(zhuǎn)化實驗進一步去驗證。再者,AG基因也屬于開花調(diào)節(jié)基因,開花分子生物學(xué)研究一直是國際上的研究熱點,然而AG基因控制調(diào)節(jié)開花方面的研究報道還比較少。同時,AG基因的持續(xù)表達導(dǎo)致茉莉酸甲酯產(chǎn)生也是擬南芥開花時間較短的主要原因[28]。綜上所述,本結(jié)果為后期蘭屬植物花發(fā)育、遺傳轉(zhuǎn)化及新品種培育等研究提供了一定的基礎(chǔ)數(shù)據(jù)和科學(xué)依據(jù)。

