外源甜菜堿處理對南果梨果實貯藏品質的影響
李燦嬰 ,侯佳寶 ,張 浪 ,蔣超男 ,葛永紅
(1.渤海大學 食品科學與工程學院,遼寧錦州 121013;2.生鮮農產品貯藏加工及安全控制技術國家地方聯合工程研究中心,遼寧錦州 121013)
0 引言
南果梨是遼寧省極具地方特色的秋子梨(Pyrus ussuriensis Maxim)品種,果實色澤鮮艷,風味宜人,素有“梨中之王”的美稱[1-2]。新鮮采收的南果梨果實堅硬,口感較差,缺乏獨特的香味,后熟后充分顯露出果實的口感、風味和色澤。南果梨成熟時間一般集中于9月上、中旬,常溫下貯藏壽命較短,由于水分流失、果肉褐變、果實軟化等原因,南果梨果實的品質受到嚴重影響[3]。低溫(0±0.5) ℃貯藏通常用于延長南果梨的貨架期,但長期冷藏會降低果實品質并導致冷害癥狀,如失去特有的風味、果皮和果肉褐變[4]。因此,研究和開發南果梨綠色防腐保鮮技術迫在眉睫。
目前,南果梨果實的貯藏保鮮研究多運用氣調、低溫、1-甲基環丙烯、二氫茉莉酸丙酯、涂膜保鮮、氣調貯藏等方法[5-11]。甜菜堿是一類季胺型生物堿,是植物細胞內最重要的非毒性滲透調節物質之一,對細菌、真菌、藻類、植物、動物和人類等生物的滲透調節起著至關重要的作用,具有穩定生物大分子結構和生物膜系統的完整性、維持細胞滲透平衡、保持蛋白質和代謝酶的活性、緩解氧化脅迫損傷等多種生理功能[12]。研究表明,外源甜菜堿處理能夠提高番木瓜、枇杷、桃、黃瓜、西葫蘆、山楂等果實的抗冷能力,且抑制冷害的發生與激活體內抗氧化相關酶活性和保護膜完整性有關[13-17]。甜菜堿誘導處理能提高Pichia caribbica對蘋果灰霉病的控制效果,提高果實抗氧化酶的活性[18]。此外,甜菜堿處理還能夠提高桃果實可溶性固形物、總酚和抗壞血酸含量[19];有效減輕香椿嫩芽的失重率和腐爛,抑制呼吸強度,同時減緩葉綠素、抗壞血酸和總黃酮含量的損失[20]。已有研究表明,甜菜堿能夠提高果實抗冷能力減輕冷害現象[21],保持果實良好的采后品質。植物在受到脅迫時,通過在細胞質中大量積累甜菜堿來調節滲透壓,從而維持細胞的水分平衡[22]。然而,有關采后甜菜堿處理對南果梨果實貯藏品質及果實軟化的影響尚未見報道。
本研究以南果梨果實為試材,研究采后不同濃度的甜菜堿處理對果實貯藏品質的影響,同時探討其對果實果膠物質代謝相關酶活性的影響,以期為甜菜堿在南果梨果實采后貯藏保鮮中的應用提供理論依據。
1 材料與方法
1.1 材料與試劑
南果梨果實采自錦州市北鎮市羅羅堡鎮,八成熟時采收,然后用紙箱包裝(60個/箱),運回實驗室,在(20±1)℃,相對濕度30%~40%下貯藏待用。
甜菜堿(純度98%,山東西亞化學股份有限公司);果膠(純度74%,北京索萊寶科技有限公司);3,5-二硝基水楊酸(分析純,北京索萊寶科技有限公司);三(羥甲基)氨基甲烷(分析純,北京索萊寶科技有限公司)。
1.2 儀器與設備
H1650R型小型冷凍離心機(湖南湘儀儀器有限公司);UV-1801型紫外分光光度計(北京北分瑞麗分析儀器集團);Check Point Ⅱ便攜式CO2/O2測定儀(丹麥PBI-Dansensor公司);LX-A型硬度計(北京沃威科技有限公司)。
1.3 試驗方法
1.3.1 甜菜堿處理
挑選大小一致、顏色均勻、無機械損傷和病蟲害的南果梨果實,用1%次氯酸鈉溶液消毒1 min,清水沖洗后將果實分為4份,3份分別用5、10和 20 mmol/L甜菜堿溶液(含 0.1%Tween 20)浸泡果實10 min,1份用等量蒸餾水(內含0.1%Tween 20)處理并作為對照。室溫晾干后分別裝入PE塑料袋并置于干凈的紙箱中,于20±1 ℃貯藏(30%~40% RH)。
1.3.2 呼吸速率和失重率測定
呼吸速率和失重率的測定參照葛永紅等[22]方法并修改。分別于處理后第0、2、4、6、8、10、12 d取甜菜堿和清水處理果實30個,分別稱重后放入3個密封袋中常溫靜置1 h,然后用Check Point Ⅱ便攜式CO2/O2測定儀測定剩余O2的體積。呼吸速率用mL O2/(h·kg)表示。將甜菜堿和清水處理南果梨果實第0 d的重量視為原始重量,并于處理后第 2、4、6、8、10、12 d 分別稱量兩組處理的果實重量,記為每次稱重量。
失重率(%)=(原始重量-每次稱重量)
×100/原始重量。
根據果實的呼吸速率和失重率的變化差異篩選最佳濃度用于后續研究。
1.3.3 取樣
根據上述結果篩選的甜菜堿濃度和清水各處理南果梨果實210個,參照GE等[23]方法并修改。分別于處理后第 0、2、4、6、8、10、12 d,取南果梨果實赤道部位皮下2~5 mm的果肉組織約3.0 g,切成小塊后,用液氮快速冷凍,用錫箔紙包好后貯藏在-80 ℃冰箱中待用。每次取樣用果實15個。
1.3.4 果肉硬度、可溶性固形物含量和可滴定酸測定
果肉硬度和可溶性固形物含量測定參照曹建康等[24]方法并修改。每次取15個甜菜堿處理和對照果實,削去陰陽面中環部位約1~2 mm的果皮,用LX-A型硬度計進行測定,單位用kg/cm2表示。削取赤道部位陰陽面果實(約1~2 mm厚)的果肉,用阿貝折光儀測定可溶性固形物含量,用%表示。
可滴定酸測定參照陳松江等[25]方法并修改。取處理和對照果肉樣品10.0 g,用液氮處理后研磨成粉末并用蒸餾水轉移到100 mL容量瓶中,沖洗研缽2~3次,合并勻漿,用蒸餾水定容至刻度并搖勻,靜置20 min后過濾。濾液用0.1 mol/L NaOH溶液進行酸堿滴定,記錄NaOH的用量。
總酸度(%)=cVK×1 000/m
式中 c——已標定NaOH溶液濃度,mol/L;
V——滴定消耗NaOH溶液體積,mL;
m——南果梨果實樣品質量,g;
K——換算為0.067 g/mmol蘋果酸的系數。
1.3.5 多聚半乳糖醛酸酶(PG)和果膠甲基酯酶(PME)活性
參照楊志敏等[26]方法。反應混合液為1.0 mL醋酸-醋酸鈉緩沖液(50 mmol/L,pH值為5.5)、0.5 mL密度為10g/L的底物(PG底物為多聚半乳糖醛酸,PME底物為果膠),在37 ℃預熱5 min后,將0.5 mL酶提取液添加到一個試管中,并將滅活酶溶液加到另一個試管中作為對照。混合搖勻后,在37 ℃的水浴中保溫1 min后再加入1.5 mL 3,5-二硝基水楊酸(DNS),在沸水浴中煮沸5 min,迅速冷卻至室溫,并通過DNS法在540 nm處測定。以1 mL酶液1 min催化底物產生1 μg半乳糖醛酸為1個酶活力單位(U)。
1.3.6 多聚半乳糖醛酸反式消除酶(PGTE)和果膠甲基反式消除酶(PMTE)活性測定
參照楊志敏等方法。取兩個試管,依次加入pH值為9.0,濃度為50 mmol/L的4.0 mL Gly-NaOH 緩沖液、3.0 mmol/L 的 1.0 mL CaCl2、1.0 g/L的300 μL多聚半乳糖醛酸或果膠。在30 ℃預保溫5 min,然后加入100 μL酶溶液至試管中,立即測定232 nm處反應混合物的吸光度;加入100 μL酶溶液到另一個試管中,并在30 ℃保溫10 min,冷卻后在232 nm處測定吸光度。PGTE和PMTE活性以每分鐘每克組織在酶促反應下催化底物釋放1 μmol不飽和醛酸反應量表示。
1.4 數據處理
所有指標測定進行3次生物學重復試驗,數據處理采用SPSS 19.0進行LSD分析(p<0.05),采用Microsoft Excel 2010計算平均值和標準誤差并作圖。
2 結果與分析
2.1 甜菜堿處理對南果梨果實失重率的影響
由圖1可知,隨著貯藏時間的延長,不同濃度甜菜堿處理和對照南果梨果實失重率逐漸增大,5、10、20 mmol/L的甜菜堿處理果實的失重率始終低于對照組,其中以5 mmol/L甜菜堿處理果實的失重率最低,在貯藏第4~12 d顯著低于對照果實。

圖1 不同濃度甜菜堿處理對南果梨果實失重率的影響Fig.1 Effects of post-harvest glycine betaine treatment at different concentrations on the weight loss of Nanguo pears
2.2 甜菜堿處理對南果梨果實呼吸速率的影響
由圖2可知,在整個貯藏期間,對照和甜菜堿處理果實呼吸速率整體呈先上升后下降趨勢,在貯藏第10 d出現呼吸高峰。10和20 mmol/L甜菜堿處理果實呼吸速率始終高于對照組,5 mmol/L甜菜堿處理果實的呼吸速率在貯藏第8~12 d顯著低于對照組,并且呼吸峰值為對照的90%。結合呼吸速率和失重率的變化趨勢可知,5 mmol/L甜菜堿處理顯著抑制了呼吸速率和失重率的增加,并在一定程度上延緩了果實的衰老。因此,選擇5 mmol/L甜菜堿處理進行后續指標的測定。

圖2 不同濃度甜菜堿處理對南果梨果實呼吸速率的影響Fig.2 Effects of glycine betaine treatment at different concentrations on the respiration rate of Nanguo pears
2.3 甜菜堿處理對南果梨果肉硬度的影響
果肉硬度是果實主要的品質指標,影響果實的口感。如圖3,隨著貯藏時間的延長,甜菜堿處理和對照果實果肉硬度均呈逐漸下降的趨勢,但甜菜堿處理在貯藏第6~12 d顯著延緩了果肉硬度的下降。在貯藏第10 d和12 d,甜菜堿處理果肉硬度分別是對照的1.24倍和1.40倍。

圖3 甜菜堿處理對南果梨果肉硬度的影響Fig.3 Effects of glycine betaine treatment on the flesh hardness of Nanguo pears
2.4 甜菜堿處理對南果梨果實可滴定酸的影響
可滴定酸主要是果實中的有機酸,影響果實品質和貯藏性。由圖4可知,隨著貯藏時間的延長,甜菜堿處理和對照南果梨果實中的可滴定酸總體呈先升后降趨勢。在整個貯藏過程中,甜菜堿處理果實中的可滴定酸始終高于對照組,但二者之間沒有顯著性差異。

圖4 甜菜堿處理對南果梨果實可滴定酸的影響Fig.4 Effects of glycine betaine treatment on the titratable acid of Nanguo pears
2.5 甜菜堿處理對南果梨果實可溶性固形物含量的影響
由圖5可知,甜菜堿處理和對照組南果梨果實可溶性固形物含量總體呈上升趨勢,且變化趨勢基本一致。貯藏第0~10 d,對照和甜菜堿處理組果實的可溶性固形物含量上升,在第10 d達到最大,然后開始下降。在整個貯藏期間,甜菜堿處理果實的可溶性固形物含量始終低于對照組,但二者沒有顯著的差異。

圖5 甜菜堿處理對南果梨果實可溶性固形物含量的影響Fig.5 Effects of glycine betaine treatment on the soluble solids content of Nanguo pears
2.6 甜菜堿處理對南果梨果實PME和PG活性的影響
由圖6(a)可知,隨著貯藏時間的延長,甜菜堿處理和對照果實PME活性呈相同的變化趨勢,貯藏第0~8 d升高,第8~12 d下降,在整個貯藏期間處理果實PME活性始終低于對照組,并且在貯藏第6、8和12 d顯著低于對照。
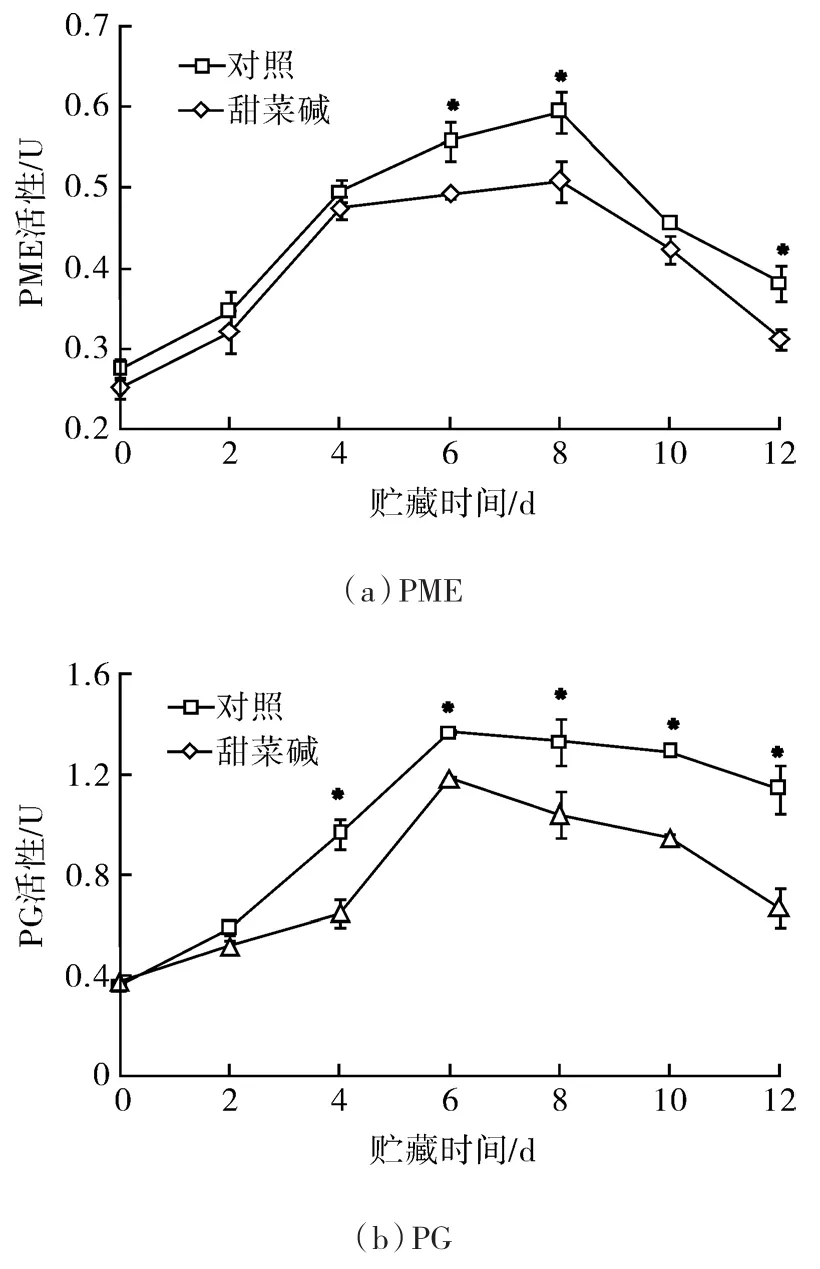
圖6 甜菜堿處理對南果梨果實PME和PG活性的影響Fig.6 Effects of glycine betaine treatment on the activities of pectin methylesterase and polygalacturonase of Nanguo pears
由圖6(b)可知,整個貯藏過程中,甜菜堿處理和對照果實PG活性總體呈現出相同的變化趨勢。貯藏第0~6 d,對照和甜菜堿處理果實PG活性呈上升趨勢;第6~12 d,PG活性逐漸降低。在整個貯藏期間,甜菜堿處理果實的PG活性始終低于對照,并且在貯藏第4~12 d二者差異顯著。貯藏第8、10和12 d,對照果實PG活性分別是甜菜堿處理果實的1.28、1.36和1.70倍。
2.7 甜菜堿處理對南果梨果實PMTE和PGTE活性的影響
PMTE和PGTE是兩種重要的果膠裂解酶,與采后果實的軟化密切相關。由圖7(a)可知,整個貯藏過程中,甜菜堿處理和對照果實PMTE活性呈先升高后緩慢下降的變化趨勢,并且甜菜堿處理果實PMTE活性始終低于對照組,在貯藏第4~6 d差異顯著。對照和處理果實PMTE活性在貯藏第6 d達到最大,對照果實PMTE活性是處理果實的1.19倍。

圖7 甜菜堿處理對南果梨果實PMTE和PGTE活性的影響Fig.7 Effects of glycine betaine treatment on the activities of pectin methyl-trans-eliminase and polygalacturonic acid trans-eliminase of Nanguo pears
如圖7(b),隨著貯藏時間的延長,甜菜堿處理果實PGTE活性始終低于對照果實,二者均呈現先升高后下降的趨勢。貯藏第0~4 d,甜菜堿處理和對照果實PGTE活性急劇升高,在第6 d達到最大,從第6 d開始,二者均開始下降。在貯藏第 4、8、10和 12 d,甜菜堿處理果實 PGTE 活性顯著低于對照果實,分別是對照果實的81.1%、87.4%、82.5%和74.8%。
3 討論
本試驗發現甜菜堿處理能夠有效降低南果梨果實的失重率、抑制呼吸速率,并且顯著降低呼吸高峰值。研究發現,苯并噻重氮處理能夠顯著抑制南果梨果實呼吸速率的升高和失重率的增加,并保持較好的品質。由此表明,采后安全化學藥物處理通過抑制呼吸速率和失重來保持果實的品質。果實的硬度、可溶性固形物含量和可滴定酸是衡量果實貯藏品質的重要指標。果實硬度的下降主要由失水和果膠物質降解等引起。于冠年[27]研究發現,采后1-MCP處理明顯延緩南果梨果實果肉的硬度下降,抑制可溶性固形物含量的上升和可滴定酸的下降。本試驗結果表明,甜菜堿處理有效抑制了南果梨果肉硬度和可滴定酸的下降;但可溶性固形物含量變化與前人研究結果有所差異,主要是因為甜菜堿延緩了南果梨果實后熟過程中淀粉轉化為可溶性糖。
PG和PME是參與細胞壁降解的關鍵酶,PG將多聚半乳糖醛酸降解為半乳糖醛酸,使細胞壁結構解體;PME能作用于果膠,脫去甲氧基生成低甲氧基果膠;PGTE和PMTE屬于果膠裂解酶,PGTE裂解果膠酸分子中的 α-1,4糖苷鍵,而PMTE降解細胞壁中的果膠或甲酯化的多聚半乳糖醛酸[28]。程園等[29]研究發現,硝普鈉處理能夠抑制南果梨果實PG、PME、PGTE和PMTE活性的升高,有效延緩南果梨果實的軟化。本研究發現,甜菜堿處理顯著抑制了南果梨果實PG、PGTE、PME 和PMTE 活性的升高。由此表明,外源甜菜堿處理延緩果實的軟化與其抑制果膠物質降解酶活性密切相關。
綜上所述,外源甜菜堿處理能夠顯著抑制南果梨果實呼吸高峰值,并保持硬度,延緩失重率的增加,抑制可滴定酸的下降和可溶性固形物含量的升高,并且甜菜堿處理保持果實的品質與其抑制細胞壁降解酶活性有關。

