基于混菌耦合發(fā)酵策略合成3′-唾液酸乳糖
游星,郭進,張洪濤*,閆競宇,CHAI Wengang ,周文,劉栗彤,黎玉, 吳劍榮,詹曉北*
1(糖化學與生物技術(shù)教育部重點實驗室,江南大學 生物工程學院,江蘇 無錫,214122) 2(中國科學院大連物理化學研究所,遼寧 大連,116021) 3(Glycoscience Laboratory,Imperial College London,South Kensington Campus,UK London,SW7 2AZ)
母乳寡糖作為在人乳中含量僅次于乳糖和脂類的第三大固體成分[1],對嬰幼兒的健康發(fā)育具有重要作用。其主要由2種結(jié)構(gòu)組成:一種由中性寡糖組成,其中許多是巖藻糖基化的;另一種則含有酸性寡糖,其中大多數(shù)是唾液酸化的[2]。唾液酸化寡糖中最豐富的結(jié)構(gòu)是唾液酸與乳糖結(jié)合產(chǎn)生的唾液酸乳糖[3],根據(jù)結(jié)合位置不同分為3′-唾液酸乳糖(3′-sialyllactose,3′-SL)和6′-唾液酸乳糖[4]。3′-SL具有抗菌和抗炎活性,可以使嬰兒腸道免受感染,有助于嬰兒免疫系統(tǒng)的發(fā)育和成熟,促進嬰兒大腦成熟,改善學習能力等作用[5-8],近年來受到人們越來越多的關注。
合成唾液酸乳糖的方法主要有化學合成法和生物合成法,由于化學合成法涉及到繁瑣的保護和去保護步驟,不適合大規(guī)模生產(chǎn),所以利用生物技術(shù)合成唾液酸乳糖成為最佳方案[9]。唾液酸乳糖的合成需要將唾液酸活化為胞苷單磷酸-N-乙酰神經(jīng)氨酸(cytidine 5′-monophosphateN-acetylneuraminic acid,CMP-Neu5Ac)[10],該過程是一個需要消耗大量三磷酸胞苷(cytidine triphosphate,CTP)的過程。由于CTP價格昂貴(8 000元/kg),造成作為唾液酸乳糖前體物質(zhì)的CMP-Neu5Ac不僅價格昂貴,并且不容易大量獲得,限制了唾液酸乳糖的產(chǎn)量。針對以上缺陷,ENDO等[11]建立了以3株重組大腸桿菌和產(chǎn)氨棒桿菌耦合合成唾液酸乳糖的系統(tǒng)。該策略通過產(chǎn)氨棒桿菌實現(xiàn)CMP到CTP的再生,降低了CTP的使用。但是由于其需要尿苷三磷酸(uridine triphosphate,UTP)來實現(xiàn)CTP的再生,在發(fā)酵體系中不得不引入專門合成UTP的菌株,使得該體系不僅發(fā)酵控制復雜,而且生產(chǎn)成本高的問題依然存在[12-13]。因此,如何簡化發(fā)酵催化體系組成與工藝成為亟需解決的問題。
研究發(fā)現(xiàn)酵母利用自身的酶系能有效地將CMP催化合成CTP[14]。啤酒酵母具有來源廣、培養(yǎng)方便、價格低廉等特點,還有不能利用乳糖發(fā)酵的特征,這樣以乳糖作為底物時就不會被酵母細胞所代謝消耗。因此,研究團隊提出了3菌耦合發(fā)酵合成3′-SL的方案(見圖1):
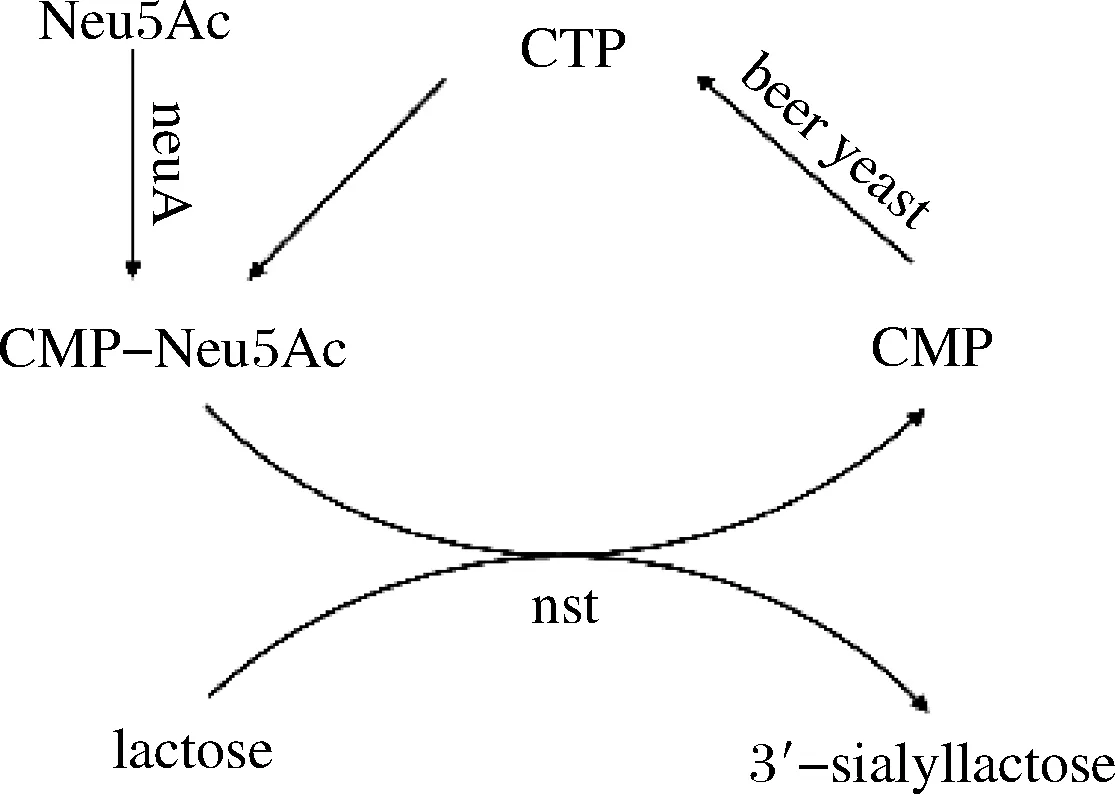
圖1 設計的全細胞催化合成唾液酸乳糖路線Fig.1 Designed strategy for sialyllactose synthesis
(1)利用廢啤酒酵母實現(xiàn)CTP的循環(huán)再生。
(2)用含有CMP-Neu5Ac合成酶基因(neuA)的工程菌JM109(DE3)/pET28a-neuA實現(xiàn)以CTP和N-乙酰神經(jīng)氨酸(N-acetylneuraminic acid,Neu5Ac,也叫唾液酸)為底物合成CMP-Neu5Ac。
(3)用含有唾液酸轉(zhuǎn)移酶基因(nst)的工程菌JM109(DE3)/pET28a-nst來實現(xiàn)唾液酸轉(zhuǎn)移酶的表達。
(4)通過基因工程菌株JM109(DE3)/pET28a-neuA、JM109(DE3)/pET28a-nst和啤酒酵母混菌培養(yǎng)耦合發(fā)酵,實現(xiàn)3′-SL的合成。
1 材料與方法
1.1 實驗材料
1.1.1 菌株與質(zhì)粒
廢啤酒酵母由江南大學生物工程學院啤酒吧平臺饋贈;實驗所需基因來源于腦膜炎奈瑟氏菌(Neisseriameningitidis);EscherichiacoliJM109(DE3),天根生化科技(北京)有限公司;表達載體pET28a為本實驗室保存。
1.1.2 試劑與儀器
質(zhì)粒提取試劑盒、細菌基因組DNA提取試劑盒、瓊脂糖凝膠回收試劑盒,生工生物工程(上海)股份有限公司;限制性內(nèi)切酶、Taq酶、T4DNA連接酶,寶生物工程(大連)有限公司;CMP、CTP(800元/100 g),杭州鎧朋生物技術(shù)有限公司;Neu5Ac,本實驗室合成;CMP-Neu5Ac,西安齊岳生物科技有限公司;3′-SL,大連化物所閆競宇博士提供;其他為國產(chǎn)分析純試劑。
PCR儀、蛋白電泳儀,Bio-Rad公司;高效液相色譜儀,島津公司;高速冷凍離心機,Sigma公司。
1.1.3 培養(yǎng)基及培養(yǎng)條件
LB培養(yǎng)基(g/L):胰蛋白胨10,NaCl 10,酵母提取物5,pH 7.0,121 ℃滅菌20 min。
巧克力色瓊脂平板(g/L):蛋白胨10,牛肉浸膏3,NaCl 5,瓊脂20,脫纖維羊血50 mL,pH 7.2。
培養(yǎng)條件:將腦膜炎菌株接種到巧克力瓊脂平板上,37 ℃、5%CO2環(huán)境培養(yǎng)24 h。
1.2 實驗方法
1.2.1 工程菌JM109(DE3)/pET28a-neuA的構(gòu)建
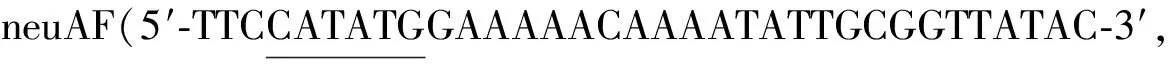
1.2.2 工程菌JM109(DE3)/pET28a-nst的構(gòu)建

1.2.3 重組蛋白的表達與鑒定
將工程菌株接種至含20 μg/mL Kan的10 mL LB液體培養(yǎng)基中,37 ℃、200 r/min搖瓶培養(yǎng)12 h,再按2%(體積分數(shù))的接種量轉(zhuǎn)接到含20 μg/mL Kan的100 mL LB液體培養(yǎng)基中,37 ℃、200 r/min搖瓶培養(yǎng)至OD600約為0.6后,加入終濃度為0.1 mmol/L的IPTG進行誘導,200 r/min搖瓶培養(yǎng)20 h。4 ℃、8 000×g離心10 min收集菌體。將誘導前及誘導20 h的菌液與SDS-PAGE Loading緩沖液混勻,100 ℃加熱10 min,得到誘導前、后樣品,SDS-PAGE檢測蛋白表達。
1.2.4 唾液酸乳糖及其中間產(chǎn)物的合成
1.2.4.1 CMP-Neu5Ac的生成
工程菌株合成CMP-Neu5Ac的轉(zhuǎn)化條件:10 mL體系中包含60 mmol/L CTP、20 mmol/L MgCl2、60 mmol/L Neu5Ac、1 mmol/L DTT、150 mmol/L Tris、50 g/L JM109(DE3)/pET28a-neuA,在30 ℃、200 r/min的條件下反應4 h[15]。
雙菌耦合催化合成CMP-Neu5Ac的轉(zhuǎn)化條件:以70 mmol/L CMP、60 mmol/L Neu5Ac為底物,在300 mmol/L葡萄糖、20 mmol/L MgCl2、248.3 mmol/L KH2PO4、1 mmol/L DTT、150 mmol/L Tris、10 mL/L甘油、6 mL/L乙醛、100 g/L啤酒酵母、50 g/L JM109(DE3)/pET28a-neuA的溶液中,反應4 h(30 ℃,200 r/min)。
1.2.4.2 唾液酸乳糖的生成
單細胞合成3′-SL的轉(zhuǎn)化條件:2 mL體系中包含1 mL按照1.2.4.1中方法合成的CMP-Neu5Ac溶液和1 mL 80 mmol/L乳糖、20 mL/L甘油、10 mL/L二甲苯、248.3 mmol/L KH2PO4、5 g/L MgCl2、4 g/L Nymeen S-215、50 g/L JM109(DE3)/pET28a-nst組成的溶液,30 ℃、200 r/min反應30 h[11]。
雙菌耦合合成3′-SL的轉(zhuǎn)化條件:以60 mmol/L CTP、60 mmol/L Neu5Ac、80 mmol/L乳糖為底物,在20 mmol/L MgCl2、1 mmol/L DTT、150 mmol/L Tris、20 mL/L甘油、10 mL/L二甲苯、4 g/L Nymeen S-215、248.3 mmol/L KH2PO4、50 g/L JM109(DE3)/pET28a-neuA、50 g/L JM109(DE3)/pET28a-nst溶液中,30 ℃、200 r/min的條件下反應30 h。
3菌耦合合成3′-SL的轉(zhuǎn)化條件:以70 mmol/L CMP、60 mmol/L Neu5Ac、80 mmol/L乳糖為底物,在含300 mmol/L葡萄糖、20 mmol/L MgCl2、248.3 mmol/L KH2PO4、1 mmol/L DTT、150 mmol/L Tris、20 mL/L甘油、6 mL/L乙醛,10 mL/L二甲苯、4 g/L Nymeen S-215、100 g/L啤酒酵母、50 g/L JM109(DE3)/pET28a-neuA、50 g/L JM109(DE3)/pET28a-nst溶液中,30 ℃、200 r/min的條件下反應30 h。
1.2.5 唾液酸乳糖與CMP-Neu5Ac的分析檢測
1.2.5.1 CMP-Neu5Ac的分析檢測
TLC檢測:參考HIGA等[16]方法略有改動。展開劑∶V(乙醇)∶V(1 mol/L pH 6.5乙酸銨)=6∶4,通過紫外線照射顯色。
HPLC檢測:色譜條件為依立特C185 μm(4.6 mm×250 mm);流動相A為0.1 mol/L磷酸鉀緩沖液和8 mmol/L四丁基硫酸氫銨(pH 5.3),流動相B為70%流動相A與30%(體積分數(shù))甲醇;梯度洗脫程序(A變化):0~2.5 min 100%,2.5~10 min 100%~60%,10~11 min 60%~0%,11~15 min保持0%,15~16 min 0%~100%,16~30 min保持100%;0.6 mL/min;進樣量為10 μL;紫外檢測波長270 nm;柱溫30 ℃[17]。
1.2.5.2 唾液酸乳糖的TLC檢測及分離純化
TLC檢測:展開劑:V(正丙醇)∶V(水)∶V(25%氨水)=7.5∶3∶2[18];顯色劑:苯胺-二苯胺-磷酸顯色劑,4 g二苯胺、4 mL苯胺與20 mL 85%(體積分數(shù))磷酸共溶于200 mL丙酮中[19];105 ℃加熱5 min顯色。
分離純化方法:HyperSep Hypercarb固相萃取小柱(SPE小柱),先用3 mL甲醇活化,再用3 mL水平衡,上樣500 μL,流出的液體記為“流穿”,接著用3 mL水洗,得到的溶液記為“水洗”,最后用3 mL 80%(體積分數(shù))乙腈洗脫,得到的溶液記為“純化后”。
2 結(jié)果與分析
2.1 工程菌JM109(DE3)/pET28a-neuA的構(gòu)建及NeuA誘導表達
以N.meningitidis基因組為模板,通過PCR獲得大小為687 bp的neuA基因,然后將該基因引入pET28a載體,獲得質(zhì)粒pET28a-neuA。重組質(zhì)粒pET28a-neuA經(jīng)過NdeI和SalI雙酶切后,結(jié)果如圖2-a所示,得到兩條片段分別大約為5 300 bp和700 bp。經(jīng)測序驗證正確后,得到重組質(zhì)粒pET28a-neuA。
將重組質(zhì)粒pET28a-neuA轉(zhuǎn)入JM109(DE3)得到工程菌JM109(DE3)/pET28a-neuA,用IPTG誘導目的蛋白表達,SDS-PAGE電泳結(jié)果如圖2-b所示,從圖中可以看出,誘導20 h的全細胞在25~35 kDa有明顯的表達條帶,其分子質(zhì)量與KARWASKI等[15]報道的CMP-Neu5Ac合成酶(NeuA)一致,說明NeuA在工程菌JM109(DE3)/pET28a-neuA中成功表達。

a-重組質(zhì)粒pET28a-neuA雙酶切圖; b-重組質(zhì)粒pET28a-neuA SDS-PAGE圖a:M-10 000 DNA Marker;1-Nde I/Sal I雙酶切 b:M-Protein Marker;1-誘導前全細胞;2-誘導20 h的全細胞圖2 重組質(zhì)粒pET28a-neuA電泳圖Fig.2 Electrophoresis of recombinant plasmid pET28a-neuA
2.2 工程菌JM109(DE3)/pET28a-nst的構(gòu)建及Nst的誘導表達
以N.meningitidis基因組為模板,通過PCR獲得大小為1 137 bp的nst基因,然后將該基因引入pET-28a載體,獲得重組質(zhì)粒pET28a-nst。對重組質(zhì)粒pET28a-nst進行了NcoI和BamH I雙酶切驗證,電泳結(jié)果如圖3-a所示,得到2條片段分別大約為5 300和1 100 bp。經(jīng)測序驗證正確后,得到重組質(zhì)粒pET28a-nst。
然后將重組質(zhì)粒pET28a-nst轉(zhuǎn)入JM109(DE3)得到工程菌JM109(DE3)/pET28a-nst。用IPTG誘導唾液酸轉(zhuǎn)移酶(Nst)的表達,其SDS-PAGE電泳結(jié)果如圖3-b所示,誘導20 h的全細胞與誘導前相比,其在35 k~45 kDa有明顯的表達條帶,與目標蛋白(43.3 kDa)一致。這表明Nst在工程菌JM109(DE3)/pET28a-nst中成功表達。
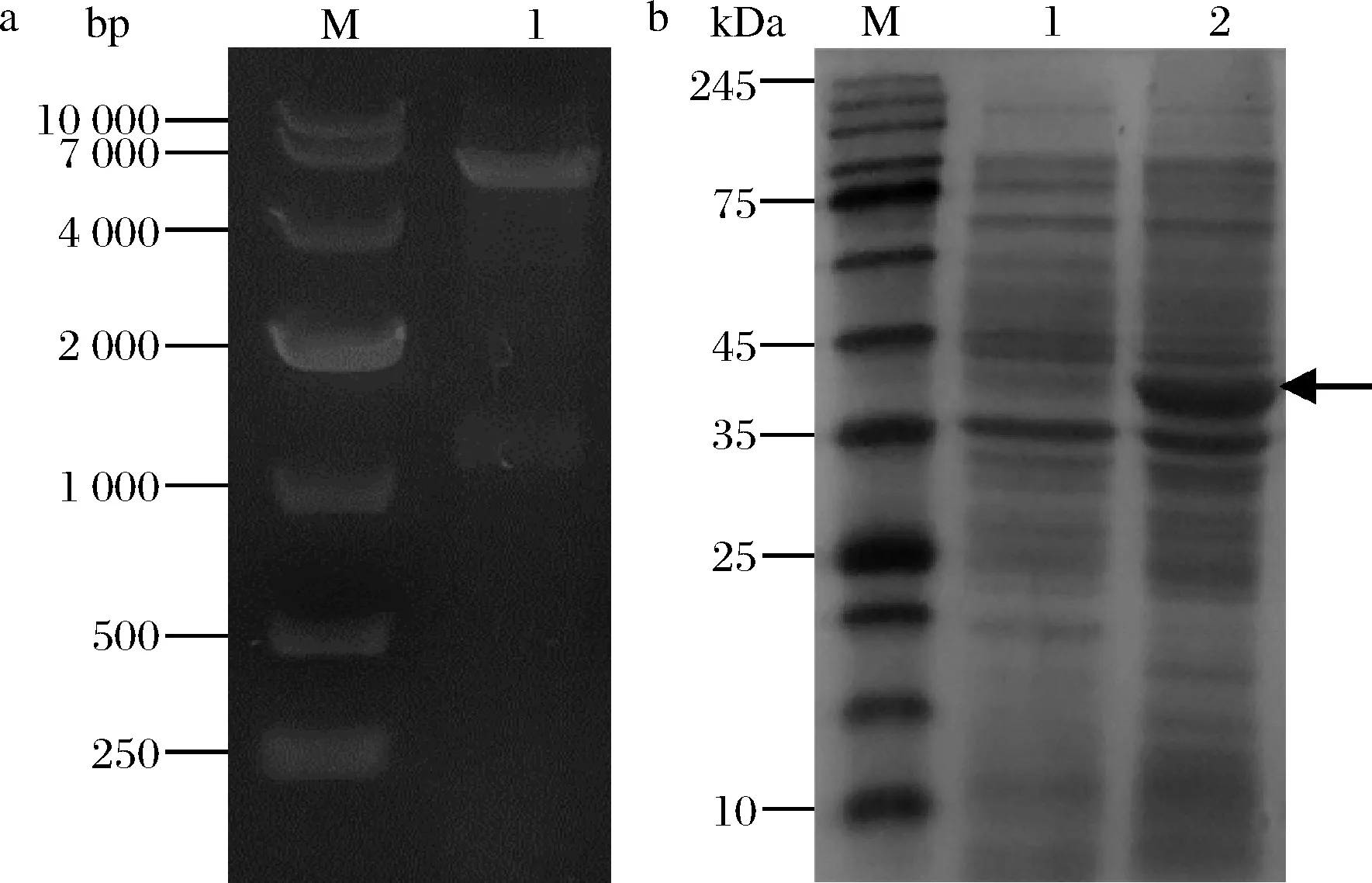
a-重組質(zhì)粒pET28a-nst雙酶切圖; b-重組質(zhì)粒pET28a-nst SDS-PAGE圖a:M-10 000 DNA Marker;1-Nco I/BamH I雙酶切 b:M-Protein Marker;1-誘導前全細胞;2-誘導20 h的全細胞圖3 重組質(zhì)粒pET28a-nst電泳圖Fig.3 Electrophoresis of recombinant plasmid pET28a-nst
2.3 CMP-Neu5Ac耦合發(fā)酵合成體系優(yōu)化
2.3.1 工程菌JM109(DE3)/pET28a-neuA合成CMP-Neu5Ac的條件優(yōu)化
為順利實現(xiàn)雙菌(啤酒酵母和工程菌株JM109(DE3)/pET28a-neuA)耦合發(fā)酵高效合成CMP-Neu5Ac,對耦合發(fā)酵的條件進行了優(yōu)化。首先用單一工程菌株JM109(DE3)/pET28a-neuA,從其誘導溫度、工程菌株濃度、底物CTP和Neu5Ac濃度和工程菌株的循環(huán)利用次數(shù),進行了單因素催化條件優(yōu)化,結(jié)果如圖4所示。

a-誘導溫度;b-菌體濃度;c-底物CTP和Neu5Ac濃度;d-細胞重復使用次數(shù)圖4 不同因素對JM109(DE3)/pET28a-neuA合成CMP-Neu5Ac的影響Fig.4 The influence of different factors on the synthesis of CMP-Neu5Ac by JM109(DE3)/pET28a-neuA
由圖4-a可知,當細胞的誘導溫度是37 ℃時,CMP-Neu5Ac產(chǎn)量高于16和30 ℃時的產(chǎn)量,因此,選取37 ℃為最佳誘導溫度。
然后,以此優(yōu)化的催化發(fā)酵體系為基礎,探索菌體濃度對CMP-Neu5Ac合成的影響,結(jié)果如圖4-b所示。菌株質(zhì)量濃度為200和250 g/L時,其CMP-Neu5Ac在1 h時即達到最大值,隨著催化時間的增加,CMP-Neu5Ac被逐漸降解;當菌株質(zhì)量濃度為100和150 g/L時,其CMP-Neu5Ac的合成在2 h時達到最大數(shù)值,尤其是后者生成的CMP-Neu5Ac濃度最高,高達25.9 g/L,然后隨著時間的增加,CMP-Neu5Ac迅速降解;當菌株質(zhì)量濃度為50 g/L時,其CMP-Neu5Ac的合成先隨著時間的增加而增加,反應4 h時CMP-Neu5Ac達到最大值,為23.3 g/L,轉(zhuǎn)化率為63.2%,然后隨著時間的增加,合成的CMP-Neu5Ac濃度基本保持穩(wěn)定,維持在22 g/L。考慮到穩(wěn)定的CMP-Neu5Ac體系更有利于后續(xù)唾液酸乳糖合成,因此,選擇50 g/L JM109(DE3)/pET28a-neuA作為最優(yōu)菌株濃度。
在確定最優(yōu)誘導溫度和最優(yōu)細胞濃度的基礎上,又進一步研究了底物CTP和Neu5Ac濃度對CMP-Neu5Ac合成的影響,結(jié)果見圖4-c。在CTP和Neu5Ac濃度低于60 mmol/L時,CMP-Neu5Ac的產(chǎn)量逐漸上升,在60 mmol/L達到最高,但是隨著底物濃度的增加,CMP-Neu5Ac的產(chǎn)量逐漸下降,故選取CTP和Neu5Ac濃度為60 mmol/L為最優(yōu)濃度。
工程菌JM109(DE3)/pET28a-neuA是否具有重復使用性是工業(yè)應用中考慮的重要因素之一,對選擇分批發(fā)酵還是流加補料發(fā)酵策略具有重要指導意義。因此,按照此前優(yōu)化的條件,研究了工程菌株重復利用對CMP-Neu5Ac的影響,結(jié)果如圖4-d所示,以第1次的轉(zhuǎn)化率設定為100%計算,經(jīng)過5次重復使用后,工程菌株的CMP-Neu5Ac轉(zhuǎn)化率仍為第1次的47%。因此,工程菌株JM109(DE3)/pET28a-neuA既可以用于補料發(fā)酵,也可以用于分批發(fā)酵。
2.3.2 酵母和工程菌JM109(DE3)/pET28a-neuA耦合發(fā)酵合成CMP-Neu5Ac
為降低合成CMP-Neu5Ac的成本,進行了以CMP和Neu5Ac為底物,通過啤酒酵母和JM109(DE3)/pET28a-neuA耦合發(fā)酵來合成CMP-Neu5Ac。由圖5-a可知,經(jīng)耦合催化系統(tǒng)催化后,成功在發(fā)酵液中檢測到CMP-Neu5Ac。
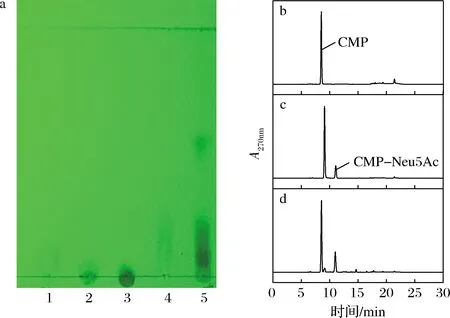
a-TLC圖;b-標品CMP液相圖;c-標品CMP-Neu5Ac液相圖; d-雙菌耦合催化產(chǎn)物液相圖 a:1-CMP;2-CDP;3-CTP;4-CMP-Neu5Ac;5-雙菌耦合催化產(chǎn)物圖5 CMP-Neu5Ac的檢測Fig.5 Determination of CMP-Neu5Ac
為進一步確定產(chǎn)物,采用HPLC對CMP、CMP-Neu5Ac標品和啤酒酵母與JM109(DE3)/pET28a-neuA耦合催化產(chǎn)物進行了分析,雙菌耦合催化產(chǎn)物的出峰時間與標準CMP-Neu5Ac相同(圖5-c和圖5-d),并且發(fā)酵液中CMP-Neu5Ac濃度為11.9 g/L。
2.4 唾液酸乳糖的耦合發(fā)酵合成體系建立
為實現(xiàn)“3菌株耦合發(fā)酵”策略的唾液酸乳糖合成,采用“單菌合成唾液酸乳糖—雙菌耦合發(fā)酵合成唾液酸乳糖—3菌耦合發(fā)酵合成3′-SL”的遞進思路來進行。
利用JM109(DE3)/pET28a-nst全細胞催化合成3′-SL,催化反應結(jié)束后,用SPE小柱純化,TLC分析純化前和純化后樣品,結(jié)果如圖6所示。

1-乳糖;2-3′-SL;3-純化前;4-純化后圖6 TLC檢測單菌催化產(chǎn)物Fig.6 Detection of the product producing from engineered bacteria fermentation with TLC
從圖6可以看出,發(fā)酵液中乳糖并沒有被利用完全,純化后組分(L4)與標準品3′-SL的比移值(retention factor value,Rf)相同。因此,單細胞存在的條件下,以CMP-Neu5Ac和乳糖為底物,可以合成3′-SL。
接著,進行了JM109(DE3)/pET28a-neuA和JM109(DE3)/pET28a-nst雙菌耦合發(fā)酵合成3′-SL的探索工作。雙菌催化結(jié)束后,上清液用SPE小柱純化,進行TLC檢測,結(jié)果如圖7所示。L3有與標準品3′-SLRf相同的寡糖存在,發(fā)酵液用SPE柱純化后的不同組分依次為L4、L5和L6,其中L6的Rf值與標準品3′-SL完全相同,但同時有乳糖的存在,這是因為80%(體積分數(shù))乙腈不僅能洗脫酸性寡糖,還能把中性寡糖洗脫下來,與PACKER等[20]研究結(jié)果一致。這表明以CTP、唾液酸和乳糖為底物,通過雙菌耦合發(fā)酵成功合成了3′-SL。

1-乳糖;2-3′-SL;3-純化前;4-流穿;5-水洗; 6-純化后;7-對照(CMP-Neu5Ac和乳糖混合)圖7 TLC檢測雙菌耦合催化產(chǎn)物Fig.7 Detection of the product producing from two strains coupling fermentation with TLC
為建立“3菌株耦合發(fā)酵”體系,合成3′-SL,在雙菌株耦合發(fā)酵成功合成3′-SL體系基礎上,添加了啤酒酵母,進行3菌混合發(fā)酵,而底物則用廉價的CMP替代價格昂貴的CTP。經(jīng)過30 h的發(fā)酵后,用TLC分析檢測,結(jié)果如圖8所示,發(fā)酵液(L3)中含有與標準品3′-SL相同Rf值的組份,這表明利用“3菌株耦合發(fā)酵體系”成功實現(xiàn)了3′-SL的合成。但是同時發(fā)酵液中殘留大量的乳糖,3′-SL轉(zhuǎn)化率不高,如何解決3′-SL轉(zhuǎn)化率不高問題成為下一步需要解決的問題。

1-乳糖;2-3′-SL;3-三菌耦合催化產(chǎn)物圖8 3菌耦合催化產(chǎn)物的TLC分析圖Fig.8 Detection of the product producing from three strains coupling fermentation with TLC
3 討論
本文通過廢啤酒酵母與JM109(DE3)/pET28a-neuA耦合發(fā)酵,實現(xiàn)了以CMP和Neu5Ac為底物,高效合成CMP-Neu5Ac的目的,在CTP充足的條件下,JM109(DE3)/pET28a-neuA經(jīng)過5個批次的分批發(fā)酵,其轉(zhuǎn)化率仍可達到第1次使用時的47%,唾液酸乳糖合成中,最為關鍵的是CMP-Neu5Ac的供給問題,本研究以啤酒酵母和JM109(DE3)/pET28a-neuA耦合,實現(xiàn)了CMP-Neu5Ac的高效再生和供給,尤其是JM109(DE3)/pET28a-neuA可重復使用特性對低成本合成CMP-Neu5Ac具有重要意義。
本研究利用“3菌耦合發(fā)酵體系”成功實現(xiàn)了3′-SL的合成。以往合成唾液酸乳糖主要采用酶法和單細胞法。酶法合成由于存在著酶提取純化工藝,增加了生產(chǎn)成本;而單細胞合成由于存在代謝負擔和代謝壓力,新的合成途徑的引入可能會打破宿主原有的物質(zhì)能量代謝平衡等問題,產(chǎn)量相對較低。本研究針對自然界的共生互利現(xiàn)象,建立了耦合發(fā)酵體系,實現(xiàn)了唾液酸乳糖的合成,為唾液酸乳糖的大規(guī)模、廉價合成提供了可能。

