苦參-地榆治療潰瘍性結腸炎活性成分和潛在靶點的網絡藥理學
王迪 劉路路 史學文
摘要 目的:基于網絡藥理學預測苦參-地榆治療潰瘍性結腸炎(UC)的作用機制。方法:通過中藥系統藥理學數據庫與分析平臺(TCMSP)中藥數據庫檢索苦參-地榆藥對的化學成分和靶基因,以口服生物利用度(OB)>30%和類藥性(DL)>0.18為條件篩選藥對的潛在有效成分,并通過TCMSP預測藥對的潛在靶點。運用Uniprot數據庫尋找到潛在靶點相對應的人類基因名稱,通過Genecards、OMIM數據庫檢索潰瘍性結腸炎的疾病靶點,與藥對的潛在靶點相映射,繪制韋恩圖,將映射找到的有效成分的靶基因導入Cytoscape3.7.2構建藥物-成分-疾病-靶點網絡圖。利用STRING數據庫構建蛋白質-蛋白質相互作用(PPI)網絡圖選出核心靶標,最后將苦參-地榆藥對治療潰瘍性結腸炎的有效靶點進行基因本體(GO)富集分析和京都基因和基因組百科全書(KEGG)富集分析。結果:共獲得苦參-地榆藥對27個有效成分和74個有效靶點。GO富集分析結果顯示90個生物過程,主要與DNA結合和蛋白質或輔助因子結合等相關;KEGG通路富集結果顯示115條通路,主要包括PI3K-AKT信號通路、癌癥通路等。結論:苦參-地榆藥對多種活性成分作用于多靶點、多途徑、多通路協同發揮治療UC。
關鍵詞 網絡藥理學;苦參;地榆;潰瘍性結腸炎;作用機制;成分;靶點;通路
Evaluation of the Active Ingredients and Potential Targets of Radix Sophorae Flavescentis-Radix Sanguisorbae in the Treatment of Ulcerative Colitis with a Network Pharmacology Approach
WANG Di1,LIU Lulu1,SHI Xuewen2
(1 Shandong University of Traditional Chinese Medicine,Ji′nan 250014,China; 2 The Affiliated Hospital of Shandong University of Traditional Chinese Medicine,Ji′nan 250014,China)
Abstract Objective:To predict the mechanism of treatment of ulcerative colitis(UC)with Radix Sophorae Flavescentis-Radix Sanguisorbae Based on network pharmacology.Methods:Chemical composition and target genes of the Radix Sophorae Flavescentis-Radix Sanguisorbae drug pair were searched through the TCMSP database of traditional Chinese medicines(TCM),and the potential active ingredients of the drug pair were screened under the condition of bioavailability(OB)>30% and drug-like properties(DL)>0.18.The TCMSP database was used to predict potential targets for the drug pair.Uniprot database was used to find the name of the human gene corresponding to the potential target.The disease target of UC were retrieved through Genecards and OMIM database,and was then mapped to the potential target of the drug pair into a Wayne diagram.The target gene of the component is introduced into Cytoscape 3.7.2 to construct the drug-component-disease-target network diagram.The STRING database was used to construct a PPI protein interaction network diagram to select the core target.Finally,the Radix Sophorae Flavescentis-Radix Sanguisorbae drug pair was used for GO analysis and KEGG analysis of effective targets for the treatment of ulcerative colitis.Results:A total of 27 active ingredients and 74 effective targets were obtained from the Radix Sophorae Flavescentis-Radix Sanguisorbae drug pair.GO enrichment analysis results showed a total of 90 biological processes,mainly related to DNA binding and protein or cofactor binding; KEGG pathway enrichment results showed totally 115 pathways,including PI3K-AKT signaling pathway and cancer pathway.Conclusion:Radix Sophorae Flavescentis-Radix Sanguisorbae drug pair can act on multiple targets,multiple channels,and multiple pathways to treat UC in a variety of active ingredients.This study provides a theoretical reference for further research on the mechanism of action of Radix Sophorae Flavescentis-Radix Sanguisorbae drug pair on UC clinical treatment.
Keywords Network pharmacology; Radix Sophorae Flavescentis; Radix Sanguisorbae; Ulcerative colitis; Mechanism of action; Component; Target; Pathway
中圖分類號:R282;R573文獻標識碼:Adoi:10.3969/j.issn.1673-7202.2021.16.007
潰瘍性結腸炎(Ulcerative Colitis,UC)是以腹瀉、黏液膿血便、腹痛和里急后重為主要癥狀的慢性非特異性腸道炎性疾病[1]。特征為腸黏膜炎癥復發與緩解交替,從直腸開始并延伸至近端結腸[2]。對于輕度至中度UC的治療,通常使用口服或直腸給予5-氨基水楊酸制劑;治療中至重度結腸炎的藥物類別包括硫嘌呤、靶向腫瘤壞死因子制劑和整聯蛋白類生物制劑以及小分子Janus激酶抑制劑。但面臨不良反應多、服藥周期長、經濟負擔重等問題[3-4]。中醫中藥治療UC在緩解臨床癥狀、抗炎、促進腸道黏膜修復、調節機體免疫力、防止復發等方面有明顯的優勢[5]。UC在中醫學屬“腸澼”“泄瀉”“久痢”等范疇[6]。基本病機為濕熱蘊腸、氣滯絡瘀,脾虛失健為主要發病基礎,飲食不調是主要發病誘因。中醫學將UC分為6個主要證型,其中以大腸濕熱證最為常見[7]。
苦參-地榆藥對是導師史學文教授治療UC大腸濕熱證的常用藥對,為治療UC經驗方圣瑜方中的君藥,在改善患者臨床癥狀、改善腸道菌群,促進腸黏膜修復方面取得良好的療效。方中苦參味苦、性寒,歸心、肝、胃、大腸、膀胱經,可清熱燥濕、殺蟲、利尿,用于治療熱痢、便血。《名醫別錄》記載:“養肝膽氣,定志益精,利九竅,除伏熱腸澼……令人嗜食。”地榆味苦酸,性寒,歸肝、肺、腎和大腸經,具有涼血止血、清熱解毒、收斂止瀉之功效。兩藥合用,共奏清熱祛濕之功。有研究顯示,復方苦參湯在治療UC方面取得良好療效,方中多見苦參與地榆的配伍[8-9]。然而苦參-地榆藥對復雜的化學成分使其難以明確其治療UC的具體作用機制。現采用網絡藥理學方法,通過挖掘苦參-地榆藥對的活性成分,預測其作用機制。
1 資料與方法
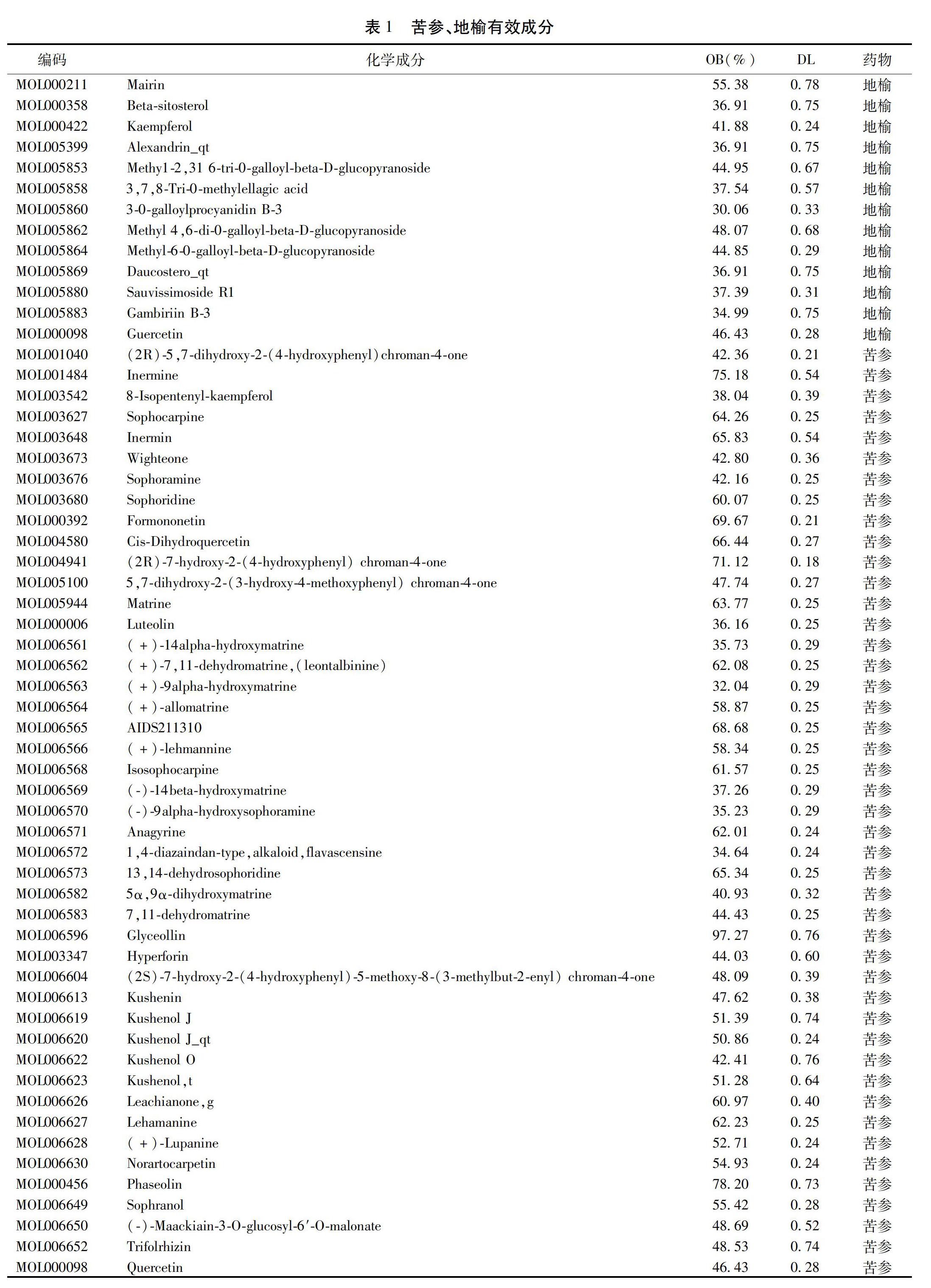
1.1 藥物潛在有效成分的獲取 分別使用苦參、地榆為關鍵詞,在中藥系統藥理學數據庫與分析平臺(Traditional Chinese Medicines Integrated Database,TCMSP http://lsp.nwu.edu.cn/)搜索,獲得苦參和地榆所有的化學信息,通過參考文獻中的多個標準,將口服生物利用度(OB)>30%和類藥性(DL)>0.18為條件[10],篩選出苦參和地榆的有效活性成分。
1.2 藥物潛在靶基因的獲取 通過TCMSP檢索苦參和地榆的所有活性成分的靶點,并與已得到的有效活性成分相映射,獲得潛在靶點,利用Perl(http://www.Perl.org/)和UniProt數據庫(http://www.UniProt.org/)將靶蛋白名轉化為基因名。
1.3 UC疾病靶點的獲取 為了揭示可能與疾病有關的基因,使用“Ulcerative colitis作為關鍵詞,在GeneCards數據庫(https://www.genecards.org/)及OMIM數據庫(https://omim.org/)搜索,獲得UC的所有相關基因及靶點蛋白。所有的數據庫都不斷更新著人類基因和基因疾病的信息,提供一個相對全面的研究結果。從搜索結果中刪除重復的靶基因,并導出到Excel,為后續處理做準備。
1.4 藥物疾病靶點韋恩圖的繪制 利用R x64 4.0.0軟件并輸入命令代碼,在R中安裝繪制韋恩圖的工具包。將已獲得的藥物活性成分和疾病靶點導入,在R中輸入了特定的命令代碼,從而生成韋恩圖和體現具體分析結果的文本,文本將用于后續處理。通過韋恩圖可以更加直觀地看出,苦參-地榆藥對是通過多基因、多靶點來治療潰瘍性結腸炎。
1.5 藥物-成分-疾病-靶點網絡構建 將藥物疾病的共同靶點與藥物的有效活性成分相映射,得到苦參-地榆有效成分治療UC的靶點。將得到的靶點數據及苦參、地榆成分名稱和UC名稱導入Cytoscape3.7.2軟件,獲得藥物-成分-疾病-靶點(M-I-D-T)網絡圖。
1.6 核心靶標蛋白質-蛋白質相互作用(PPI)網絡構建 將藥對和疾病的共同靶點導入STRING數據庫(https://string-db.org/),并限定物種為人類物種(Homo sapiens),該數據庫是一個蛋白質-蛋白質相互作用(Protein-Protein Interaction,PPI)數據庫,可以搜索已知蛋白質并預測PPI[11]。檢索研究相關文獻,為確保可信度,將交互分數限定為>0.90,去除無相互作用的單一蛋白,獲得最終的PPI網絡圖,導出圖片并以TSV格式保存結果,利用R x64 4.0.0軟件,將結果挑選出前30名核心靶標,并繪制柱狀圖。
1.7 基因本體(GO)富集分析和京都基因和基因組百科全書(KEGG)富集分析 Biocounductor(http://www.bioconductor.org/)為高通量基因組數據的分析和解釋提供工具,它使用編程軟件R,是一個開源和開放式開發軟件[12]。在R包的幫助下,成功地安裝了這個分析工具,然后運行代碼。對藥物和疾病的共同靶點基因進行基因本體(Gene Ontology,GO)富集分析和京都基因和基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析(以P≤0.05為篩選標準)。通過計算得分,選出了前20名進行展示。
2 結果
2.1 潛在有效成分篩選結果 通過TCMSP收集到苦參113個化學成分,地榆41個化學成分,共154個化學成分。設定上述過濾條件后共獲得有效成分58個,其中苦參45個,如苦參堿、槐果堿、福莫尼汀、順二氫槲皮素、醋胺、木犀草素等,地榆13個,如β-西他固醇、山柰酚、槲皮素、三七皂苷等。見表1。
2.2 藥物疾病靶基因結果與韋恩圖的繪制 在獲得的苦參-地榆58個有效成分中,通過Uniprot數據庫共找到人類相關靶點759個,通過GeneCards數據庫及OMIM數據庫共找到UC潛在靶點4 357個,利用R x64 3.6.2軟件取二者交集,得到藥物與疾病的共同靶點74個,并繪制韋恩圖。見圖1。
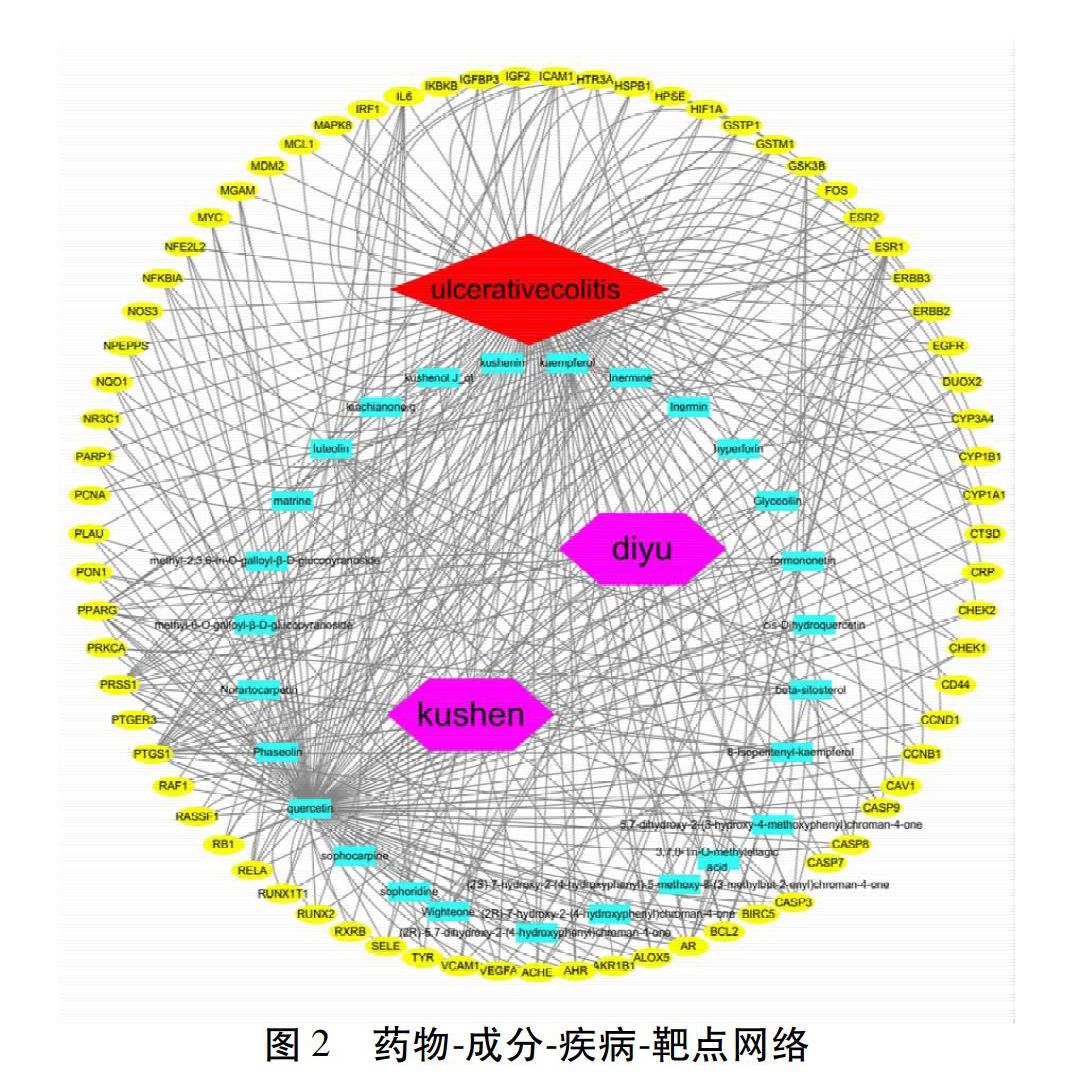
2.3 藥物-成分-疾病-靶點網絡構建 通過映射共獲得苦參-地榆治療UC的有效成分27個,將有效成分和共同靶點導入Cytoscape3.7.2軟件,獲得苦參-地榆治療UC的“藥物-成分-疾病-靶點”網絡。見圖2。圖中共有103個節點,344條邊,節點包括藥物、疾病、成分、靶點,邊則表示其之間存在相互關系,紅色菱形代表疾病,紫色六邊形代表藥物,藍色長方形代表活性成分,黃色橢圓形代表靶點基因。通過此網絡直觀的看出苦參-地榆藥對治療UC是通過多種成分、多種靶點來發揮作用。其中槲皮素、木犀草素、山柰酚、福莫尼汀的自由度值分別是118、24、22、11,說明這些成分與疾病相關度較高。
2.4 PPI網絡圖與核心靶標柱狀圖 利用STRING數據庫獲得蛋白互作網絡。見圖3。圖中共有74個節點,143條邊,節點代表蛋白,平均節點度3.86,節點代表靶標蛋白,邊表示蛋白質與蛋白質之間的關系。淺藍色邊代表來自管理的數據庫,紫色邊代表實驗測定,綠色邊代表基因相鄰,紅色邊代表基因融合,深藍色邊代表基因共現,黃色邊代表文本挖掘,黑色邊代表共表達,淡藍色邊代表蛋白質同源性。利用R軟件挑選出前30位核心靶標并繪制柱狀圖。如ESR1、RELA、CCND1、EGFR、Fos、MAPK8、NR3C1、CASP3、IL6、RB1、AR等,提示這些靶標可能在苦參-地榆治療UC中發揮重要作用。見圖4。
2.5 GO分析與KEGG通路分析 為了更全面、更具體地闡明苦參-地榆活性成分對UC的影響,利用ClusterProfiler對成分-疾病-靶網絡中74個常見靶點進行了GO富集分析。共得到90個生物過程,確定前20個富集GO項,以條形圖顯示(設定P≤0.05分)。見圖5。如泛素樣蛋白連接酶結合(GO:0044389)、DNA結合轉錄激活活性,RNA聚合酶Ⅱ特異性(GO:0001228)、泛素蛋白連接酶結合(GO:0031625)、RNA聚合酶Ⅱ轉錄因子結合(GO:0001085)、核受體活動(GO:0004879)、轉錄因子活性,直接配體調節的序列特異性DNA結合(GO:0098531)、類固醇激素受體(GO:0003707)等生物過程。同時,氣泡圖顯示一個生物過程中所涉及的目標基因數與所有注釋基因數的基因比率。比值越高,富集程度越高。點的大小反映了分析中目標基因的數量,點的不同顏色表示不同的P調整值范圍(設定P≤0.05)。見圖6。
為了闡明74個潛在靶點治療UC的關鍵途徑,進行KEGG通路富集分析(設定P≤0.05),共得到115條通路,選取前20條繪制柱狀圖和氣泡圖。見圖7、圖8。如PI3K-AKT信號通路、卡波西肉瘤相關皰疹病毒感染通路(hsa05167)、癌癥中的蛋白多糖通路(hsa05205)、人巨細胞病毒感染通路(hsa05163)、癌癥中的microRNAs通路(hsa05206)、乙型肝炎通路(Bhsa05161)、前列腺癌通路(hsa05215)、細胞凋亡通路(hsa04210)等,結果顯示苦參-地榆藥對治療UC與多種通路密切相關。
3 討論
UC的發病具有多基因聯合的復雜遺傳背景,基因多態性和異質性與其易感性聯系密切。再加上環境、心理等多因素共同作用,導致黏膜屏障功能受損,上皮細胞通透性改變,腸道菌群紊亂,神經內分泌調節異常,代謝產物破壞腸黏膜,引起或加重腸黏膜炎癥反應,導致UC的發生[13]。苦參及復方制劑的多成分、多靶點、多功能、多通路在治療UC方面顯示出無可比擬的優勢[14]。
本研究基于現代藥理研究與網絡藥理學平臺探討苦參-地榆藥對治療UC的作用機制,共收集到27種有效成分。槲皮素與山柰酚均屬于黃酮類化合物,研究證實,山柰酚具有很好的抗炎活性,口服山柰酚可以有效抑制某些與UC相關的標志物[15]。槲皮素能抑制體內過氧化物的生成,有效清除體內的自由基,提高抗氧化能力,改善腸道菌群多樣性[16]。李欽等[17]發現槲皮素可以抑制醋酸誘導的UC小鼠腹腔毛細血管通透性增加,證明其在非特異性炎癥反應的急性時期即可發揮抗炎功效,并通過抗氧自由基獲得鎮痛作用。木犀草素可以抑制炎性浸潤、滲出和組織增生,減輕腸黏膜的病理損害[18]。李越[19]證實木犀草素可激活Nrf2信號通路,抑制炎癥介質TNF-α,IL-6mRNA表達,增強結腸抗氧化活性。楊倩等[20]研究發現,刺芒柄花素(Formononetin)可通過激活Nrf2的表達,抑制炎癥介質TNF-α,IL-6,改善結腸組織氧化壓力參數,降低UC的發生。苦參堿對UC和肺部損傷具有很好的保護作用,可能與調節TFF3表達有關[21]。苦參堿能明顯抵抗UC的炎癥反應,增強機體免疫,通過調節腸黏膜細胞因子平衡,抑制黏膜細胞氧自由基的產生和抗氧化功能干預UC的發病并降低腫瘤的發生率[22-23]。
藥物-成分-疾病-靶點網絡圖的構建,可直觀感受到苦參-地榆藥對治療UC是通過多成分、多靶點發揮作用。在PPI網絡圖中可以看到靶點間有多種相互作用,連接度越大,表明藥物通過該靶點治療UC的可能性越大。PPI網絡中按度值排名可發現ESR1、RELA、CCND1、EGFR、FOS、MAPK8等是治療UC的關鍵靶點。ESR1,核激素受體,類固醇激素及其受體參與真核基因表達的調節,并影響靶組織中的細胞增殖和分化。現代研究證明,在UC患者中,炎癥活動性黏膜ESR1甲基化程度升高,且參與了UC的致癌作用[24]。RELA(核因子κB,P65)是信號通路核因子κB中的一員。核因子κB是一種幾乎所有細胞類型中都存在的多效轉錄因子,涉及細胞的轉化、增殖和凋亡,參與調節多種炎癥反應和免疫基因的轉錄和表達[25]。在UC患者中可以觀察到核因子κB的表達增加,特別是在黏膜巨噬細胞和上皮細胞中,同時還伴有炎癥介質TNF-α,IL-6的增加[26]。CCND1在調節細胞增殖中起重要作用,研究表明,結腸癌患者CCND1表達顯著升高,進而影響結腸癌細胞SW620的遷移和增殖[27]。表皮生長因子受體(EGFR)是酪氨酸激酶家族中的一員,通過其配體表皮生長因子(Epidermal Growth Factor,EGF)的激活,調節細胞的增殖、黏附、運動、蛋白水解酶的分泌等[28]。研究表明,EGFR在非活動期UC患者結腸黏膜中的表達較活動期UC患者和對照組明顯增加。EGFR在UC患者結腸炎癥黏膜修復過程中可能起一定作用,過度不恰當的表達可能在細胞的惡性轉化中起作用,促進潰瘍性結腸炎相關性結直腸癌的發生[29-30]。MAPK8是MAPK信號轉導途經中重要的信號分子,其功能涉及細胞增殖、細胞分化和細胞凋亡等各種機制。研究表明UC大鼠MAPK8的表達增加,與其參與細胞凋亡過程有關[31]。
GO功能分析發現苦參-地榆治療UC重要的生物過程包括DNA結合和蛋白質或輔助因子結合。通過這些生物過程,藥物作用于相關靶位,從而影響相關信號通路以發揮藥效。通過KEGG通路分析,苦參-地榆主要通過某些癌癥、疾病、腫瘤壞死因子信號通路和壓力信號通路發揮作用。最近的研究表明,免疫反應紊亂與炎癥介質和抗炎細胞因子之間的表達失衡有關。細胞因子的表達和分泌與PI3K-AKT信號通路密切相關。研究表明,免疫細胞如中性粒細胞激活PI3K-AKT信號通路,致PI3K、磷酸化AKT和AKT高表達,磷酸化AKT(p-AKT)可以通過增強IjB(主要是IjBa)的磷酸化和減少IjB的合成來激活NF-jB。NF-jB的激活促進了TNF-α、IL-1β等炎癥介質的表達和分泌,導致細胞因子分泌失衡,引起一系列炎癥反應和黏膜損傷的發生,從而導致UC的發生[32]。苦參-地榆藥對治療UC可能是有效成分作用于PI3K-AKT信號通路,進一步干預通路中核因子κB轉錄,進而影響下游RELA(核因子κB,P65)的表達。
本研究初步探討了苦參-地榆藥對通過多成分、多靶點、多通路治療UC的機制,與現有的研究結果基本一致,但仍有部分功能和信號通路需要進一步實驗證實。本研究借助網絡藥理學進行預測性探討,為苦參-地榆藥對治療UC提供理論支持。
參考文獻
[1]Di Sabatino A,Biancheri P,Rovedatti L,et al.Recent advances in understanding ulcerative colitis[J].Intern Emerg Med,2012,7(2):103-111.
[2]劉志龍,趙佩,高進賢,等.鐵皮石斛提取物對DSS誘導的潰瘍性結腸炎小鼠的抗氧化及抗炎作用[J].中國新藥雜志,2019,28(2):214-220.
[3]Ordás I,Eckmann L,Talamini M,et al.Ulcerative Colitis[J].Lancet,2012,380(9853):1606-1619.
[4]Cohen RD,Yu AP,Wu EQ,et al.Systematic review:the costs of ulcerative colitis in Western countries[J].Aliment Pharmacol Ther,2010,31(7):693-707.
[5]趙振營,李亞卓,于飛,等.潰瘍性結腸炎中藥組方規律及整合藥理學分子機制探索[J].中草藥,2018,49(13):3042-3050.
[6]甄建華,黃光瑞.潰瘍性結腸炎中醫病名、病因、病機的古今比較和回顧[J].環球中醫藥,2019,12(8):1286-1289.
[7]中華中醫藥學會脾胃病分會.潰瘍性結腸炎中醫診療專家共識意見(2017)[J].中華中醫藥雜志,2017,32(8):3585-3589.
[8]仝戰旗,楊波,童新元,等.復方苦參結腸溶膠囊治療濕熱內蘊型潰瘍性結腸炎多中心、隨機、雙盲、對照研究[J].中國中西醫結合雜志,2011,31(2):172-176.
[9]徐萌.復方苦參湯治療潰瘍性結腸炎的臨床和實驗研究[C].中國中西醫結合學會基礎理論專業委員會.第十四屆中國中西醫結合基礎理論學術年會,中國中西醫結合學會基礎理論專業委員會,中國中西醫結合學會,天津:2018.
[10]屈映,張書信,周璐,等.荊芥、防風治療潰瘍性結腸炎的網絡藥理學研究[J].中國中藥雜志,2019,44(24):5465-5472.
[11]Szklarczyk D,Morris JH,Cook H,et al.The STRING database in 2017:quality-controlled protein-protein association networks,made broadly accessible[J].Nucleic Acids Res,2017,45(D1):D362-D368.
[12]Stanstrup J,Broeckling CD,Helmus R,et al.The metaRbolomics Toolbox in Bioconductor and beyond[J].Metabolites,2019,9(10):200.
[13]甄建華,黃光瑞.潰瘍性結腸炎病因和發病機制的現代醫學研究進展[J].世界華人消化雜志,2019,27(4):245-251.
[14]李鵬帆,羅月,張玉麗,等.苦參及其復方治療潰瘍性結腸炎的作用機制研究進展[J].世界中醫藥,2020,16(6):945-948.
[15]Park MY,Ji GE,Sung MK.Dietary kaempferol suppresses inflammation of dextran sulfate sodium-induced colitis in mice[J].Dig Dis Sci,2012,57(2):355-363.
[16]黃思瑩,黃春萍,劉旭,等.桑葉槲皮素對D-半乳糖致衰老小鼠抗氧化能力及腸道菌群的影響[J].四川師范大學學報:自然科學版,2020,43(3):373-377.
[17]李欽,鄭曉亮,陳愛君,等.槲皮苷防治潰瘍性結腸炎的藥效學研究[J].中國現代應用藥學,2009,26(3):180-184.
[18]周祝成,劉保林,吳巍巍.木樨草素對小鼠實驗性潰瘍性腸炎影響[J].中國臨床藥理學與治療學,2005,10(10):1152-1155.
[19]李越.木犀草素對葡聚硫酸鈉誘導的小鼠實驗性結腸炎的防治作用[D].武漢:武漢大學,2017.
[20]楊倩,陳剛,楊洋,等.刺芒柄花素通過誘導Nrf2表達緩解DSS誘導的小鼠潰瘍性結腸炎[J].中國藥學(英文版),2016,25(3):178-188.
[21]Yan X,Lu QG,Zeng L,et al.Synergistic protection of astragalus polysaccharides and matrine against ulcerative colitis and associated lung injury in rats[J].World J Gastroenterol,2020,26(1):55-69.
[22]鐘振東,熊永愛,楊玲.苦參堿對潰瘍性結腸炎大鼠腸黏膜細胞因子和自由基的影響[J].中國醫藥生物技術,2011,6(4):251-254.
[23]張慶,茹慶國,劉艷,等.苦參堿與氧化苦參堿對炎癥相關結直腸癌的化學預防作用研究[J].中草藥,2016,47(9):1548-1553.
[24]Saito S,Kato J,Hiraoka S,et al.DNA methylation of colon mucosa in ulcerative colitis patients:correlation with inflammatory status[J].Inflamm Bowel Dis,2011,17(9):1955-1965.
[25]紀桂賢,王邦茂,鄭岳.NF-κB在潰瘍性結腸炎中的意義[J].中國誤診學雜志,2011,11(27):6581-6582.
[26]孫偉東,張志強,樸大勛.NF-κB信號通路抑制結腸炎及炎癥相關結腸癌的研究[J].醫學綜述,2020,26(8):1521-1525.
[27]王秋爽,王琦,孫華文,等.microRNA-138通過靶向作用于CCND1抑制結腸癌細胞增殖[J].臨床和實驗醫學雜志,2020,19(7):733-737.
[28]王囡囡,陳遠能.EGF、EGFR及β-catenin在潰瘍性結腸炎相關癌變中作用的研究進展[J].中國醫藥指南,2014,12(36):47-48.
[29]表皮生長因子受體在潰瘍性結腸炎結腸黏膜修復中的作用[J].中國臨床康復,2005,9(34):104-106.
[30]呂冠華,包永欣,孫希良,等.中藥潰結方對難治性潰瘍性結腸炎患者腸黏膜EGFR、MUC2表達的影響[J].中華中醫藥學刊,2017,35(8):2128-2130.
[31]許雅清,李海龍,邱家權,等.痛瀉二草方對肝郁脾虛型潰瘍性結腸炎大鼠相關基因的影響[J].中醫臨床研究,2016,8(8):3-7.
[32]Huang XL,Xu J,Zhang XH,et al.PI3K/Akt signaling pathway is involved in the pathogenesis of ulcerative colitis[J].Inflamm Res,2011,60(8):727-734.
(2020-05-24收稿 責任編輯:楊覺雄)

