不同種類的脂肪酸對肝細胞脂質堆積的研究
尹震 張曉琳 田金英 姜楠 李雪晨 葉菲


摘 要:目的:比較不同種類的脂肪酸對人肝癌細胞(HepG2)脂質堆積的影響。方法:HepG2細胞隨機分為對照組(Con)、棕櫚酸組(PA)、油酸組(OA)、亞油酸組(LA)和亞麻酸組(ALA)。培養24 h后,以MTT法比較不同種類脂肪酸對肝細胞存活率的影響;同一濃度下,以油紅O染色法比較,各組細胞內脂滴生成情況拍照并測量吸光度;以酶學法檢測各組細胞內甘油三酯含量比較不同種類脂肪酸對肝細胞脂質堆積的影響。結果:確定了每種脂肪酸誘導的濃度為50 μmol/L,同一濃度下,隨著PA、OA、LA、ALA各組脂肪酸的不飽和度依次增加,PA、OA、LA、ALA各組細胞內脂滴依次增多,細胞內TG含量依次升高。與對照組相比,PA無統計學差異,OA存在顯著性差異(P<0.05),而LA和ALA分別存在極顯著性差異(P<0.001)。且對每種脂肪酸誘導的肝細胞脂質堆積程度進行統計學分析,均存在顯著性差異(P<0.05)。結論:同一條件下,不同種類的脂肪酸對肝細胞活力和脂質堆積程度的影響不同,提示可能與脂肪酸的不飽和度有關,不飽和度越高的脂肪酸對細胞脂質堆積作用越明顯。
關鍵詞:脂肪酸;肝細胞;細胞活力;脂質堆積
非酒精性脂肪性肝病(NAFLD)是指無明確過量飲酒史和其他致病因素,以肝臟內脂肪過度堆積為主要特征的臨床病理綜合征,其疾病譜包括單純性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)、纖維化、肝硬化和肝癌[1]。在發達國家,NAFLD 的發病率已達到 20%~30%,在發展中國家,NAFLD 的發病率也在逐漸上升[2]。隨著人們生活方式、膳食結構的改變,NAFLD 已成為世界范圍內常見的慢性疾病之一。目前,對NAFLD 的治療尚無良好的藥物,在其NAFL 階段多采用控制飲食、增加運動的方法,發展到NASH 階段多以保肝類藥物和對癥治療為主,均不能滿足廣大患者的需求。NAFLD 的主要病因是胰島素抵抗等因素引起肝臟脂代謝紊亂,脂類尤其是甘油三酯(TG)在肝臟的堆積。當肝臟 TG 的含量超過肝重的5%時,便認為NAFLD發生[3]。
膳食脂肪酸攝入過多是導致體內脂代謝失衡的首要原因[4]。脂肪酸,是指一端含有一個羧基的長的脂肪族碳氫鏈的有機物,根據碳鏈中碳原子間雙鍵的數目可將脂肪酸分為飽和脂肪酸(SFA)(不含雙鍵)、單不飽和脂肪酸(MUFA)(含1個雙鍵)和多不飽和脂肪酸(PUFA)(含1個以上雙鍵)三類[5]。當機體處于肥胖、2 型糖尿病等代謝異常狀態下,肝臟的脂質輸入和輸出的平衡被打破,最終導致肝臟內脂質的堆積和脂肪肝的形成[6]。因此,NAFLD 的防治策略中,抑制脂肪在肝臟中的堆積顯得尤為重要。
脂肪酸主要在肝臟內代謝,然而在生理條件下獲得人肝臟細胞非常困難,且正常人肝臟細胞個體差異大,難于穩定地傳代培養,因此不利于長期研究肝臟脂質代謝。人肝癌細胞株HepG2是目前常用的研究體外脂代謝細胞模型[7]。應用外源性脂肪酸誘導肝細胞形成脂質堆積模型,從而進行降脂藥物的體外篩選及其作用機制的研究。
有軟脂酸又稱棕櫚酸,是一種飽和高級脂肪酸,以甘油酯的形式廣泛存在于各種油脂中,是細胞膜的重要組成成分,可誘導肝細胞形成胰島素抵抗模型。油酸為MUFA中最為代表性的一種脂肪酸,廣泛存在于動物脂肪和植物油中,在魚油、棕櫚油、橄欖油等中含量較高。PUFA中的亞油酸和α-亞麻酸在體內不能自身合成,需由食物提供,所以這些脂肪酸又稱為必需脂肪酸[8]。研究表明,膳食脂肪攝入過多、膳食脂肪酸不平衡等是導致脂肪肝的主要危險因素[9-10]。眾所周知,不同種類脂肪酸對肝細胞脂質堆積的影響不同[11],但目前為止,未有各種脂肪酸對肝細胞HepG2的作用進行系統的研究。尤其是針對不飽和程度不同的脂肪酸在肝細胞脂質堆積形成過程中的作用鮮見報道。不同種類的脂肪酸對肝細胞脂質堆積產生不同影響的原因是否和脂肪酸本身的不飽和程度有關,是一個值得研究的課題。故本研究采用具有代表性的棕櫚酸(PA,飽和脂肪酸)、油酸(OA,單不飽和脂肪酸)、亞油酸(LA,多不飽和脂肪酸,含2個雙鍵)、α-亞麻酸(ALA,多不飽和脂肪酸,含3個雙鍵)分別刺激HepG2細胞,比較了不飽和度不同的脂肪酸對肝細胞脂質堆積的影響。
1 材料與方法
1.1 材料
HepG2細胞株,中國醫學科學院基礎醫學研究所細胞資源中心;胎牛血清(FBS)、二甲基亞砜(DMSO)、MEM培養基,Gibco公司;PA、OA、LA、ALA、脫脂牛血清白蛋白(BSA)、油紅O染液,美國Sigma公司;四甲基偶氮唑鹽(MTT),Amresco公司;TG 測定試劑盒,北京普利萊基因生物技術公司。
酶標儀μ-Quant,美國BIO-TEK公司;磁力攪拌器,德國IKA公司;THZ-C型全溫空氣恒溫振蕩器,太倉科教儀器廠;高速低溫離心機,德國Heraus公司;電子天平,德國賽多利斯公司;超低溫冰箱,日本SANYO公司。
1.2 方法
1.2.1 細胞培養 人HepG2肝癌細胞株,接種于25 cm2培養瓶,用含10%胎牛血清的MEM高糖培養基,37℃(5%CO2)細胞培養箱內培養,待細胞生長至80%~90%密度時用胰蛋白酶消化,按1∶3比例傳代。
1.2.2 脂肪酸儲備液的配置(10 mmol/L) 準確稱取4種脂肪酸,分別溶解到含5%BSA的PBS緩沖液中,使每種脂肪酸的終濃度為10 mmol/L,充分攪拌,在70℃的水浴鍋中加熱10 min,過濾除菌,4℃保存。
1.2.3 細胞存活率測定 實驗分為5組,對照組(Con)添加與脂肪酸組終濃度相同的BSA作溶劑對照,PA、OA、LA和ALA。將對數期生長的細胞經胰酶消化成單個細胞,接種96孔板,每孔接種2×104個細胞。細胞正常培養24 h,棄上清,PBS潤洗,每個濃度設置4個復孔,各組加入終濃度為1、10、50、100、150、200、250 μmol/L不同種類的脂肪酸分別處理HepG2細胞24 h。MTT法測定細胞存活率:
細胞存活率(%)=實驗組OD值/空白組OD值×100%(1)
1.2.4 油紅O染色 實驗分為5組,Con添加與脂肪酸組終濃度相同的BSA作溶劑對照,PA、OA、LA和ALA。將對數期生長的細胞經胰酶消化成單個細胞,接種96孔板,每孔接種2×104個細胞。細胞正常培養24 h,棄上清,PBS潤洗,每個濃度設置3個復孔,終濃度為50 μmol/L不同種類的脂肪酸處理細胞24 h之后,棄上清,PBS洗滌2遍,用4%多聚甲醛固定10 min,0.5%油紅O染液室溫染色15 min,60%異丙醇漂洗30 s,蒸餾水洗30 s至背景透明。于倒置顯微鏡下拍照觀察細胞內脂滴形成情況后,用異丙醇提取,在510 nm處測定吸光度值,吸光度值直接反映細胞內紅色脂滴的多少進一步評價脂質堆積程度[12]。
1.2.5 胞內甘油三酯(TG)含量的測定 將對數期生長的細胞經胰酶消化成單個細胞,接種6孔板,每孔接種2×105個細胞。細胞正常培養24 h,棄上清,PBS潤洗,實驗分為5組,Con、PA、OA、LA、ALA,每個濃度設置4個復孔,Con添加與脂肪酸組終濃度相同的BSA作溶劑對照,其余每組加入終濃度為50 μmol/L的脂肪酸分別處理HepG2細胞24 h,收取細胞后用試劑盒測定細胞內TG含量,結果用蛋白濃度校準。
1.2.6 統計學分析 各組數據以(±s)表示,采用Prism 5統計軟件。所有數據通過t檢驗的方法進行統計學分析,P<0.05表示差異有統計學意義。
2 結果與分析
2.1 不同種類脂肪酸對肝細胞存活率的影響
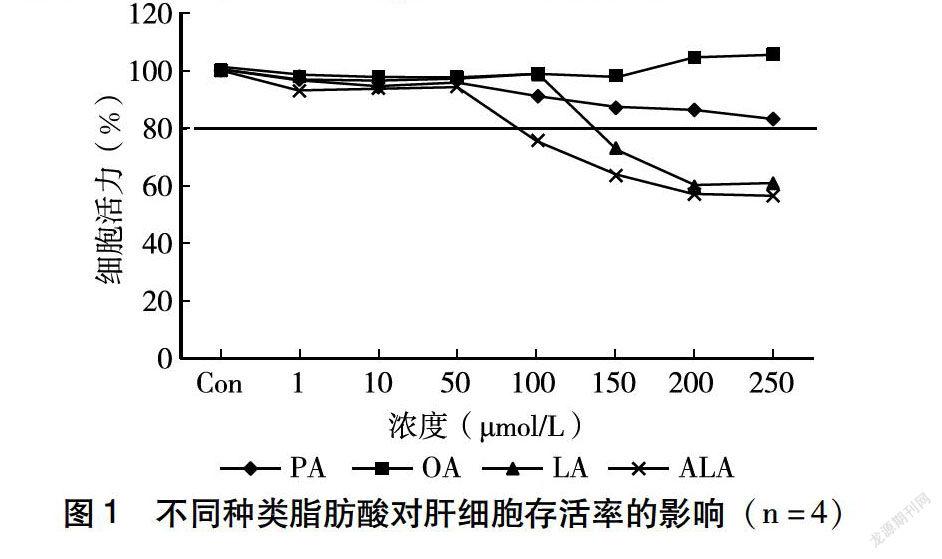
為了評估4種脂肪酸對HepG2的細胞毒作用,用MTT法測定了不同濃度的4種脂肪酸分別對肝細胞存活率的影響。如圖1所示,終濃度為1~250 μmol/L不同種類的脂肪酸分別處理HepG2細胞,PA隨著濃度的升高,細胞存活率降低,但均高于80%;OA隨著濃度的升高,細胞存活率均高于80%;LA當濃度為150~250 μmol/L時,細胞存活率均低于80%;ALA濃度為100~250 μmol/L時,細胞存活率均低于80%。在一定劑量(0~50 μmol/L)范圍內,4種脂肪酸對HepG2細胞活力影響不大(細胞存活率>80%),所以后續實驗均采用濃度為50 μmol/L的脂肪酸誘導肝細胞。
2.2 不同種類脂肪酸對肝細胞脂質堆積的影響
如圖2所示,油紅O半定量結果表明,與Con相比,PA誘導的肝細胞內脂質堆積程度無統計學意義。與Con相比,OA誘導的肝細胞內脂質堆積程度顯著升高了0.14倍(P<0.05),LA、ALA誘導的肝細胞內脂質堆積程度分別顯著升高了0.25、0.31倍(P<0.001)。與PA相比,OA誘導的肝細胞內脂質堆積程度顯著升高了0.09倍(P<0.05),LA誘導的肝細胞內脂質堆積程度顯著升高了0.19倍(P<0.01),ALA誘導的肝細胞內脂質堆積程度顯著升高了0.25倍(P<0.001)。與OA相比,LA誘導的肝細胞內脂質堆積程度顯著升高了0.09倍(P<0.05),ALA誘導的肝細胞內脂質堆積程度顯著升高了0.15倍(P<0.01)。與LA相比,ALA誘導的肝細胞內脂質堆積程度顯著升高了0.05倍(P<0.05)。根據油紅O半定量結果可知,同一濃度下,不飽和度不同的脂肪酸對肝細胞脂質堆積程度影響不同。
每組加入終濃度為50 μmol/L的脂肪酸分別處理HepG2細胞24 h,進行油紅O染色和細胞內TG含量檢測。如圖3(a)所示,Con、PA、OA、LA、ALA各組細胞內脂滴依次增多。收集細胞,用試劑盒測定細胞內TG含量,實驗結果與油紅O染色結果一致。如圖3(b)所示,與Con相比,PA誘導后細胞內TG含量無顯著性差異,OA誘導后細胞內TG含量顯著升高了0.33倍(P<0.05,LA和ALA誘導的細胞內TG含量分別顯著升高了1.17、1.38倍(P<0.001);與PA相比,OA誘導后細胞內TG含量顯著升高了0.16倍(P<0.05),LA誘導后細胞內TG含量顯著升高了0.89倍(P<0.001),ALA誘導后細胞內TG含量顯著升高了1.07倍(P<0.001);與OA相比,LA誘導后細胞內TG含量顯著升高了0.63倍(P<0.001),ALA誘導后細胞內TG含量顯著升高了0.79倍(P<0.001);與LA相比,ALA誘導后細胞內TG含量顯著升高了0.1倍(P<0.05)。油紅O染色和細胞內TG含量檢測結果顯示,同一濃度下,隨著PA、OA、LA、ALA各組脂肪酸的不飽和度依次增加,PA、OA、LA、ALA各組細胞內脂滴依次增多,細胞內TG含量依次升高,且每種脂肪酸之間進行統計學分析,均存在顯著性差異(P<0.05)。由此可以得出,同一濃度下,不飽和度不同的脂肪酸對肝細胞脂質堆積程度不同。由此推測不飽和度越高的脂肪酸對細胞脂質堆積作用越明顯。
3 討論
NAFLD是與胰島素抵抗、肥胖和脂質代謝異常等密切相關的代謝性肝損傷疾病[13-15]。在NAFL及NASH階段,其病程是可逆的,但當疾病進入肝纖維化以后,病程將很難逆轉。NAFLD 已經成為全球的主要公共問題之一。15%~30%的成年人有NAFLD,而在肥胖和糖尿病群體中,70%以上有NAFLD,可見NAFLD對人類健康的威脅非常大。NAFLD的病因和發病機理一直存在爭議,且迄今為止尚未發現治療 NAFLD的特效藥物[16]。盡管大多數單純性脂肪肝患者短期內無明顯肝功能損傷,但長期的脂肪肝有發展成NASH,肝硬化甚至肝癌的危險[17],可見NAFLD已嚴重威脅人類的身體健康,必須引起高度重視。膳食脂肪酸攝入過多或脂肪酸不平衡,可導致血漿中飽和脂肪酸升高,使肝臟脂肪蓄積增多。膳食脂肪酸包括SFA、MUFA和PUFA,它們是細胞膜的重要組成部分,在一定條件下維持機體血糖和血脂的相對穩定[18]。肝臟是調節糖脂代謝的重要場所[19],機體攝入脂肪酸的種類和數量能夠影響肝臟在糖脂代謝中的調控作用。
探究不同種類的脂肪酸對肝細胞脂質堆積的作用十分重要,針對作用不同的脂肪酸我們可以靶向的進行降脂藥物的體外篩選實驗,同時明確不同種類的脂肪酸對肝細胞的作用機制可以指導人們合理搭配膳食脂肪酸的種類以預防和緩解疾病的發生。基于以上分析,本研究選用PA(飽和脂肪酸)、OA(單不飽和脂肪酸)、LA(多不飽和脂肪酸,含2個雙鍵)、ALA(多不飽和脂肪酸,含3個雙鍵)分別刺激HepG2細胞,通過MTT、油紅O染色、細胞內TG測定等實驗,觀察不同不飽和度、同一劑量下的外源性脂肪酸對HepG2細胞脂質堆積的影響。
MTT實驗反映細胞的活性強度[20],根據MTT結果確定了每種脂肪酸誘導的濃度為50 μmol/L,以比較不同種類脂肪酸對肝細胞脂質堆積的影響。油紅O是脂肪染色的最敏感染料[21],可將細胞內中性脂質染成紅色,細胞內紅色脂滴的多少可反映細胞脂質堆積的程度。根據油紅O染色結果發現,通過半定量檢測和鏡下觀察細胞內脂質堆積情況,可以直觀地看出每種脂肪酸誘導的肝細胞內脂滴的數量存在明顯的差異。
在不同種類脂肪酸對肝細胞內TG含量影響的實驗中,實驗結果與油紅O染色結果一致,而利用試劑盒測定的細胞內TG含量更為精確。不同種類脂肪酸誘導的肝細胞內TG含量隨著4種脂肪酸不飽和度的升高而升高,與對照組相比,飽和脂肪酸PA的肝細胞脂質堆積程度無統計學差異,單不飽和脂肪酸OA的肝細胞脂質堆積程度存在顯著性差異(P<0.05),而多不飽和脂肪酸LA和ALA的肝細胞脂質堆積程度分別存在極顯著性差異(P<0.001),且對每種脂肪酸誘導的肝細胞脂質堆積程度進行統計學分析,均存在顯著性差異(P<0.05)。
綜上所述,不同種類的脂肪酸對肝細胞活力和脂質堆積程度的影響不同,提示可能與脂肪酸的不飽和程度有關,不飽和度越高的脂肪酸對細胞脂質堆積作用越明顯,這一結論為今后建立不同種類脂肪酸誘導肝細胞脂質堆積藥物篩選模型提供了方向,但本實驗針對每種脂肪酸僅選取了其中具有代表性的一種進行研究,今后還應增加研究深度并進一步探討脂肪酸影響肝細胞脂質堆積的作用機制。◇
參考文獻
[1]王瑤芬.非酒精性脂肪性肝病的研究綜述[J].臨床薈萃,2014,29(4):474-477.
[2]Giorgio B,Valerio N,Claudio T.Epidemiology of fatty liver:an update[J].World Journal of Gastroenterology,2014,20(27):9050-9054.
[3]Rahimi R S,Landaverde C.Nonalcoholic fatty liver disease and the metabolic syndrome:clinical implications and treatment[J].Nutr Clin Pract,2013,28(1):40-51.
[4]Zelber-Sagi S,Nitzan-Kaluski D,Goldsmith R,et al.Long term nutritional intake and the risk for non-alcoholic fatty liver disease (NAFLD):a population based study[J].J Hepatol,2007,47(5):711-717.
[5]陳銀基,鞠興榮,周光宏.飽和脂肪酸分類與生理功能[J].中國油脂,2008(3):35-39.
[6]Brumbaugh D E,Friedman J E.Developmental origins of nonalcoholic fatty liver disease[J].Pediatr Res,2014,75(1-2):140-147.
[7]宋旭霞,閆志勇,王斌,等.體外培養的肝癌細胞株與正常肝細胞株蛋白質的差異表達[J].世界華人消化雜志,2005(22):2689-2692.
[8]楊立杰,楊在賓,姜淑貞.必需脂肪酸對動物的功能及其需要量再認識[J].飼料工業,2016,37(12):31-33.
[9]Morisco F,Vitaglione P,Amoruso D,et al.Foods and liver health[J].Mol Aspects Med,2008,29(1-2):144-150.
[10]Gentile C L,Pagliassotti M J.The role of fatty acids in the development and progression of nonalcoholic fatty liver disease[J].J Nutr Biochem,2008,19(9):567-576.
[11]崔秋英,霍麗靜,賈敏,等.高脂飲食中不同脂肪酸類型與胰島素敏感性的相關性研究[J].現代預防醫學,2013,40(9):1630-1633.
[12]Alkhatatbeh M J,Lincz L F,Thorne R F.Low simvastatin concentrations reduce oleic acid-induced steatosis in HepG2 cells:An in vitro model of non-alcoholic fatty liver disease[J].Exp Ther Med,2016,11(4):1487-1492.
[13]Dietrich P,Hellerbrand C.Non-alcoholic fatty liver disease,obesity and the metabolic syndrome[J].Best Pract Res Clin Gastroenterol,2014,28(4):637-653.
[14]Metin B,Serra K,Nevin Y,et al.Understanding mechanisms of the pathogenesis of nonalcoholic fatty liver disease[J].World Journal of Gastroenterology,2010,16(18):2223-2226.
[15]L S,Lm A,R Q,et al.Hepatic expression of adiponectin receptors increases with non-alcoholic fatty liver disease progression in morbid obesity in correlation with glutathione peroxidase 1[J].Obesity surgery,2011,21(4):492-500.
[16]Sanal M G.The blind men ‘see’ the elephant-the many faces of fatty liver disease[J].世界胃腸病學雜志,2008,14(6):831-844.
[17]Friedman S L,Neuschwander-Tetri B A,Rinella M,et al. Mechanisms of NAFLD development and therapeutic strategies[J].Nat Med,2018,24(7):908-922.
[18]Calder P C.Functional roles of fatty acids and their effects on human health[J].JPEN J Parenter Enteral Nutr,2015,39(1 Suppl):18S-32S.
[19]Koo S H.Nonalcoholic fatty liver disease:molecular mechanisms for the hepatic steatosis[J].Clin Mol Hepatol,2013,19(3):210-215.
[20]白生賓,陳紅香,鐘近潔,等.MTT法檢測RAW264.7細胞活力及可能因素分析[J].中國現代醫學雜志,2011,21(23):2831-2833.
[21]Mehlem A,Hagberg C E,Muhl L,et al.Imaging of neutral lipids by oil red O for analyzing the metabolic status in health and disease[J].Nat Protoc,2013,8(6):1149-1154.
Effects of Different Types of Fatty Acids on Lipid Accumulation in Hepatocytes
YIN Zhen,ZHANG Xiao-lin,TIAN Jin-ying,JIANG Nan,LI Xue-chen,YE Fei
(Institute of Materia Medica,Chinese Academy of Medical Sciences/Peking Union Medical College Center for Drug Evaluation/Beijing Key Laboratory of New Drug Action Mechanism and Evaluation,Beijing 100050,China)
Abstract:ObjectiveTo compare the effects of different types of fatty acids on lipid accumulation in human liver cancer cells (HepG2).MethodHepG2 cells were randomly divided into control group (Con),palmitic acid group (PA),oleic acid group (OA),linoleic acid group (LA)and linolenic acid group (ALA).After 24 h culture,the effects of different fatty acids on the survival rate of hepatocytes were compared by MTT method.At the same concentration,the formation of lipid droplets in each group was photographed and the absorbance was measured by oil red O staining.The effects of different fatty acids on lipid accumulation in hepatocytes were compared by enzymatic method.ResultThe concentration induced by each fatty acid was determined to be 50 μmol/L.At the same concentration,as the fatty acid unsaturation of PA,OA,LA and ALA increased successively,the intracellular lipid droplets of PA,OA,LA and ALA increased successively,and the intracellular TG content increased successively.Compared with the control group,there was no statistical difference in PA,a significant difference in OA (P<0.05),and a very significant difference in LA and ALA (P<0.001).Moreover,statistical analysis of the lipid accumulation degree of each fatty acid induced hepatocytes showed significant differences (P<0.05).ConclusionUnder the same condition,different types of fatty acids have different effects on liver cell viability and lipid accumulation degree,suggesting that fatty acid unsaturation may be related to the degree of unsaturation of fatty acid.The higher the degree of unsaturation,the more obvious the effect of fatty acids on lipid accumulation.
Keywords:fatty acid;liver cell;cellular viability;lipid accumulation

