失代償期肝硬化并發敗血癥患者外周血白細胞VCS參數變化及其臨床價值分析
武 瓊,孫 洋,劉 娜,張 錦
肝硬化是我國最常見的消化系統疾病之一,年發病率約為17/10萬人。當疾病進展至失代償期肝硬化階段時,出現自發性細菌性腹膜炎(SBP)、肺部感染和敗血癥的風險明顯增加[1-3]。研究顯示,失代償期肝硬化并發敗血癥患者病死率可增加4倍以上[4],對其進行早期診斷和病情評估對于改善預后具有重要的意義。目前,臨床上應用模型評分和血生化指標對肝硬化患者病情進行判斷,但由于失代償期肝硬化患者存在脾功能亢進或并發上消化道出血和肝性腦病等因素的影響,降低了這些指標判斷的準確性。因此,需開發更多的生物標志物進行聯合診斷,以提高對病情判斷的效能[5,6]。有學者報道,白細胞體積(volume, V)、電導率(conductivity, C)和散射(scattering, C)參數,對于敗血癥的診斷和治療效果評估具有一定的臨床應用價值[7]。我們應用白細胞VCS參數評估了失代償期肝硬化并發膿毒癥患者的病情,現報道如下。
1 資料與方法
1.1 一般資料 2017年6月~2020年6月我院診治的失代償期乙型肝炎肝硬化患者130例,男性71例,女性59例;年齡為35~72歲,平均年齡為(50.18±7.22)歲。失代償期肝硬化的診斷參照2018年歐洲肝病協會(EASL)制定的標準[8],膿毒癥的診斷參照國際敗血癥會議制定的Sepsis 3.0標準[9]。本研究納入發生敗血癥患者39例,普通感染46例(肺部感染15例,腹腔感染23例,尿路感染8例)和未感染者45例。排除標準:①合并惡性腫瘤;②存在其它嚴重的肝外疾病;③近期有應用免疫抑制性藥物。本研究納入患者簽署知情同意書,本研究經我院醫學倫理委員會審核通過。
1.2 實驗室檢查 無菌抽取肘靜脈血2 mL,加入乙二胺四乙酸抗凝管中,使用美國貝克曼公司生產的COULTER LH 750/LH 755全自動血液分析儀和其配套試劑檢測外周血白細胞(中性粒細胞、單核細胞和淋巴細胞)的VCS參數,包括中性粒細胞平均體積(mean neutrophil volume,MNV)、中性粒細胞平均電導率(mean neutrophil conductivity,MNC)、中性粒細胞平均散射率(mean neutrophil scattering,MNS),單核細胞平均體積(mean monocyte volume,MMV)、單核細胞平均電導率(mean monocyte conductivity,MMC)、單核細胞平均散射率(mean monocyte scattering,MMS),淋巴細胞平均體積(mean lymphocyte volume,MLV)、淋巴細胞平均電導率(mean lymphocyte conductivity,MLC)和淋巴細胞平均散射率(mean lymphocyte scattering,MLS);使用美國BD公司生產的BACTEC FX血培養儀、血培養瓶及其配套試劑進行血培養。
1.3 資料收集 入組時,記錄急性生理與慢性健康評分(acute physiology and chronic health evaluation II,APACHE II)和敗血癥相關的序貫器官衰竭評分(sepsis-related organ failure assessment,SOFA)評分。

2 結果
2.1 三組中性粒細胞VCS參數比較 敗血癥組中性粒細胞MNV和MNC水平顯著高于普通感染組或未感染組,普通感染組中性粒細胞MNV水平顯著高于未感染組,差異具有統計學意義(P<0.05,表1)。
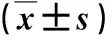
表1 三組評分和中性粒細胞VCS參數比較
2.2 三組單核細胞VCS參數比較 敗血癥組單核細胞MMV水平顯著高于普通感染組或未感染組,普通感染組MMV水平顯著高于未感染組,差異具有統計學意義(P<0.05,表2)。
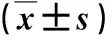
表2 三組單核細胞VCS參數比較
2.3 三組淋巴細胞VCS參數比較 敗血癥組淋巴細胞MLV水平顯著高于普通感染組或未感染組,普通感染組淋巴粒細胞MLV水平顯著高于未感染組,差異具有統計學意義(P<0.05,表3)。
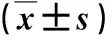
表3 三組淋巴細胞VCS參數比較
2.4 各參數及APACHE II和SOFA對敗血癥的診斷效能 ROC分析結果顯示,MNV、MMV、MLV、APACHE II和SOFA各單指標診斷失代償期肝硬化患者發生敗血癥都具有一定的效能,而各指標聯合診斷的效能最高(P<0.05,表4、圖1)。

表4 各指標診斷敗血癥的效能(%)

圖1 肝硬化患者并發敗血癥的ROC曲線分析
3 討論
研究發現肝硬化患者平均感染發生率為20%~60%,當病情發展至失代償期肝硬化時,發生感染的風險進一步增加,導致敗血癥等的發生,嚴重影響預后[10-12]。既往國內學者已經對失代償期肝硬化感染分布的特點進行了調查。失代償期肝硬化患者感染部位以腹腔感染和消化道感染多見,肺部感染也不少見。在感染病原菌方面,以革蘭陰性菌居多,其中大腸埃希菌和表皮葡萄球菌是檢出率較高的病原菌[13]。進一步分析發現年齡較大、住院時間較長、存在侵入性操作、合并存在較多并發癥、有預防性應用抗菌藥物史和肝功能Child C級等是患者發生醫院感染的危險因素。臨床可進行針對性預防,并在發生感染后及時給予處理[14,15]。
在免疫穩態環境中,肝臟的豐富血供和血竇網絡內皮系統對于降低感染負荷具有重要的意義。當患者處于失代償期肝硬化時,肝臟多種抗原呈遞細胞的免疫監視功能失調,導致阻止微生物成分進入肝臟的能力下降[16],而吞噬細胞水平下降則對識別病原后對病原的清除能力下降,是失代償期肝硬化患者全身抗感染能力下降的直接原因[17]。當失代償期肝硬化患者合并血流感染時,其外周血白細胞計數顯著升高,表明在該狀態下全身血液中白細胞狀態有著明顯的改變[18]。本研究比較了敗血癥患者、普通感染患者和未感染的失代償期肝硬化患者中性粒細胞、單核細胞和淋巴細胞體積、電導率和散射率的變化,結果顯示與普通感染或未感染組比,中性粒細胞、單核細胞和淋巴細胞的平均體積均存在明顯的升高,反映了在膿毒癥狀態下的白細胞形態改變。既往研究對于VCS參數的臨床應用價值已有較多的報道,發現MNV和MMV對于骨髓移植后的粒系成活具有良好的預測價值,且早于中性粒細胞絕對計數[19]。白細胞VCS參數對于傳染性單核細胞增多癥也有較好的診斷效能[20]。在抗結核治療中,白細胞VCS參數MNV、NDW和MNS被用于評估藥物所致的中性粒細胞減少和藥物性肝損傷[21,22]。在資源有限的地區,白細胞VCS參數是評估急性髓系白血病的有效工具[23]。
失代償期肝硬化患者往往由肝臟局部炎癥發展至全身性免疫失衡,進一步引起免疫缺陷,而肝組織的肝竇纖維化和毛細血管化等病理生理學改變使肝臟對內毒素的代謝能力下降,血液清除能力降低,腸道等部位菌群發生移位是普通感染進展至敗血癥的關鍵因素。本研究進一步評估了MNV、MMV、MLV對失代償期肝硬化患者發生敗血癥的診斷效能,結果顯示單指標評估時的AUC都超過了0.5,但將各指標聯合應用時,其AUC達到0.847,高于APACHE II評分和SOFA評分,考慮到失代償期肝硬化患者并發敗血癥時其病情往往較為危急,計算APACHE II評分和SOFA評分較為繁瑣,應用MNV、MMV、MLV進行判斷是較為簡易的評估指標。
目前,臨床上已有較多研究白細胞VCS參數評估感染和敗血癥的價值,但這些指標的臨床大規模應用仍存在一些不足。VCS參數涉及的指標較多,不同疾病間可能呈現出統計學差異,同一指標在不同研究中選取的臨界值也有所不同[24]。不同研究間所用的血液分析儀存在一定的差異,同時由于檢驗誤差等因素,導致統計學結果存在一定的差異。白細胞VCS參數用于感染或敗血癥的預測價值尚不明確,還需更多研究的驗證[25]。

