體外脂肪變L02細胞Notch家族和脂質代謝變化研究*
吳偉杰,陳源文,丁雯瑾,范建高
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的發病機制尚不清楚,目前學界最為公認的發病機制為“多重打擊學說”,NAFLD發生發展與炎癥,氧化應激和胰島素抵抗等代謝障礙關系密切,而其中肝細胞內甘油三酯異常沉積便是NAFLD發病過程中的關鍵一環[1]。Notch信號通路是通過相鄰細胞之間配受體結合后釋放Notch受體胞內結構域(Notch intracellular domain, NICD)進入胞核,激活下游轉錄因子Hes-1和Hey-1,轉錄因子結合到靶基因DNA序列上發揮作用[2-4]。研究發現人類肝組織Notch下游轉錄因子活性與NAFLD活動評分(NAS)呈正相關。同時,Notch信號通路能夠激活肝組織對營養敏感的mTorc1通路,增加脂肪從頭合成途徑和肝臟甘油三酯的生成[5、6]。本實驗通過建立體外脂肪變細胞模型并使用Notch信號通路抑制劑觀察了L02細胞Notch1、-2、-3、Hes-1和Hey-1基因水平及其與脂質水平的變化,以探討Notch家族對脂肪變細胞脂質代謝的影響。
1 材料與方法
1.1 細胞、試劑與儀器人 正常肝細胞L02由中國科學院上海細胞庫提供;RPMI-1640 培養基和磷酸鹽緩沖液(PBS)均購于美國Hyclone 公司;胎牛血清(fatal bovine serum,FBS)購于以色列Biological Industries 公司;γ分泌酶抑制劑N-【N-(3,5-difluorophenacetyl)-L-alnyl】-S-phenylycine t-butyl ester(DAPT)和棕櫚酸(palmitic acid,PA)均購于美國默克公司;RPS-18內參引物購于中國上海生物工程公司;Trizol試劑和預混型定量用逆轉錄試劑盒購于日本寶日醫公司;qPCR SYBR Green Master Mix購于中國上海翊圣生物科技有限公司;Q3 PCR 擴增儀和Nano Drop 2000 超微量分光光度儀(美國賽默飛公司);PCR 逆轉錄儀(德國艾本德公司);chemray240全自動生化分析儀(中國雷杜公司)。
1.2 體外細胞脂肪變模型建立與藥物干預 使用PA 5mM母液和RPMI-1640完全培養基(含10% FBS)配制成含PA 0.1mM、0.25mM和0.5mM的完全培養基作為工作液使用。細胞造模分組:對照組(Con)、PA 0.1mM組、PA 0.25mM組和PA 0.5mM組,待L02細胞在培養皿中密度達到60%~70%時,棄掉原有的培養基,用PBS洗1遍,加入不同濃度的PA工作液處理L02細胞24 h,收集細胞。根據前期實驗結果選擇PA 0.25mM濃度作為造模條件,在PA 0.25 mM濃度下,將DAPT設為0 μM、1μM、2μM、5μM和10μM的干預濃度,其中以DAPT 0μM作為模型組,處理L02細胞24 h,收集細胞。
1.3 細胞Notch家族mRNA水平檢測 采用Trizol提取細胞總RNA,使用預混型定量用逆轉錄試劑盒逆轉錄mRNA。在Primer bank設計引物,由上海生物工程公司合成。使用Q3 PCR擴增儀進行擴增,采用SYBR法,反應條件設定為反應體系20 μL,95 ℃預變性30 s,循環次數40次,依次進行95 ℃變性10 s,60 ℃退火30 s。Notch1上游:5’TGCGAGACCAACATCAACGAGTG3’,Notch1下游:5’TCAGGCAGAAGCAGAGGTAGGC3’,擴增片段長度為94 bp;Notch2上游:5’GTAAGGAGTGCCAATGGACGGATG3’,Notch2下游:5’ATTTCTGCCCTGTGAAGCCTGTG3’,擴增片段長度為120 bp;Notch3上游:5’CGTGGCTACACTGGACCTC3’,Notch3下游:5’AGATACAGGTGAACTGGCCTAT3’,擴增片段長度為109 bp;Hes-1上游:5’TCAACACGACACCGGATAAAC3’,Hes-1下游:5’GCCGCGAGCTATCTTTCTTCA3’,擴增片段長度為153 bp;Hey-1上游:5’GT-TCGGCTCTAGGTTCCATGT3’,Hey-1下游:5’CGTCGGCGCTTCTCAATTATTC3’,擴增片段長度為88 bp;選擇人RPS-18作為內參對照,計算各基因mRNA相對水平(結果以2-ΔΔCt表示)。
1.4 培養上清液轉氨酶檢測 收集細胞上清液,準備谷草轉氨酶(aspartate aminotransferase,AST)/谷丙轉氨酶(alanine transaminase,ALT)的基質液、顯色液,應用終止液(濃縮終止液:雙蒸水=1:9),吸取待測樣品50 μL,與基質液250 μL混合,37 ℃水浴30 min;加入顯色液250 μL,37 ℃水浴20 min;加入應用終止液2.5 mL,混勻后室溫放置5 min,在505 nm波長測得各管OD值。查詢標準曲線,求得相應的水平。
1.5 培養上清脂質檢測 收集細胞,離心棄凈上清,用PBS洗兩次,加入PBS 100 μL,重懸,超聲破碎細胞,離心取上層上清,使用Chemray240全自動生化分析儀檢測甘油三酯(triglyceride,TG)、總膽固醇(cholesterol,TC)、游離脂肪酸(free fatty acid,FFA)水平。
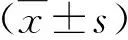
2 結果
2.1 不同濃度PA干預細胞Notch家族mRNA水平比較 與對照組比,在0.1mM PA干預下,Notch3 mRNA水平顯著升高(P<0.05);在PA 0.25mM濃度干預下,Notch3 mRNA水平顯著降低(P<0.01),而Hes-1 mRNA水平顯著升高(P<0.01);在0.5mM PA干預下,Notch3 mRNA水平顯著降低(P<0.01),而Notch1和Hes-1 mRNA水平顯著升高(P<0.01),Hey-1 mRNA水平變化與對照組比無統計學差異(P>0.05,表1)。

表1 不同濃度PA干預細胞Notch家族mRNA水平比較
2.2 不同濃度DAPT干預PA處理細胞Notch家族mRNA水平變化 與模型組(DAPT 0μM)處理相比,DAPT 2μM、5μM和10μM干預組Notch家族下游Hes-1和Hey-1 mRNA水平均顯著下調(P<0.01),而Notch1-3基因水平均未被DAPT顯著抑制(表2)。

表2 不同濃度DAPT干預PA處理細胞Notch家族mRNA水平比較
2.3 各組細胞上清液轉氨酶水平變化 在0.25mM和0.5mM PA處理組,AST水平顯著高于對組【(6.7±2.6 )U/L和(12.4±1.6 )U/L對(2.4±0.1 )U/L,P均<0.01】;同樣地,ALT水平也顯著高于對照組【(5.7±0.8)U/L和(10.3±0.7)U/L對(2.2±0.3 )U/L,P均<0.01】;在0.25mM PA處理細胞,給予1μM、2μM、5μM和10μM DAPT干預24 h,各組AST水平均顯著低于模型組(P均<0.01】,而ALT水平均無顯著變化。
2.4 細胞TG、TC和FFA水平變化 在0.25mM和0.5mM PA處理組,細胞TG水平顯著高于對照組【分別為(0.4±0.04)mmol/g和(0.4±0.04)mmol/g對(0.2±0.02)mmol/g,P均<0.01】;在 0.5mM PA處理組,細胞TC和FFA水平顯著高于對照組【分別為(1.2±0.4)mmol/g對(0.2±0.02)mmol/g和(0.07±0.004)mmol/g對(0.02±0.001)mmol/g,P均<0.01】;在 0.25mM PA處理細胞,經2μM、5μM和10μM DAPT 干預24 h,細胞TG水平顯著低于0μM DAPT處理模型組【分別為(0.03±0.01)mmol/g、(0.04±0.01)mmol/g和(0.02±0.01)mmol/g對(0.07±0.01)mmol/g,P均<0.01】,在10μM DAPT干預組,細胞TC水平顯著高于模型組【(0.2±0.03)mmol/g對(0.1±0.02)mmol/g,P<0.05】,而FFA水平無顯著變化。
3 討論
本實驗發現經PA處理L02細胞,Notch 1、Notch3及其下游Hes-1基因水平發生很大變化。據文獻報道,Notch1和叉頭框轉錄因子O亞型1(FoxO1)可以協同調節肝臟葡萄糖代謝,抑制Notch1和FoxO1基因表達能改善胰島素抵抗小鼠對胰島素的敏感性[7-11]。Notch家族與NAFLD脂代謝變化機制可能部分是通過胰島素信號通路途徑實現的[12]。本實驗還發現經PA處理細胞Hes-1基因明顯被激活。本實驗使用DAPT作為γ-分泌酶底物,可以競爭性與γ分泌酶結合,從而實現間接抑制Notch信號轉導。在PA作用細胞,經DAPT干預,觀察到Notch下游Hes-1和Hey-1基因水平均被顯著抑制,結果提示DAPT能成功阻斷Notch向下游傳導[13-15]。
有研究發現抑制脂肪肝大鼠Notch1能同時降低下游Hes-1表達,使脂質代謝相關基因、脂肪酸合成酶和乙酰輔酶A羧化酶表達下調,從而減輕大鼠脂肪肝和高血糖的發生發展[16-18]。Hes-1可以通過調節某種基因,有效阻斷低密度脂蛋白受體在細胞膜上表達[19,20]。在實驗中,我們通過抑制Notch通路,導致下游Hes-1和Hey-1基因表達下調,檢測發現細胞內甘油三酯沉積減少。本研究表明,Notch在肝細胞脂質代謝過程中具有調節作用,其中Notch1/Hes-1途徑可能是參與脂肪肝發病的潛在機制。因此,Notch信號通路值得進一步探索,是治療肝脂肪變性有希望的靶點之一。
Notch信號依賴于細胞間配體與受體相互識別而發揮作用。肝臟組織內不僅有肝實質細胞,同時也存在肝星狀細胞、庫普弗細胞和血管內皮細胞等。單純在L02細胞的實驗可能不足以解釋生物體內細胞間的相互作用。我們課題組擬在未來開展動物實驗進一步了解Notch信號具體是如何影響肝臟脂代謝變化的,以期對肝細胞脂肪變性的發生機制有新的認知。

