門冬氨酸鳥氨酸對非酒精性脂肪性肝炎合并肌少癥性肥胖小鼠的保護作用*
王子璇,王夢雨, 李經緯, 楊蕊旭, 曾靜, 潘勤, 范建高
近年來,全球非肥胖和瘦人非酒精性脂肪性肝病(NAFLD)患病率增長迅速,這些患者非酒精性脂肪性肝炎(NASH)以及代謝和心血管疾病發病風險與肥胖的NAFLD患者相似[1,2],部分原因是體質量診斷肥胖的敏感性因存在肌少癥而降低,合并肌少癥的隱性肥胖群體不容忽視。以骨骼肌質量和功能減退為特征的肌少癥在非肥胖NAFLD群體中常見且與NASH互為因果[3-5],提示防治NAFLD需兼顧干預肌少癥和NASH。鑒于高氨血癥可能是誘發和加劇NAFLD患者肌少癥和肝損傷的重要因素[6-8],本研究采取高脂飲食飼養小鼠制備NASH合并肌少癥性肥胖模型,探討了降血氨藥物門冬氨酸鳥氨酸顆粒對造模形成的影響。
1 材料與方法
1.1 一般資料 28只8周齡SPF級雄性C57BL/6小鼠,體質量20~22 g,購于杭州子源實驗動物科技有限公司【SCXK(浙)2019-0004】,分籠飼養于上海睿太莫斯生物科技有限公司【SYXK (滬) 2016-0004】SPF級動物房,恒溫(24℃±2℃)、恒濕(50%±5%),晝夜明暗交替(12 h/12 h)。
1.2 動物模型的制備 隨機將動物分為普通飼料飼養的對照組(n=11)及普通飼料加10%豬油和2%膽固醇飼養的模型組(n=17)。在實驗第12 w,隨機處死對照組和模型組動物5只,其后將模型組小鼠隨機分為干預組和模型對照組,分別給予門冬氨酸鳥氨酸顆粒(武漢啟瑞藥業有限公司惠贈)2 g.kg-1.d-1或等量生理鹽水灌胃共8 w。在實驗第20 w,隔夜禁食12 h,腹腔注射水合氯醛麻醉小鼠,常規收集血液及肝臟和股四頭肌組織,將標本置于4%多聚甲醛溶液中固定12 h,石蠟包埋制片行HE染色。采用NAFLD活動度積分(NAFLD activity score,NAS)評估肝臟病理學變化。應用ImageJ 1.52a軟件(美國國立衛生研究院)在200倍視野下測量30個以上肌細胞的肌纖維直徑,取均值。
1.3 小鼠體成分和抓力測試 在處死動物前1天,在透明動物倉內插入Minispec LF50小動物MRI體成分分析儀(德國Bruker公司),檢測小鼠全身脂肪和肌肉質量(瘦體質量)。根據脂肪質量與體質量的百分比計算體脂率。然后,使用BIO-GS3握力計(法國Bioseb公司)測量小鼠前肢抓力(g),測量3次,取均值。
1.4 工作定義 依據2018年歐洲肌少癥共識[9]和有關文獻[10],規定模型組小鼠體質量或體脂質量顯著高于對照組為肥胖,瘦體質量和抓力顯著低于對照組為肌少癥,兩者并存為肌少癥性肥胖。規定肝組織5%以上肝細胞脂肪變伴小葉內炎癥細胞浸潤(≥1分)和肝細胞氣球樣變(≥1分)為NASH,干預組小鼠肝臟炎癥評分0~1分和氣球樣變評分0分,無或僅輕度肝脂肪變為NASH緩解[11]。
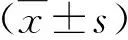
2 結果
2.1 各組體質量、體脂質量、瘦體質量和抓力比較 在實驗12 w,模型組動物抓力顯著低于對照組(P<0.05);在第20 w,模型組體脂質量和體脂率顯著高于對照組,而瘦體質量和抓力則顯著低于對照組(P<0.05,表1)。
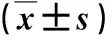
表1 各組小鼠體質量、體成分和抓力比較
2.2 各組肌纖維變化比較 在20 w,模型組肌纖維排列疏松,肌纖維間隙增加,肌纖維直徑顯著低于對照組(P<0.05,圖1)。

圖1 對照組和模型組小鼠肌肉病理學表現(HE,200×)A:對照組;B:模型組;C: 模型對照組
2.3 各組肝組織學變化比較 在第12 w,模型組5只小鼠都出現了5%以上大泡性肝脂肪變,伴小葉內不同程度的炎性細胞浸潤和肝細胞氣球樣變(達到NASH診斷標準);在第20 w時,肝細胞脂肪變、小葉內炎癥和氣球樣變程度加重,NAS積分進一步升高(圖2,表2)。

圖2 對照組和模型組小鼠肝組織病理學表現(HE,100×)A:對照組;B:模型組;C: 模型對照組
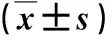
表2 各組小鼠肝組織NAS積分比較
2.4 各組小鼠股四頭肌和肝組織病理學表現比較 在第20 w,干預組小鼠肌細胞形態飽滿,肌纖維直徑顯著增加,肝組織NAS積分顯著下降,所有小鼠都達到了NASH緩解標準(圖3、圖4)。

圖3 各組小鼠股四頭肌病理學表現(HE,200×)A:對照組;B: 模型對照組;C: 干預組

圖4 各組小鼠肝組織病理學表現(HE,100×)A:對照組;B: 模型對照組;C: 干預組
3 討論
肌少癥和NAFLD及其嚴重類型NASH與肝纖維化關系密切[12],兩者有許多共同的危險因素[13]。然而,至今大多數研究是橫斷面調查,難以闡明兩者的因果關系。本研究動態觀察了高脂飲食飼養8周齡雄性C57BL/6小鼠的體成分、肝臟和肌四頭肌病理學改變,結果發現在實驗12周時模型組小鼠肝組織病理學改變已滿足NASH診斷標準,并且前肢抓力顯著下降,但其體質量、體脂含量和瘦體質量與普通飼料喂養的對照組并無顯著性差異;繼續造模8周小鼠肝脂肪變、炎癥、氣球樣變加重,伴體脂質量、體脂率增高,而瘦體質量和前肢抓力減少,提示20周的高脂飲食飼養野生型小鼠可建立NASH合并肌少癥性肥胖模型。長期高脂肪高熱量飲食及缺乏運動可能通過胰島素抵抗、代謝性炎癥、細胞因子失衡、維生素D缺乏、腸道菌群失衡等引起機體脂肪-肌肉-肝軸細胞和分子協調機制受損,從而導致NAFLD和肌少癥性肥胖的發生和發展。
本研究高脂飲食模型小鼠體質量與對照組比并無顯著性增加,這與非肥胖NAFLD和瘦人NAFLD表型相似。通常,非肥胖NAFLD患者體脂質量、體脂率和內臟脂肪含量顯著增加[14],而其骨骼肌質量則比健康成人和肥胖的NAFLD患者減少[15]。為此,基于體質量的NAFLD分型標準需要被精準的人體成分分析和代謝心血管危險因素分層所取代[2]。本模型造模方法簡便,成功率高達100%,似可用于非肥胖或瘦人NASH發病機制及新藥研發的研究。
NASH與肌少癥之間可能互相影響并形成惡性循環。高脂飲食及其相關腸菌紊亂和脂肪肝既可引起腸道產氨增多又影響肝臟尿素合成,導致腸源性高血氨,后者可能是NASH和肌少癥的重要發生機制[8]。NAFLD患者肝臟尿素循環關鍵酶氨基甲酰磷酸合成酶1和鳥氨酸氨基甲酰轉移酶活性降低,導致肝臟尿素循環紊亂和高血氨,進而引起肝臟和肌肉損傷[7]。12周的門冬氨酸鳥氨酸顆粒干預可使超聲診斷的NASH患者肝酶水平降低和脂肪肝程度減輕[16]。然而,該研究未行肝活檢評估NASH,亦未關注肌少癥。本研究發現,在高脂飲食造模的同時,8周的門冬氨酸鳥氨酸干預可顯著使模型小鼠NASH緩解,以小葉內炎癥和氣球樣變改善最為明顯。此外,門冬氨酸鳥氨酸干預小鼠體脂質量和體脂率降低,而瘦體質量、抓力和肌纖維直徑增加。這些結果提示門冬氨酸鳥氨酸顆粒可以改善NASH小鼠肝損傷,并可預防肌少癥性肥胖的發生。門冬氨酸鳥氨酸對肝臟和肌肉保護作用的機制可能與降血氨有關,因其促進尿素循環并通過谷氨酰胺合成酶增加谷氨酰胺合成而促進氨的解毒[17]。本研究的缺點是未檢測實驗小鼠腸道菌群、血氨等重要指標,未觀察到肌少癥性肥胖小鼠肌肉組織脂肪浸潤現象,未探討門冬氨酸鳥氨酸對NASH相關肝纖維化的影響,這些都有待進一步的實驗和臨床研究探討。
總之,本研究成功制備了NASH合并肌少癥性肥胖小鼠模型,可能是探討肌少癥與NASH內在聯系及新藥研發的理想工具。門冬氨酸鳥氨酸顆粒對高脂飲食小鼠脂肪性肝炎及肌少癥的保護作用值得進一步的體內外試驗以及設計嚴謹的臨床試驗來驗證其療效,并探討其作用機制。

