核苷(酸)類似物序貫聯(lián)合聚乙二醇干擾素α治療血清HBsAg低水平的慢性乙型肝炎患者療效分析*
吳鳳萍,魯 瑞,劉怡欣,王怡愷,田 燕,張 欣,賈曉黎,黨雙鎖
乙型肝炎病毒(hepatitis B virus,HBV)感染所引起的慢性乙型肝炎(chronic hepatitis B,CHB)有進展為肝硬化(liver cirrhosis,LC)甚至肝細胞癌(hepatocellular carcinoma, HCC)的風(fēng)險[1]。抗病毒治療可以有效地控制肝病的進展,降低LC和HCC的發(fā)生[1]。近年來,多項研究已表明單用核苷(酸)類似物(nucleos(t)ide analogs, NAs)或聚乙二醇干擾素α(peginterferon alpha,Peg-IFN-α)治療CHB患者,達到HBsAg清除或臨床治愈的比例非常低,而兩類藥物的聯(lián)合應(yīng)用則有望提高療效,有助于進一步追求臨床治愈的目標(biāo)[2, 3]。本研究探討了應(yīng)用NAs序貫聯(lián)合Peg-IFN-α治療血清HBsAg低水平的CHB患者的療效和安全性,現(xiàn)將結(jié)果報道如下。
1 資料與方法
1.1 一般資料 2015年11月~2018年10月在西安交通大學(xué)第二附屬醫(yī)院感染病科就診的CHB患者106例,男性76例,女性30例;年齡為19~62歲,平均年齡為38.6±11.0歲。診斷符合2015年中華醫(yī)學(xué)會肝病學(xué)分會和感染病學(xué)分會修訂的《慢性乙型肝炎防治指南》的診斷標(biāo)準(zhǔn)[2]。納入標(biāo)準(zhǔn):(1) 年齡18~65歲;(2) 經(jīng)NAs治療1年以上后達到血清HBsAg≤1500 IU/mL、HBeAg轉(zhuǎn)陰、HBV DNA <20 IU/mL;(3) 血清膽紅素和轉(zhuǎn)氨酶均正常;(4) Fibroscan檢測顯示肝硬度測定(LSM)為9.0 ≤ LSM < 12.0 Kpa。排除標(biāo)準(zhǔn):(1) 合并嚴(yán)重的心、腦、肺、腎、血液系統(tǒng)疾病;(2) 伴有甲狀腺疾病、視網(wǎng)膜病變、銀屑病、神經(jīng)性耳聾、精神病或有精神疾病史;(3) 既往接受過IFN-α或Peg-IFN-α治療;(4) LC或HCC患者;(5) 有酗酒、吸毒史或未能控制的癲癇、糖尿病、高血壓和自身免疫性疾病;(6) 合并其它嗜肝病毒感染和(或)HIV 感染;(7) 妊娠或哺乳期婦女。本研究已通過我院醫(yī)學(xué)倫理委員會批準(zhǔn),所有患者入組前簽署了書面知情同意書。
1.2 治療方法與隨訪 根據(jù)患者治療意愿分為兩組,42例患者在繼續(xù)NAs治療的基礎(chǔ)上聯(lián)合應(yīng)用Peg-IFNα-2a(上海羅氏制藥有限公司)180μg皮下注射,1次/w或Peg-IFNα-2b(廈門特寶生物工程股份有限公司)180μg皮下注射,1次/w,治療48 w;另64例患者繼續(xù)單用原NAs治療,觀察48 w。隨訪至96 w(即停用Peg-IFN-α后或繼續(xù)口服NAs治療,再隨訪48 w)。兩組基線資料均衡,具有可比性(P>0.05,表1)。

表1 106例患者基線資料比較
1.3 檢測和檢查 使用羅氏公司生產(chǎn)的全自動AmpliPrepCOBAS TaqMan 48系統(tǒng)檢測儀及其配套試劑檢測血清HBV DNA;使用美國雅培公司生產(chǎn)的Architect i2000 化學(xué)發(fā)光免疫分析儀及其配套試劑檢測血清HBV標(biāo)志物(血清HBsAg<0.05 IU/mL被定義為 HBsAg轉(zhuǎn)陰,血清 HBsAb ≥10 mIU/mL被定義為HBsAb陽性);使用上海科華生物工程股份有限公司生產(chǎn)的奧林巴斯AU2700 生化儀檢測肝功能;使用Echosens公司的FibroScan 502行LSM測定,單位為千帕(kPa)。
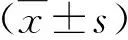
2 結(jié)果
2.1 兩組血清HBsAg轉(zhuǎn)陰率和血清學(xué)轉(zhuǎn)換率比較 在序貫聯(lián)合組,有41例患者完成了48 w的Peg-IFN-α治療,最終有40例患者接受隨訪至96 w;在NAs組,有60例患者完成了96 w隨訪。本研究采用意向性分析(intention-to-treat analysis,ITT分析,即對所有進入本研究的患者進行療效和安全性分析,或?qū)γ撀涞牟±徽J為無效),結(jié)果在48 w和96 w時,序貫聯(lián)合組血清HBsAg轉(zhuǎn)陰率和血清學(xué)轉(zhuǎn)換率均顯著高于NAs組,差異均有統(tǒng)計學(xué)意義(P均<0.001,表2)。

表2 兩組HBsAg轉(zhuǎn)陰率和血清學(xué)轉(zhuǎn)換率(%)比較
2.2 兩組血清HBsAg動態(tài)變化比較 在治療12 w后,序貫聯(lián)合組血清HBsAg水平均顯著低于NAs組,差異具有統(tǒng)計學(xué)意義(P均<0.001,表3)。

表3 兩組HBsAg水平動態(tài)變化比較
2.3 兩組血清ALT水平動態(tài)變化比較 見表4。

表4 兩組血清變化比較
2.4 兩組LSM變化比較 見表5。

表5 兩組變化比較
3 討論
NAs和Peg-IFN-α均為慢性乙型肝炎防治指南推薦的抗HBV感染的一線藥物,但兩者抗HBV的作用機制不同[1]。NAs主要通過競爭性抑制HBV DNA聚合酶的活性而直接抑制HBV DNA的復(fù)制,具有抗病毒作用強、安全性好等特點,但血清HBsAg清除率低[4]。IFN-α具有抗病毒和免疫調(diào)節(jié)雙重作用。它可以誘導(dǎo)具有抗病毒作用的干擾素刺激基因的表達,活化并增強T淋巴細胞、巨噬細胞、自然殺傷細胞功能,誘導(dǎo)脫氨酶載脂蛋白B mRNA編輯酶催化多肽3A的表達而降解HBV復(fù)制模板共價閉合環(huán)狀DNA(covalently closed circular DNA, cccDNA),從而徹底清除HBsAg[5]。多項臨床研究已證實聯(lián)合使用抑制病毒復(fù)制和調(diào)節(jié)宿主免疫的治療方法,通過不同機制的協(xié)同作用可以有效地提高CHB患者血清HBsAg 轉(zhuǎn)陰率及血清學(xué)轉(zhuǎn)換率[6-9]。然而,目前關(guān)于兩類藥物聯(lián)合使用治療血清低水平HBsAg的CHB患者的療效仍不明確。
本研究中42例NAs經(jīng)治的血清低水平HBsAg的CHB患者通過序貫聯(lián)合Peg-IFN-α治療,獲得了較好的療效。在治療48 w 末,血清HBsAg轉(zhuǎn)陰率及血清學(xué)轉(zhuǎn)換率分別為19.0%和14.3%,在隨訪48 w時分別提高到21.4%和19.0%,顯著高于未序貫聯(lián)合Peg-IFN-α而繼續(xù)單用NAs治療的CHB患者。該研究結(jié)果表明對于NAs經(jīng)治的低水平HBsAg的CHB患者,采用NAs與Peg-IFN-α序貫聯(lián)合治療可以充分地發(fā)揮兩者的協(xié)同抗病毒作用,從而有效地提高HBsAg 轉(zhuǎn)陰率及血清學(xué)轉(zhuǎn)換率。
本研究結(jié)果顯著優(yōu)于法國學(xué)者Marcellin et al報道的應(yīng)用富馬酸替諾福韋酯與Peg-IFN-α初始聯(lián)合治療方案的研究結(jié)果,其血清HBsAg清除率僅為9.0%[7]。分析其原因可能為本研究所采用的治療方案是一種優(yōu)化的聯(lián)合治療方案,所選患者是經(jīng)過長期NAs治療后實現(xiàn)HBV DNA持續(xù)抑制、HBeAg陰轉(zhuǎn)且HBsAg降至低水平的患者,屬于Peg-IFN-α治療的優(yōu)勢患者[10]。 既往研究發(fā)現(xiàn)高水平的HBsAg、HBeAg和HBV DNA 可以導(dǎo)致機體HBV特異性T細胞的耗竭,Thl/Th2比例失衡,誘導(dǎo)機體免疫耐受,從而降低機體對Peg-IFN-α的治療應(yīng)答[11-14]。長期NAs治療可以有效地抑制HBV DNA復(fù)制并且降低HBsAg水平,促使機體免疫功能的恢復(fù),進而提高機體對Peg-IFN-α的應(yīng)答[15]。
然而,我們前期已發(fā)表的研究顯示NAs序貫聯(lián)合Peg-IFN α-2a治療血清HBsAg≤ 1500 IU/mL的CHB患者可實現(xiàn)37.4% HBsAg轉(zhuǎn)陰率和29.7%血清學(xué)轉(zhuǎn)換率,顯著優(yōu)于本研究的療效[6]。分析其原因可能為前期研究所入選的患者是LSM <9.0 kPa的CHB患者,而本研究的患者是伴有肝纖維化(9.0 ≤ LSM < 12.0 Kpa)的患者,提示CHB伴有肝纖維化可能會影響對Peg-IFN-α治療的應(yīng)答。
本研究中我們觀察到序貫聯(lián)合組患者在使用Peg-IFN-α治療前基線ALT水平正常,與NAs治療患者無統(tǒng)計學(xué)差異,而78.6%患者在使用Peg-IFN-α治療過程中出現(xiàn)了ALT升高,而在停用Peg-IFN-α治療后,ALT也逐漸恢復(fù)至正常水平,推測Peg-IFN-α可以導(dǎo)致CHB患者免疫功能的激活,而既往研究發(fā)現(xiàn)這種免疫功能的激活又會促進HBsAg的清除[16]。
本研究發(fā)現(xiàn)在隨訪48 w時,序貫聯(lián)合組患者LSM顯著低于NAs組,推測Peg-IFN-α治療可以有效地改善肝纖維化程度[17]。然而,有趣的是我們觀察到在48 w治療結(jié)束時序貫聯(lián)合治療組患者LSM水平顯著高于NAs組,可能為Peg-IFN-α治療導(dǎo)致肝臟炎癥反應(yīng)影響了LSM的評估[18]。本研究結(jié)果顯示序貫聯(lián)合組患者所發(fā)生的不良反應(yīng)均為Peg-IFN-α的常見不良反應(yīng),無嚴(yán)重不良反應(yīng)發(fā)生。
本研究存在以下兩點局限性:一、使用瞬時彈性成像進行無創(chuàng)性肝臟硬度測定不能取代肝組織活檢。雖然肝穿刺活檢是診斷肝纖維化分期的金標(biāo)準(zhǔn),但由于其具有侵襲性、取樣偏差、觀察者間偏差、觀察者內(nèi)偏差、膽漏和出血等風(fēng)險[19],在臨床實踐中難以廣泛實施。瞬時彈性成像是一種較為成熟的無創(chuàng)檢查技術(shù),在膽紅素和轉(zhuǎn)氨酶均正常的情況下能夠比較準(zhǔn)確地識別出輕度肝纖維化和進展期肝纖維化或早期肝硬化[20];二、樣本量偏小。后續(xù)我們將會開展多中心研究進一步擴大樣本量,繼續(xù)觀察該治療方案的療效和安全性。

