TACE術(shù)后阿帕替尼維持治療進(jìn)展期肝細(xì)胞癌患者療效分析*
張 英,張 雷,丁海濤
肝細(xì)胞癌(hepatocellular carcinoma,HCC)屬臨床常見的惡性腫瘤。據(jù)報道,近年來在世界范圍內(nèi)HCC發(fā)病率和死亡率分別位于惡性腫瘤的第四位和第三位,病因較為復(fù)雜,致病因素包括內(nèi)源性因素,如代謝紊亂和外源性因素,如乙型或丙型肝炎病毒感染、過度飲酒、高黃曲霉毒素接觸等[1]。近年來,雖然治療HCC的手段取得了較大的突破,如熒光腹腔鏡下肝腫瘤切除術(shù)、射頻消融等,但大部分患者初診時即處于疾病進(jìn)展期而無上述治療方法的適應(yīng)證。有研究表明,無法手術(shù)治療的進(jìn)展期HCC患者1 a、3 a和5 a生存率分別為29%、8%和0%,而經(jīng)導(dǎo)管肝動脈化療栓塞術(shù)(transcatheter arterial chemoembolization,TACE)可使無法手術(shù)的進(jìn)展期HCC患者1 a、3 a和5 a生存率分別提高至75%、47%和26%[2]。盡管TACE治療能延緩疾病進(jìn)展,改善進(jìn)展期HCC患者的生存,但其并不能完全殺滅腫瘤,治療后局部殘存腫瘤組織缺氧易導(dǎo)致血管內(nèi)皮生長因子水平劇增,刺激腫瘤新生血管的形成,最終引起腫瘤的復(fù)發(fā)和轉(zhuǎn)移[3]。阿帕替尼作為一種新型小分子抗血管生成抑制劑,具有強(qiáng)效抗腫瘤作用,可促使血管內(nèi)皮生長因子受體2酪氨酸激酶活性受抑,切斷血管內(nèi)皮生長因子與受體結(jié)合介導(dǎo)的信號傳導(dǎo),抑制腫瘤血管內(nèi)皮細(xì)胞遷移、增殖,最終阻斷腫瘤新生血管的生成[4]。盡管目前有較多報道證實TACE治療后阿帕替尼維持治療進(jìn)展期HCC患者安全有效,但關(guān)于影響其療效的因素仍缺乏較為全面的研究[5,6]。本研究通過分析TACE治療后應(yīng)用阿帕替尼維持治療進(jìn)展期HCC患者的近期療效,探討了影響療效的因素,現(xiàn)將結(jié)果報道如下。
1 資料與方法
1.1 一般資料 2018年1月~2019年12月我院收治的進(jìn)展期HCC患者138例,男97例,女41例;年齡為37~74歲,平均年齡為(56.8±8.4)歲。診斷參照《原發(fā)性肝癌診療規(guī)范(2017年版)》[7],經(jīng)CT引導(dǎo)下肝穿刺病理學(xué)檢查診斷為進(jìn)展期HCC,肝功能Child-Pugh A級109例,B級29例;巴塞羅那臨床肝癌(Barcelona clinic liver cancer,BCLC)分期B期91例,C期47例。排除標(biāo)準(zhǔn):肝臟腫瘤負(fù)荷>70%、合并有其他原發(fā)性惡性腫瘤、門靜脈系統(tǒng)完全阻塞、出血或凝血傾向、高血壓病、大量頑固性腹水、既往有精神障礙性疾病、對治療藥物過敏、既往有肝臟外科手術(shù)史、肝功能Child-Pugh C級、治療期間因非腫瘤原因死亡。患者簽署知情同意書,本研究通過我院醫(yī)學(xué)倫理委員會審核。
1.2 治療方法 先行TACE治療,采用改良的Seldinger技術(shù)穿刺,勾掛腹腔干動脈造影,明確血管走行后,將導(dǎo)管插至肝固有動脈遠(yuǎn)端,再次造影,判斷腫瘤大小、位置和供血動脈走行。插入2.7 F微導(dǎo)管(河南康芮特醫(yī)療器械商貿(mào)有限公司)至腫瘤供血動脈,將表柔比星(浙江海正藥業(yè)股份有限公司,國藥準(zhǔn)字H19990279)10 mg、奧沙利鉑(杭州中美華東制藥有限公司,國藥準(zhǔn)字H20113457)50 mg與超液態(tài)碘化油(上海博萊科信誼藥業(yè)有限責(zé)任公司,國藥準(zhǔn)字H31021435)5~10 mL混合均勻乳化后,注入腫瘤供血血管,以100~300 μm微粒球(embosphere microspheres)栓塞腫瘤供血血管,直至供血血管內(nèi)血流停滯,再行明膠海綿條加強(qiáng)栓塞。在栓塞后,造影提示病灶異常染色完全消失,且供血動脈完全閉塞時,退出導(dǎo)管,結(jié)束手術(shù)。在TACE治療后3 d,開始給予阿帕替尼(江蘇盛迪醫(yī)藥有限公司,國藥準(zhǔn)字H20140102)500 mg口服,1次/d,持續(xù)28 d,停止口服治療3 d,再進(jìn)行第二次TACE。在二次治療后第3 d起恢復(fù)用藥,持續(xù)28 d,以此往復(fù)。
1.3 指標(biāo)檢測 采用化學(xué)發(fā)光免疫分析法檢測血清甲胎蛋白(alpha-fetoprotein,AFP)水平(深圳邁瑞生物醫(yī)療電子股份有限公司);采用ELISA法檢測血漿熱休克蛋白90α(heat shock protein 90α,HSP90α)水平(上海極威生物科技有限公司)。
1.4 療效判定標(biāo)準(zhǔn) 采用實體瘤治療反應(yīng)評價標(biāo)準(zhǔn)( response evaluation criteria in solid tumors group,RECIST)[8],1)完全緩解(complete response,CR):增強(qiáng)掃描動脈期未見目標(biāo)病灶有增強(qiáng)表現(xiàn);2)部分緩解(partial response,PR):目標(biāo)病灶直徑總和縮小30%以上;3)疾病穩(wěn)定(stable disease,SD):病灶增加未達(dá)疾病進(jìn)展(progressive disease,PD)或縮小未達(dá)到PR;4)PD:目標(biāo)病灶直徑總和增加20%以上,或有新病灶出現(xiàn)。將CR、PR、SD歸入疾病控制組。
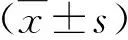
2 結(jié)果
2.1 療效情況 在治療結(jié)束時,138例進(jìn)展期HCC患者獲得CR 10例(7.2%),PR 56例(40.6%),SD 42例(30.4%),PD 30例(21.7%)。
2.2 影響療效的單因素分析 疾病進(jìn)展組患者年齡≥60歲、Child-Pugh分級為B級、BCLC分期為C期、腫瘤直徑≥5 cm、血清AFP≥400.0 μg/L、HSP90α≥460.0 ng/mL占比顯著高于疾病控制組(P<0.05),而兩組性別比較差異無統(tǒng)計學(xué)意義(P>0.05,表1)。

表1 影響療效的單因素(%)分析
2.3 影響療效的多因素Logistic回歸分析 多因素Logistic回歸分析顯示,Child-Pugh分級、BCLC分期、血清AFP和HSP90α是進(jìn)展期HCC患者接受TACE治療后阿帕替尼維持治療臨床療效的獨立影響因素(P<0.05,表2)。

表2 影響TACE治療后阿帕替尼維持治療療效的多因素Logistic回歸分析
3 討論
近年來,研究發(fā)現(xiàn)抗血管生成藥物能抑制血管內(nèi)皮生長因子受體2的合成,阻斷血管內(nèi)皮生長因子刺激所致的血管內(nèi)皮細(xì)胞遷移、增殖,促使腫瘤微血管密度下降,誘導(dǎo)腫瘤細(xì)胞凋亡[9-11]。采取TACE聯(lián)合抗血管生成靶向藥治療可起到協(xié)同抗腫瘤效應(yīng),有利于改善患者預(yù)后[12]。阿帕替尼屬我國研發(fā)的新型小分子抗血管生成抑制劑,與血管內(nèi)皮生長因子受體2結(jié)合的親和力為索拉菲尼的10倍,可經(jīng)高度選擇性競爭細(xì)胞內(nèi)血管內(nèi)皮生長因子受體2的三磷酸腺苷結(jié)合位點,促使下游信號轉(zhuǎn)導(dǎo)受阻,從而抑制腫瘤供血動脈新生血管的生成,誘導(dǎo)腫瘤生長受抑,已被證實聯(lián)合TACE術(shù)在肝癌治療方面意義重大[13]。本研究結(jié)果顯示,在治療結(jié)束時138例患者疾病控制率達(dá)78.3%,與有關(guān)報道[14]結(jié)果相似,提示在TACE術(shù)后應(yīng)用阿帕替尼治療進(jìn)展期HCC患者療效確切。
本研究結(jié)果顯示,存在一些影響該聯(lián)合治療療效的因素,特別是肝功能差,腫瘤太大的患者,療效較差[15]。一旦腫瘤生長過大,患者體內(nèi)產(chǎn)生的特異性抗腫瘤淋巴細(xì)胞數(shù)量明顯減少,無法對腫瘤細(xì)胞產(chǎn)生足夠的免疫殺傷力。AFP屬一種高特異性蛋白質(zhì),是胚胎內(nèi)胚層衍生相關(guān)組織細(xì)胞同源蛋白產(chǎn)物,分布于消化、呼吸、生殖等系統(tǒng)。一旦成人血清AFP水平異常升高,應(yīng)警惕上述系統(tǒng)病變的發(fā)生[16-18]。AFP不僅具有促進(jìn)肝癌細(xì)胞增殖和誘導(dǎo)凋亡的生物學(xué)功能,還可促使自然殺傷細(xì)胞功能受抑,致使淋巴細(xì)胞比例發(fā)生改變,引起機(jī)體免疫機(jī)制失衡,進(jìn)一步加大肝癌細(xì)胞對機(jī)體器官組織的損傷,最終導(dǎo)致臨床療效降低。因此,推測AFP可作為評估進(jìn)展期HCC患者TACE治療后應(yīng)用阿帕替尼維持治療臨床療效的有效指標(biāo)。
本研究結(jié)果顯示,HSP90α是進(jìn)展期HCC患者接受TACE治療后阿帕替尼維持治療臨床療效的獨立影響因素。有人建議將血清HSP90α水平作為評估進(jìn)展期HCC患者臨床療效的指標(biāo)[19]。Hsp90a屬潛在的腫瘤標(biāo)志物,是一類廣泛豐富存在的分子伴侶蛋白,能調(diào)控細(xì)胞周期、激素和信號通路等過程,已成為了腫瘤治療的研究靶點之一。Hsp90a是HSP90的主要亞型之一,不僅可在細(xì)胞內(nèi)存在,還可在細(xì)胞膜上分布,甚至可分泌到細(xì)胞外,而細(xì)胞外HSP90α可作用于層連蛋白、基質(zhì)金屬蛋白酶2、質(zhì)金屬蛋白酶9等重構(gòu)細(xì)胞外基質(zhì),誘導(dǎo)細(xì)胞侵襲,并可結(jié)合細(xì)胞膜上的低密度脂蛋白受體相關(guān)蛋白1、人表皮生長因子受體-2等蛋白,激活細(xì)胞外信號調(diào)節(jié)激酶1/2等信號通路,誘導(dǎo)細(xì)胞上皮間質(zhì)化,影響腫瘤細(xì)胞侵襲和轉(zhuǎn)移能力。有報道顯示,HSP90α在肝癌組織和肝癌患者外周血水平均顯著升高,提示HSP90α可能參與了肝癌的發(fā)生和發(fā)展[20]。高表達(dá)的Hsp90a可促使腫瘤細(xì)胞侵襲和增強(qiáng)轉(zhuǎn)移能力。當(dāng)進(jìn)展期HCC患者血漿Hsp90a水平升高時,預(yù)示出現(xiàn)轉(zhuǎn)移和侵襲其他組織器官的風(fēng)險加大,致使病情進(jìn)展快,治療難度增大,最終也影響臨床療效。

