尼羅羅非魚CD2-like基因克隆及其胞外區表達研究
陳福暖,高曉琳,曾曉憐,謝彩霞,汪志文,2,魯義善,2,吳灶和,王忠良,2,王 蓓,2
( 1.廣東海洋大學 水產學院,廣東省水產經濟動物病原生物學及流行病學重點實驗室,廣東省水產經濟動物病害控制重點實驗室,廣東 湛江 524088; 2.廣東海洋大學 深圳研究院,廣東 深圳 518000 )
白細胞分化抗原2(CD2)是T淋巴細胞上一類重要的黏附分子,它通過與胸腺基質細胞、紅細胞、巨噬細胞等細胞表面CD2配體結合,在T淋巴細胞發育成熟及活化中發揮著重要的作用[1]。細胞表面特異性黏附分子的表達,使多細胞生物的許多細胞選擇性地附著于自身類型的細胞上[2]。這種具有選擇性的細胞黏附或細胞分選在細胞調控形態和信號轉導方面起著重要作用。在大鼠中CD48為CD2的主要結合配體,而在人類中CD2的主要結合配體則是具有高親和力的CD58。CD2與配體分子的相結合,對大多數T淋巴細胞和自然殺傷(NK)細胞發育成熟及活化表現出一定的共刺激作用[3-5]。近年來CD2分子、CD2配體以及它們形成的復合物結構性質的解析研究取得了很大的進展,進一步豐富了哺乳動物中CD2分子的功能研究[6-7];但關于魚類CD2基因的相關信息卻少有報道。
目前,羅非魚是世界上養殖最普遍的魚類之一,也是我國淡水養殖的主要品種,在全國淡水養殖魚類產品產量中排名第6位[8]。引起羅非魚病害的根本原因是養殖環境的惡化和養殖魚類抗病力的下降[9]。對此,可以通過測定酸性磷酸酶、堿性磷酸酶的活性來初步判斷魚類免疫力的高低,進而選擇最佳的養殖環境[10]。盡管目前已有研究表明,硬骨魚類擁有T淋巴細胞介導的細胞免疫應答,CD3不同肽鏈的cDNA序列以及CD4、CD8分子的cDNA序列已相繼被證明在多種魚類中存在[11],但魚類的免疫系統研究依舊處于起步階段,而對魚類CD2表達譜和功能特性的研究相對較少,甘楨等[12]研究發現,CD2胞質結合蛋白2(CD2BP2)基因全長1429 bp,并具有頭腎、脾臟等免疫組織高表達特征。因此,筆者旨在通過克隆鑒定尼羅羅非魚(Oreochromisniloticus)中與CD2具有相似結構的CD2-like基因和探究其胞外區原核表達情況,優化表達條件,以及在變性條件下,復性純化出相關功能蛋白,為進一步研究CD2-like在羅非魚中的免疫功能奠定基礎。
1 材料與方法
1.1 材料
1.1.1 試驗動物
試驗用健康尼羅羅非魚,體質量(150±50) g,購于高州朗業畜牲漁業科技養殖有限公司,且于廣東海洋大學水產學院東海島海洋生物基地暫養4周。
1.1.2 質粒
克隆載體pMD18-T Vector購自TaKaRa公司(大連),原核表達載體pGEX-6P-1由廣東省水產經濟動物病原生物學及流行病學重點實驗室保存。
1.1.3 主要試劑
總RNA提取試劑盒、cDNA反轉錄試劑盒購自北京全式金生物技術有限公司,PCR引物由生工生物工程(上海)股份有限公司合成,Ex Taq DNA聚合酶、T4連接酶、EcoR Ⅰ和Xho Ⅰ購自TaKaRa公司,質粒提取試劑盒、DNA凝膠回收純化試劑盒購自Thermo公司,瓊脂糖、尿素、二硫蘇糖醇、聚乙二醇辛基苯基醚(Triton X-100)、異丙基-β-D-硫代半乳糖苷(IPTG)、苯甲基磺酰氟、乙二胺四乙酸、感受態大腸桿菌(Escherichiacoil) DH5α以及BL21菌株由本實驗室提供。
1.2 方法
1.2.1 尼羅羅非魚總RNA的提取及cDNA的合成
尼羅羅非魚于(25±2) ℃暫養4周后,在無菌操作臺上取健康尼羅羅非魚頭腎組織15~20 mg,按照北京全式金TransZol Up Plus RNA Kit試劑盒的說明方法提取總RNA后。將提取的上述組織按照北京全式金EasyScript First-Strand cDNA Synthesis SuperMix試劑盒說明方法反轉錄合成cDNA第一鏈。
1.2.2 CD2-like基因的克隆
根據數據庫中羅非魚CD2-like基因(GenBank登錄號:XM_005460661.4)片段序列,利用Primer Premier 5.0設計羅非魚CD2-like基因的ORF引物On-CD2L-1F和On-CD2L-1110R9(表1)。以羅非魚頭腎組織cDNA第一鏈為模板進行PCR擴增,擴增程序:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,35個循環;72 ℃,10 min[10-13]。然后進行PCR產物電泳檢測、目的條帶純化回收、與pMD 18-T Vector連接、連接產物轉化步驟后,挑選克隆用菌落PCR鑒定,并將挑選的陽性克隆樣本送至廣州生物工程有限公司測序。
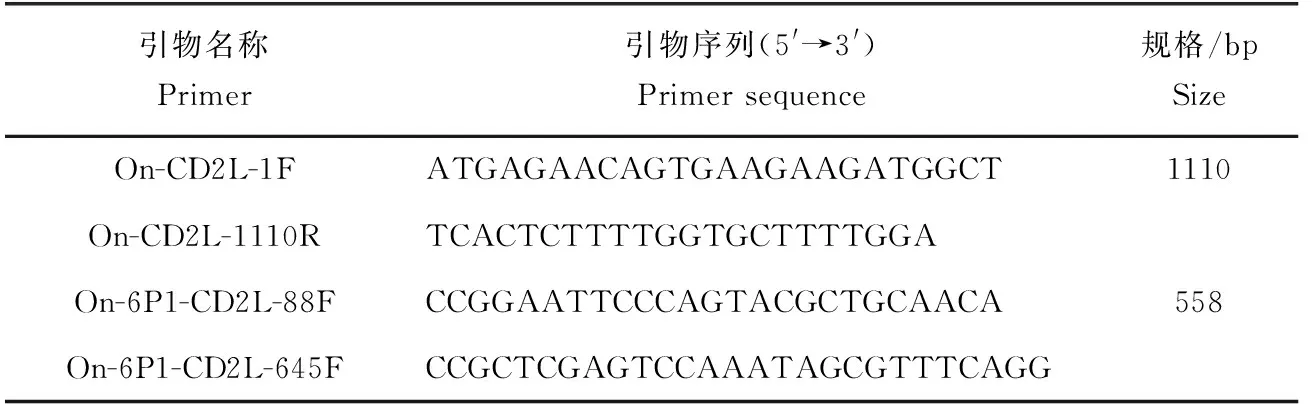
表1 試驗所用引物Tab.1 PCR primers used in this experiment
1.2.3 CD2-like胞外區基因的克隆
與測序結果比對無誤后,根據羅非魚CD2-like基因胞外區片段(G88~A645)設計原核表達引物:On-6P1-CD2L-88F和On-6P1-CD2L-645F。以pMD18T-CD2L為模板進行 PCR 擴增,擴增程序:94 ℃ 5 min;94 ℃ 30 s,64 ℃ 30 s,72 ℃ 45 s,35個循環;72 ℃,10 min[10-13]。然后進行PCR產物電泳檢測、目的條帶純化回收、與pMD 18-T Vector連接、連接產物轉化步驟后,挑選克隆用菌落PCR鑒定,并將挑選的陽性克隆樣本送至廣州生物工程有限公司測序。
1.2.4 CD2-like基因序列的分析
將挑選的陽性克隆的測序結果用DNAMAN Version 6 軟件進行拼接,以獲得OnCD2-like編碼序列。OnCD2-like序列比對分析:美國國立生物技術信息中心 (http:∥www.ncbi.nlm.nih.gov/blast);氨基酸序列推導、開放閱讀框確定、理論等電點預測、分子量和親水性參數的分析推導:ORF Finder (http:∥www.ncbi.nim.nih.gov/govf/govf.html)和ExPASy Proteomics Server (http:∥ca.expasy.org);信號肽序列預測:SignalP 4.0 Server (http:∥www.cbs.dtu.dk/services/signalp);跨膜結構域預測:TMHMM Server2.0 (http:∥www.cbs.dtu.dk/services/TMHMM);氨基酸基本功能位點分布預測:SoftBerry-Psite (http:∥linux1.softberry.com/berry.phtml?topic=psite&group=programs&subgroup=proloc Inter Proscan);蛋白功能結構域分析:Inter ProScan Sequencesearch (http:∥www.ebi.ac.uk/Tools);二級結構、三維結構預測分析:SOPMA (https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISSM-MODEL (http:∥swissmodel.expasy.org/inter active);鄰接法構建系統進化樹:Clustal X 和MEGA 6.0 軟件,利用MEGA 6.0 采用鄰位相連法構建CD2-like系統進化樹。
1.2.5 原核表達載體的構建
提取測序正確的重組質粒和pGEX-6P-1表達質粒,經EcoR Ⅰ和Xho Ⅰ進行雙酶切后,用T4連接酶和CD2-like胞外區片段的酶切產物連接,而后轉化至大腸桿菌BL21感受態細胞,并于搖床上以37 ℃、200 r/min條件培養1 h。用含有Amp+的LB平板篩選結合菌落,挑取單菌落進行PCR鑒定,將陽性克隆重組質粒送廣州生物工程有限公司測序。
1.2.6 誘導表達重組蛋白
將測序正確的重組質粒命名為pGEX-6P1-CD2L,并將含有表達載體的大腸桿菌BL21以1∶100數量比例接種于Amp+的LB液體培養基中,在37 ℃的搖床200 r/min 擴大培養至600 nm光密度值(D600)達0.4~0.6時加入IPTG,使其終濃度為1 mmol/L,繼續培養6 h。菌體預處理后進行超聲破碎獲取全菌蛋白,程序設置為:200 W條件下破碎4 s,間隔6 s,破碎時間為10 min。直至菌液變清,離心,收集上清液和沉淀后經SDS-PAGE 分析。
1.2.7 重組蛋白表達的條件優化
(1)IPTG濃度:在確定溫度為37 ℃,誘導時間為6 h的條件下,設置IPTG濃度分別為0、0.2、0.4、0.8、1.2、1.6 mmol/L,收集菌體,用SDS-PAGE電泳分析蛋白表達情況。采用解離非連續緩沖系統垂直板電泳。丙烯酰胺體積分數:分離膠10%,濃縮膠5%。每孔上樣10 μL,濃縮膠以80 V電壓通電30 min,分離膠以120 V電壓通電1 h,染色,脫色。
(2)時間:在確定溫度為37 ℃,IPTG誘導濃度為0.2 mmol/L的條件下,誘導2、4、6、8、10 h分別收集菌體,用SDS-PAGE電泳分析蛋白表達情況。
(3)溫度:IPTG濃度為1.0 mmol/L,在18、28、37 ℃條件下誘導6 h,離心后置于冰上進行超聲破碎,程序設置為:200 W條件下破碎4 s,間隔6 s,破碎時間為10 min,直至菌液變清,離心,收集上清液和沉淀,以SDS-PAGE電泳分析目的蛋白的表達量。
1.2.8 變性條件下重組蛋白的表達、復性以及純化
根據重組蛋白表達的條件優化結果,利用含有Amp+的500 mL 營養肉湯液體培養基對活化后的目的菌種進行大量原核表達,將經原核表達的菌種分次加入50 mL離心管,離心收集菌體。
(1)目的菌體的收集:收集好細菌沉淀后,每克細菌沉淀濕質量加入2~5 mL的破碎緩沖液(50 mmol/L Tris-HCl pH 8.0內含150 mmol/L氯化鈉、1 mmol/L苯甲基磺酰氟),并加入500 mmol/L溶菌酶至終質量濃度為1 mg/mL,混勻,冰浴30 min。隨后冰上進行超聲破碎,200 W條件下超聲6 s、間隔 8 s,至懸液半透明。
(2)包涵體收集清洗:于4000 r/min轉速下4 ℃離心50 min,棄上清液,用破碎緩沖溶液重懸沉淀并將懸液再次于4000 r/min轉速下4 ℃離心50 min,棄上清液后往沉淀中加入洗滌液(50 mmol/L Tris-HCl pH 8.0,內含2 mol/L尿素、1 mmol/L乙二胺四乙酸、0.5% Triton X-100、0.1 mol/L氯化鈉以及10 mmol/L二硫蘇糖醇),4000 r/min,4 ℃離心10 min后收集沉淀。
(3)包涵體的稀釋復性:將洗滌后的包涵體沉淀,加入變性液(50 mmol/L Tris-HCl pH 8.0,含8 mol/L尿素、20 mmol/L二硫蘇糖醇)進行過夜變性溶解;次日,將溶解后的包涵體溶液加入復性液(50 mmol/L Tris-HCl pH 8.0,含0.5 mmol/L乙二胺四乙酸、50 mmol/L氯化鈉、5%甘油、1 mmol/L二硫蘇糖醇)并按照2倍體積倍比進行梯度稀釋復性,直至稀釋到尿素終濃度達到 0.5 mol/L;最后利用截留分子質量為10 ku的超濾濃縮管濃縮復性后的溶液。
(4)復性后包涵體的純化:此后與以8∶1體積比例的谷胱甘肽瓊脂糖樹脂勻漿混合,4 ℃旋轉30 min,于4000 r/min離心5 min后棄上清液。沉淀加入10倍于柱床體積的漂洗液(Tris-HCl pH 8.0)反復顛倒混勻以洗去未與谷胱甘肽瓊脂糖樹脂結合的雜蛋白,于離心機4 ℃,500 r/min離心5 min后棄上清液,重復3次;加入等柱床體積的洗脫緩沖液(50 mmol/L Tris-HCl pH 8.0,內含10 mmol/L谷胱甘肽)重懸樹脂,室溫孵育10 min 后于4000 r/min離心5 min保留上清液;再用等體積的洗脫緩沖液洗脫并離心后合并2次所得上清液,即為純化得到的谷胱甘肽(GST)融合蛋白;取40 μL該蛋白溶液與6×Loading buffer,以體積比1∶5混勻,煮沸5 min后離心收集上清液,進行SDS-PAGE,觀察蛋白純化情況。
2 結果與分析
2.1 尼羅羅非魚CD2-like基因的克隆及理化性質
克隆獲得尼羅羅非魚CD2分子同源類似物,并命名為OnCD2-like(GenBank登錄號為:MN296489),開放閱讀框為1110 bp,其中胞外區長558 bp,可編碼369個氨基酸(圖1)。理論分子質量41.53 ku,理論等電點(PI)為9.76。使用Signal P 4.1 Server 預測該序列的信號肽,發現前29個氨基酸為信號肽序列;利用TMHMM Server v. 2.0在線網站預測發現,OnCD2-like蛋白的第1~215位氨基酸位于細胞外,第242~369位氨基酸位于細胞內,而216~241位氨基酸為跨膜結構域(圖2)。SoftBerry-Psite預測該序列功能位點,發現該序列N-糖基化位點有3個,腺苷一磷酸和環磷鳥嘌呤核苷依賴性蛋白激酶磷酸化位點3個,蛋白激酶C磷酸化位點有9個,酪蛋白激酶Ⅱ磷酸化位點2個,N-豆蔻酰化位點2個,原生質膜脂筏附著位點2個,CAAX box 3個,C末端定位信號序列微體4個。

圖1 OnCD2-like基因序列及其推導氨基酸序列Fig.1 Sequence and deduced amino acid sequence of OnCD2-like gene“”表示信號肽; “----”表示免疫球蛋白樣結構域(38~101); “”表示免疫球蛋白樣結構域(126~197); “”表示富含脯氨酸結構域(230~369).“”stands for signal peptide; “----” stands for immunoglobulin-like domain (38—101); “” stands for immunoglobulin-like domain (126—197); “” stands for proline-rich domain (230—369).
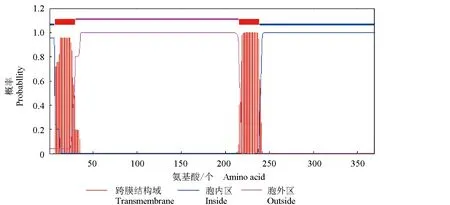
圖2 OnCD2-like跨膜結構域的預測Fig.2 Predicted transmembrane domain of CD2-like protein in tilapia
ProtParam在線分析結果顯示,推測賴氨酸(Lys)占比為8.7%;谷氨酰胺(Gln)為8.1%;蛋氨酸(Met)為0.8%。其中帶正電荷的氨基酸殘基(Arg+Lys)有55個,帶負電荷的氨基酸殘基(Asp+Glu)有31個。不穩定指數為44.60,歸類為不穩定蛋白。該蛋白脂溶指數為66.83,總平均親水值為-0.799,很有可能是親水蛋白。ProtScale分析表明,OnCD2-like蛋白親水性氨基酸占比較高,親水區域較大,為親水性蛋白,與理化分析的結果一致。因此推測On-CD2-like基因編碼的蛋白質為親水性蛋白。
2.2 OnCD2-like二級結構和三級結構預測
通過SOPMA分析OnCD2-like的二級結構(圖3),發現該蛋白二級結構中存在:由56個氨基酸組成的α螺旋,占15.18%;由15個氨基酸組成的β轉角,占4.07%;由85個氨基酸組成的延伸鏈,占23.01%;由213個氨基酸組成的無規則卷曲結構,占57.72%。利用SWISS-MODLE在線預測蛋白質三級結構工具分析發現,OnCD2-like屬于免疫折疊蛋白,能夠與人類CD2分子高度重合,表明OnCD2-like與人類CD2分子結構具有一定相似性(圖4)。
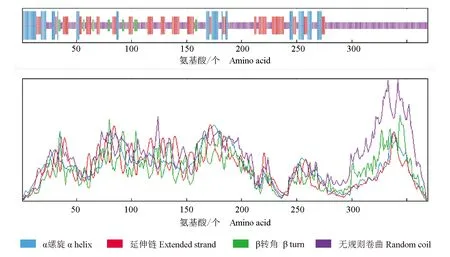
圖3 OnCD2-like二級結構預測Fig.3 The prediction of secondary structure of OnCD2-like
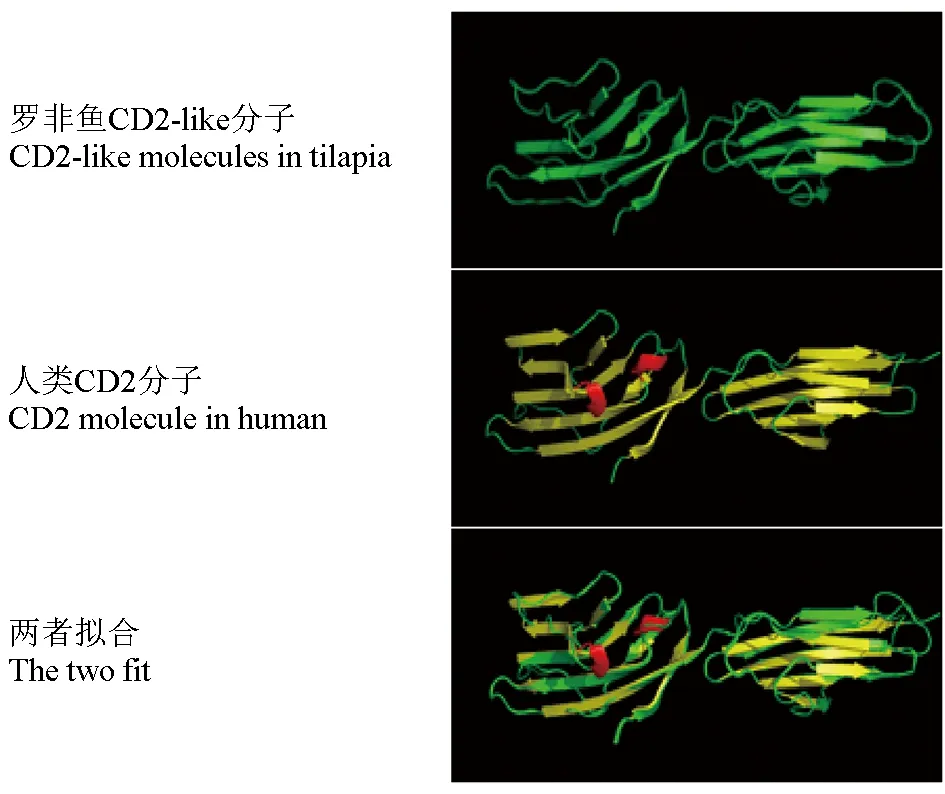
圖4 OnCD2-like蛋白與人類CD2蛋白三維結構Fig.4 The three-dimensional structures of CD2-like protein in tilapia and CD2 in Homo sapiens
2.3 OnCD2-like系統進化分析
本研究基于OnCD2-like氨基酸序列以及斑馬擬麗魚(Maylandiazebra)、多刺棘光鰓鯛(Acanthochromispolyacanthus)、眼斑雙鋸魚(Amphiprionocellaris)、高山倭蛙(Nanoranaparkeri)、原雞(Gallusgallus)、家鼠(Musmusculus)、家牛(Bostaurus)和人(Homosapiens)等的相關數據,在MEGA 6.0軟件中采用鄰接方法構建系統進化樹。分析該進化樹發現,尼羅羅非魚和同屬鱸形目慈鯛科的斑馬魚親緣關系最為相近,且聚為一支;其次與同屬鱸形目的泰國斗魚(Bettasplendens)親緣關系也較相近,與其他哺乳動物親緣關系則相對較遠(圖5)。
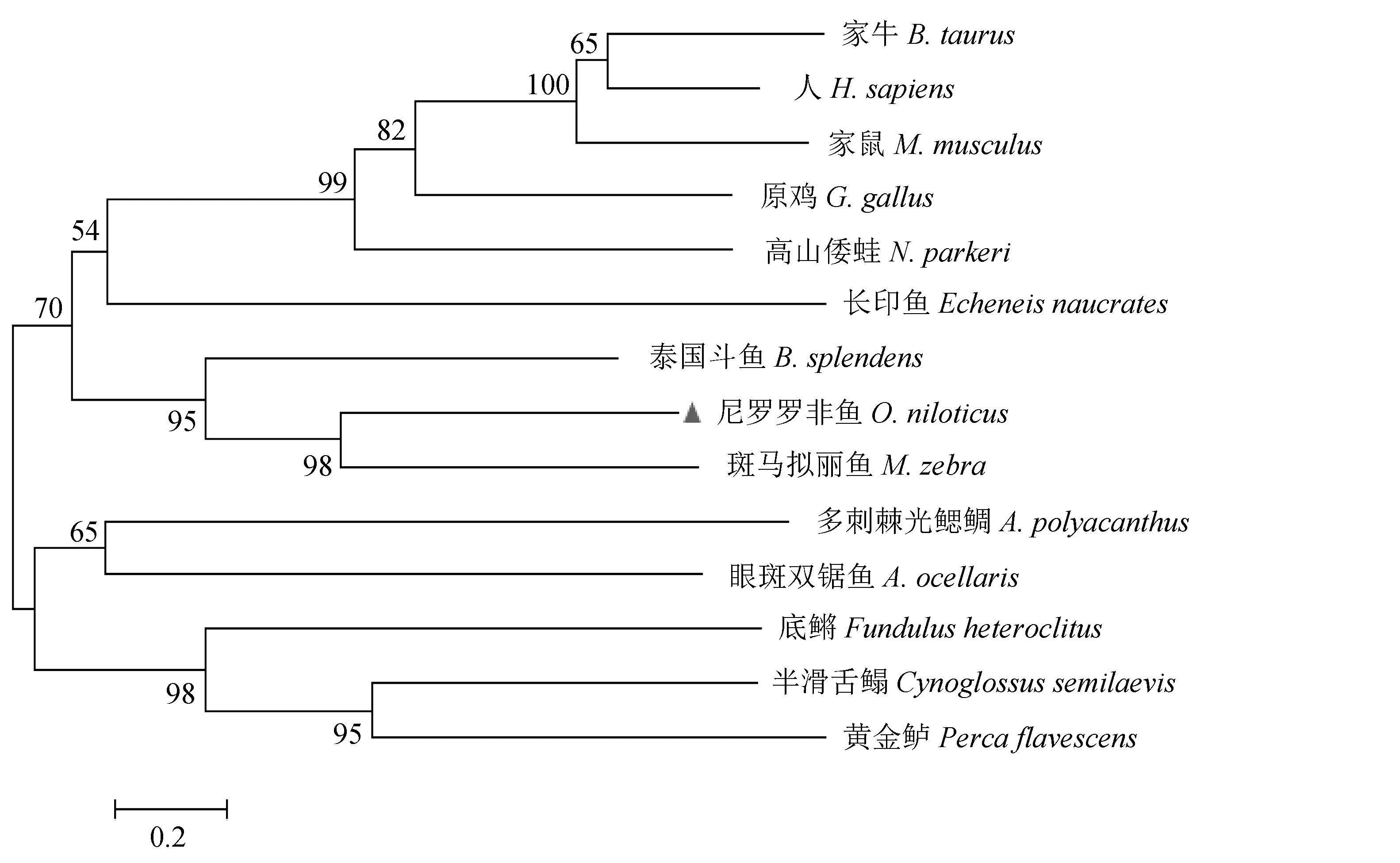
圖5 OnCD2-like氨基酸序列系統進化樹Fig.5 Phylogenetic tree of CD2-like amino acid sequence of tilapia
2.4 OnCD2-like胞外區原核表達
根據OnCD2-like基因設計引物,克隆獲取該基因胞外段(G88~A645),并成功構建pGEX-6P1-CD2L原核表達載體。原核表達結果顯示,未誘導的菌株前后均未出現目的蛋白,重組蛋白主要在包涵體中表達(圖6a),pGEX-6P1-CD2L融合蛋白分子質量約為46 ku,OnCD2-like胞外區片段蛋白分子質量約為20 ku。隨后原核表達條件摸索試驗結果顯示,濃度為0.2 mmol/L的IPTG即可誘導目的蛋白高效表達(圖6b);2~10 h目的蛋白的表達量增加,6 h后表達量增加不明顯(圖6c);重組蛋白GST-CD2-like融合蛋白在18、28、37 ℃的包涵體蛋白中均有表達,在37 ℃條件下蛋白表達量較高(圖6d)。
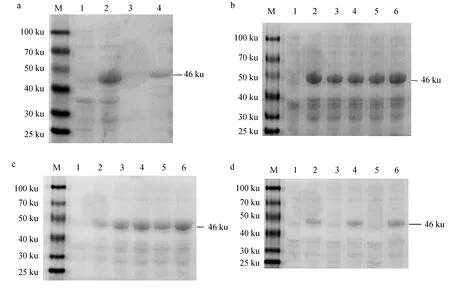
圖6 GST-CD2-like融合蛋白表達及其條件優化SDS-PAGE分析Fig.6 Expression protein and SDS-PAGE analysis of optimized conditions in GST-CD2-like fusiona:M.全式金蛋白分子標準; 1.未經IPTG誘導的全菌蛋白; 2.經IPTG誘導的全菌蛋白; 3、4.經IPTG誘導的上清液、沉淀重組蛋白表達. b:M.全式金蛋白質分子標準; 1.未經IPTG誘導的全菌蛋白; 2~6. IPTG誘導濃度分別為0.2、0.4、0.8、1.2、1.6 mmol/L 誘導后的全菌蛋白. c:M.賽默飛世爾蛋白質分子標準; 1.未誘導的全菌蛋白; 2~6.全菌蛋白誘導時間分別為2、4、6、8、10 h. d:M.全式金蛋白質分子標準; 1~2.對照組未誘導及18 ℃誘導; 3~4.對照組未誘導及28 ℃誘導; 5~6.對照組未誘導及全菌蛋白.a: M.Trans protein molecular marker; 1.whole bacterial protein without IPTG inducing; 2.whole bacterial proteinr with IPTG inducing; 3,4.supernatant and precipitated recombinant protein expression with IPTG inducing. b: M.Trans protein molecular marker; 1.whole bacterial protein without IPTG inducing; 2—6.total protein of recombinant bacteria induced by 0.2, 0.4, 0.8, 1.2, and 1.6 mmol/L IPTG. c: M.Thermo Fisher protein molecular marker; 1.the recombinant bacteria without IPTG inducing; 2—6.total protein of recombinant bacteria inducing at 2, 4, 6, 8 and 10 h, respectively. d: M.Trans protein molecular marker; 1—2.the recombinant bacteria without IPTG inducing and inclusion body protein induced at 18 ℃; 3—4.the recombinant bacteria without IPTG inducing and inclusion body protein induced at 28 ℃; 5—6.the recombinant bacteria without IPTG inducing and inclusion body protein.
2.5 包涵體中GST-CD2-like融合蛋白的變性、復性與純化
在包涵體蛋白復性純化過程中分別選取經洗滌液洗滌后、復性后和純化洗脫后3個不同階段的蛋白樣品進行SDS-PAGE電泳(圖7)。結果顯示,CD2-like融合蛋白表達含量高(圖7泳道1);當蛋白溶液被復性液等濃度梯度稀釋至尿素終濃度為0.5 mol/L(即相當于稀釋16倍)時,GST-CD2-like融合蛋白仍然保持可溶,盡管復性后蛋白存在部分降解,但依舊有相當一部分結構完整的GST-CD2-like融合蛋白保留(圖7泳道2);將復性濃縮后的融合蛋白利用谷胱甘肽瓊脂糖樹脂進行親和層析純化,潤洗去除雜蛋白后最終用10 mmol/L還原型谷胱甘肽溶液進行目標蛋白的洗脫,得到目的融合蛋白(圖7泳道3),并且將洗脫液洗脫后的融合蛋白與標簽蛋白進行SDS-PAGE電泳(圖8)。綜上所述,本研究成功地在變性條件下,通過純化復性獲取了目的蛋白。
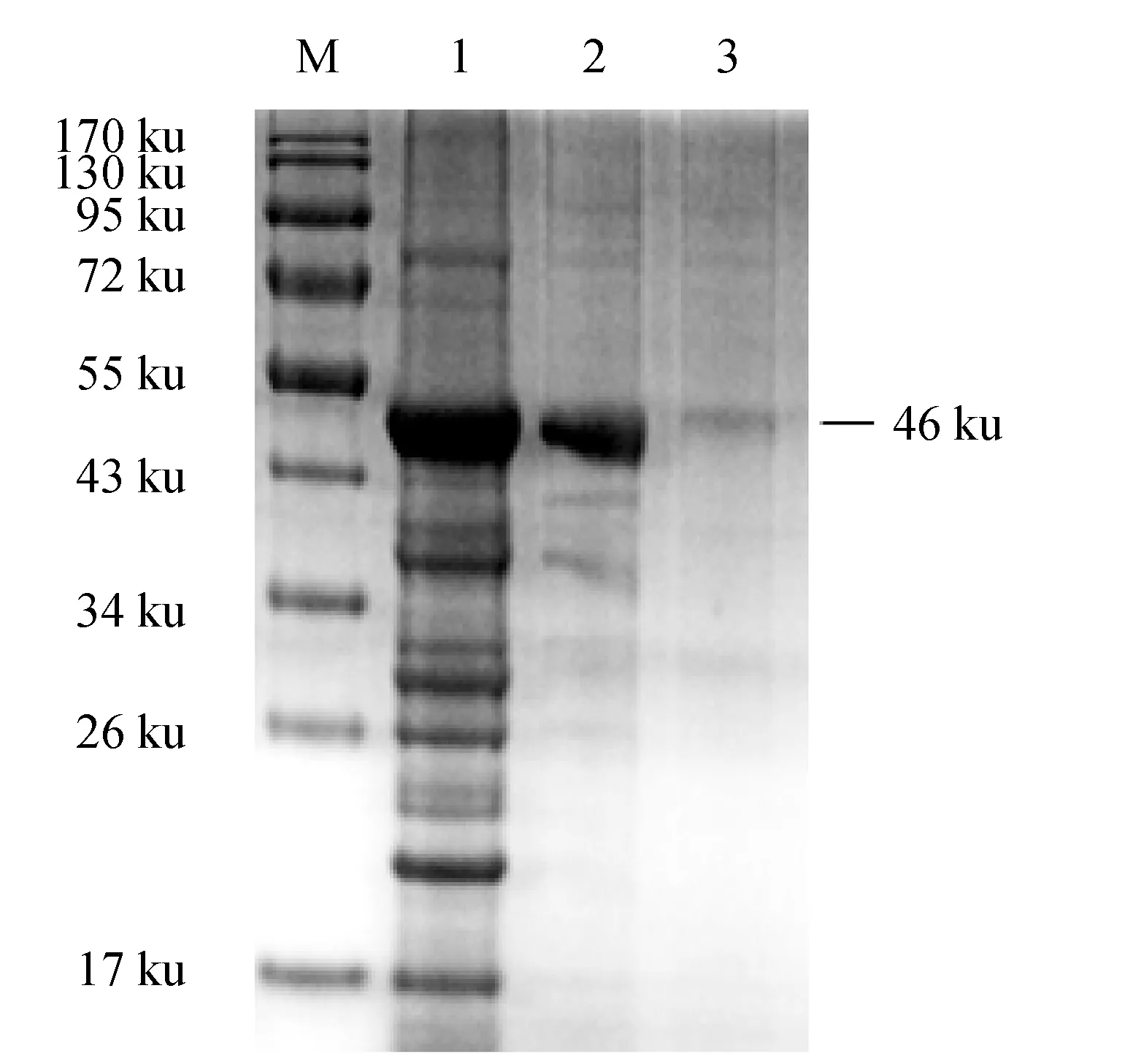
圖7 GST-CD2-like融合蛋白變性、復性與純化等產物SDS-PAGE分析Fig.7 SDS-PAGE of denaturation, renaturation and purification of GST-CD2-like recombinant protein M.蛋白質分子標準; 1. 2 mol/L 尿素溶解后包涵體全菌蛋白; 2.梯度稀釋復性后經10 ku濃縮管濃縮后的全菌蛋白; 3.谷胱甘肽瓊脂糖樹脂純化后的GST-CD2-like融合蛋白.M.protein molecular marker; 1.inclusion body whole bacterial protein after 2 mol/L urea dissolution; 2.whole-bacterial protein after concentration and renaturation in a 10 ku concentrating tube; 3.GST-CD2-like-I fusion protein by glutathione agarose resin purification.
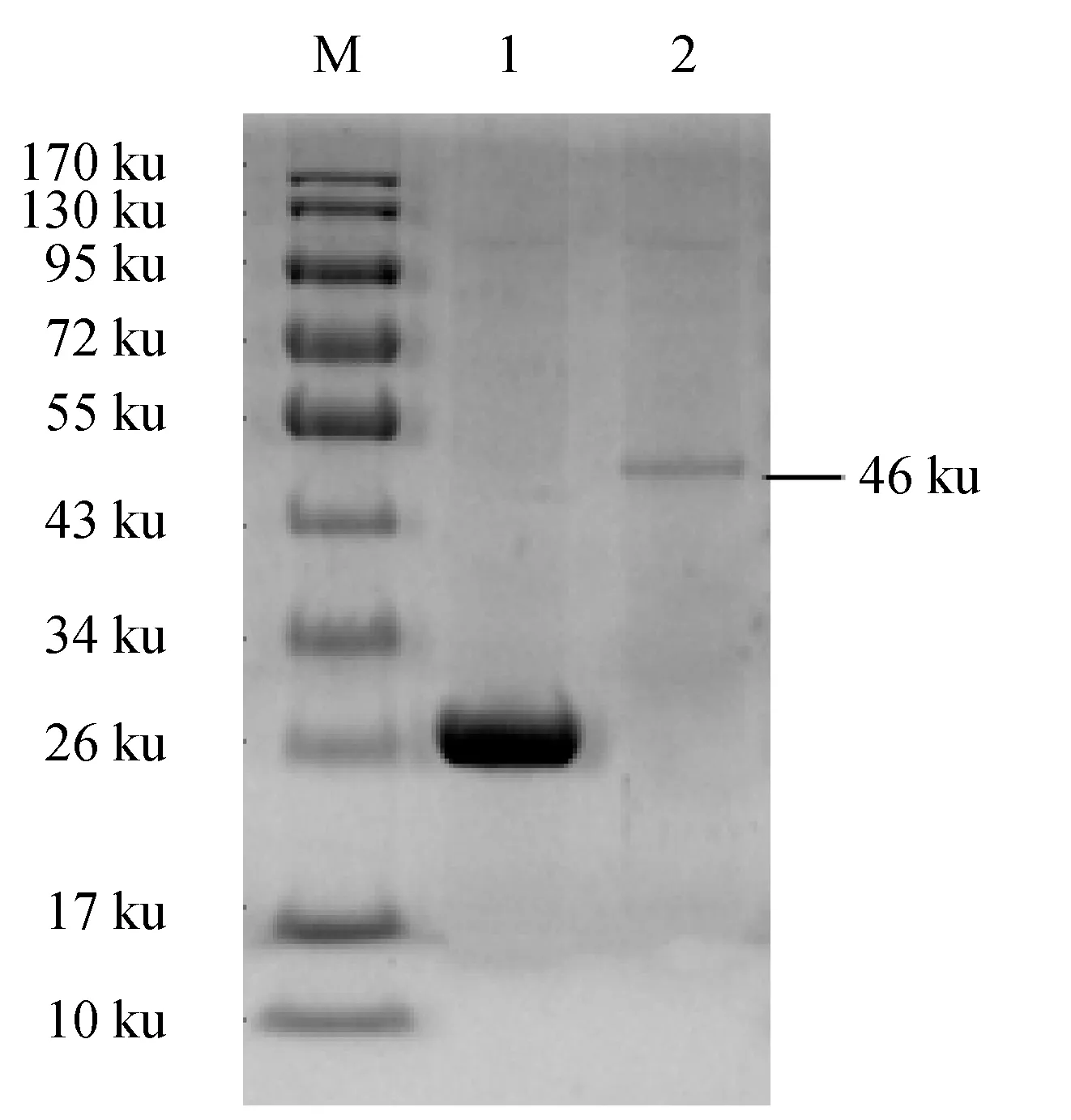
圖8 重組蛋白pGEX-6P1-CD2L SDS-PAGE分析Fig.8 Identification of GST-CD2-like recombinant proteins by SDS-PAGEM.蛋白質分子標準; 1.經IPTG誘導的GST標簽蛋白; 2.純化后的包涵體蛋白SDS-PAGE結果.M.protein molecular marker; 1.GST-tagged protein with IPTG inducing; 2.SDS-PAGE results of purified inclusion body protein.
3 討 論
T淋巴細胞激活需要兩組信號:一是通過T淋巴細胞上的T淋巴細胞抗原受體(TCRs)與抗原肽—主要組織相容性復合體(p-MHC)結合提供刺激信號;二是通過T淋巴細胞上的共刺激受體與抗原提呈細胞上的配體的相互作用提供信號。CD2是能夠傳遞共刺激信號最具特征的受體之一,主要是在T淋巴細胞和自然殺傷細胞表面表達的一種細胞表面糖蛋白,在刺激T淋巴細胞的活化與細胞黏附方面起著重要作用[14-15]。近年來,相關研究表明,多種哺乳動物中存在CD2,其結構以免疫功能等的相關研究較多[16-18];在哺乳動物中,CD2可以作為共刺激分子發揮作用,促進白細胞介素2(IL-2)的產生,IL-2是促進T淋巴細胞增殖分化的最重要的細胞因子;同時在自然殺傷細胞上的CD2也是介導效應靶結合形成的重要因子,并通過z鏈傳遞下游信號,引起細胞毒性顆粒的胞吐作用[19-21]。但迄今為止對于魚類CD2的研究較少,目前在硬骨魚類中CD2基因克隆鑒定研究僅見銀鯽(Carassiusauratusgibelio)[22]、斑點叉尾(Ietaluruspunetaus)[23]以及尼羅羅非魚[24]等少數硬骨魚,對魚類CD2表達譜及功能特性的研究也相對有限。已有研究表明,CD2可能在尼羅羅非魚細胞內細菌的免疫應答中發揮重要作用[24]。
3.1 OnCD2-like基因序列結構分析
依據預測序列,對尼羅羅非魚CD2分子同源類似物進行克隆鑒定,獲得OnCD2-like基因全長為1110 bp,可以編碼369個氨基酸。預測發現,該蛋白序列含有1個信號肽區域和2個免疫球蛋白樣結構域。此外,通過SoftBerry-Psite在線預測,發現該分子胞外區還具有2個蛋白激酶C磷酸化位點(氨基酸位點:129~131,168~170),這暗示著位于該蛋白胞外區具有完整的抗原結合位點,對于抗原信息傳遞具有重要作用。通過InterPro 在線軟件分析OnCD2-like氨基酸序列中的保守結構域發現,胞質尾區富含脯氨酸結構域(230~369),已有研究證明,該結構域在鼠與人之間有著顯著的同源性,表現出較高的保守性[25]。綜上所述,基于相關的保守結構域和位點較為保守推測,OnCD2-like蛋白功能保守。
3.2 OnCD2-like胞外區蛋白
原核表達結果顯示,重組蛋白大部分以包涵體形式存在,并且在37 ℃下,0.2 mmol/L的IPTG誘導6 h時,包涵體蛋白表達量最高。在原核表達過程中,為求目的蛋白以高翻譯率表達而進行高溫、高誘導濃度誘導蛋白表達,但導致細菌蛋白質質量控制系統耗竭,引起部分折疊或錯誤折疊的蛋白分子聚集而形成包涵體[26]。包涵體蛋白是非正確折疊狀態的聚集體,不具有生物學活性[27]。鑒于OnCD2-like胞外區蛋白多以包涵體形式存在,如果能成功對表達出的目標蛋白進行變性溶解和復性純化,將有利于蛋白的純化以及純度的提高,從而為后續的蛋白功能研究奠定基礎。因此,筆者決定在變性條件下對OnCD2-like胞外區包涵體蛋白進行純化復性。
3.3 OnCD2-like胞外區蛋白梯度稀釋復性
本研究中采用的包涵體復性方法為梯度稀釋復性,梯度稀釋的方法可以為蛋白提供充分的復性時間,促使蛋白質緩慢發生變化以適應外環境,這有利于蛋白與復性液充分結合,從而獲取大量復性后的目的蛋白。透析復性也是包涵體復性常用的方法,然而相較于梯度稀釋復性,透析復性可能會因緩沖液交換過程中尿素去除過快,導致蛋白大量析出而出現大量絮狀沉淀,不利于后續的蛋白功能研究[28]。故此,通過比較上述兩種方法,本研究中采用了梯度稀釋復性方法進行。GST-CD2-like融合蛋白經梯度稀釋復性后,得到目的蛋白條帶單一,無雜蛋白條帶存在,表明梯度復性純化方法純化了目標蛋白且高效可行。本研究在變性條件下探究了該OnCD2-like分子胞外區包涵體蛋白的純化方法,這不僅為包涵體蛋白的純化復性方法提供了參考,也為進一步研究尼羅羅非魚CD2分子在先天免疫中的功能作用奠定了基礎。
4 結 論
本研究成功克隆OnCD2-like基因,全長1110 bp,其中胞外區長558 bp,可編碼369個氨基酸。生物信息學分析顯示,OnCD2-like基因序列結構中含有信號肽區域1個、免疫球蛋白樣結構域2個、跨膜結構區以及富含輔氨酸胞質尾區各1個;通過免疫球蛋白結構域及富含輔氨酸的胞質尾區所具有的結構證明,該分子具有較高的保守性。OnCD2-like系統進化樹分析顯示,尼羅羅非魚與斑馬擬麗魚聚為一支;三級結構預測結果顯示,OnCD2-like基因所編譯的蛋白與人類CD2蛋白具有相似性。原核表達條件優化為:37 ℃條件下,0.2 mmol/L IPTG誘導6 h,依據最佳條件通過梯度稀釋復性的方法成功純化出OnCD2-like胞外區蛋白。

