尖孢鐮刀菌對人參皂苷的動態響應機制
吉世禹, 孫 茹, 馮 琳, 孫天霞, 閆茹月, 趙 雨, 連文慧
(長春中醫藥大學 人參科學研究院, 長春 130117)
0 引 言
人參(PanaxginsengC.A.Meyer)是五加科人參屬植物的干燥根, 是我國傳統的名貴中藥材, 人參皂苷(Ginsenoside)是人參的主要活性成分, 具有抗腫瘤、 抗炎、 安神益智、 增強免疫力等藥理活性[1-3]. 人參皂苷大多數屬于達瑪烷型皂苷, 根據C6位上是否有羥基, 可將人參皂苷分為原人參二醇型皂苷(如Rb1,Rb2和Rd)和原人參三醇型皂苷(如Rg1和Re)兩種類型, 由于兩類皂苷結構存在差異, 因此其具有不同的生物活性[4]. 如原人參三醇型皂苷Rg1可刺激促炎細胞因子釋放, 但原人參二醇型皂苷Rb1對相同促炎介質有顯著的抑制作用[5-6].
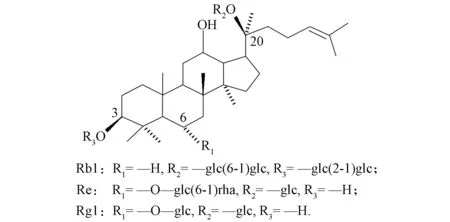
圖1 3種人參皂苷的分子結構Fig.1 Molecular structure of three ginsenosides
人參的生長周期長, 易受病菌感染[7]. 人參根腐病是最常見且危害最嚴重的一種土傳性真菌病害, 其主要病原菌是腐皮鐮刀菌(Fusariumsolani)和尖孢鐮刀菌(Fusariumoxysporum)[8]. 尖孢鐮刀菌是一種世界性分布的病原真菌, 寄主范圍廣泛, 致病能力強, 已成為第三大土傳性病原真菌. 病原菌的致病機制復雜, 可產生對寄主正常生理活動有害的代謝產物, 如酶、 毒素、 生長調節物質等, 誘發寄主產生病變[9]. 高等植物可產生具有抑菌作用的次生代謝產物, 能夠抑制真菌的孢子萌發和生長發育[10]. 皂苷是一類植物次生代謝物, 研究表明, 皂苷具有殺菌活性, 是植物抵御病原真菌侵襲的防御物質[11-12], 能夠為燕麥和番茄抵制真菌感染提供化學防御[13].人參皂苷是人參根部的主要次生代謝產物, Nicol等[14]研究表明, 人參皂苷具有抗真菌活性, 莖葉總皂苷可通過改變菌體細胞膜通透性、 誘導菌體 內的蛋白質和內含物流出, 從而起到抑制腐皮鐮刀菌活性的作用[15]. 目前, 關于人參皂苷對尖孢鐮刀菌響應變化的研究報道較少. 為確定人參皂苷的質量比是否受尖孢鐮刀菌侵入的影響及人參抗性系統中化學響應的作用, 本文研究人參皂苷Rb1,Re,Rg1(圖1)感染尖孢鐮刀菌后的質量比變化, 通過測定人參皂苷對尖孢鐮刀菌分生孢子萌發的影響, 確認人參皂苷Rb1可對尖孢鐮刀菌病原體的攻擊做出化學響應.
1 材料和方法
1.1 試劑和儀器
4年生人參(Panaxg.)購于吉林省撫松縣參王植保有限責任公司; 供試菌種由吉林農業大學楊利民教授分離并鑒定為尖孢鐮刀菌(Fusariumo.); 乙腈、 甲醇為色譜純試劑, 正丁醇等其他試劑為分析純試劑, 水為超純水; 人參皂苷Rb1,Rg1,Re標準品均購于上海源葉生物科技有限公司.
LC-2030型高效液相色譜儀(日本島津公司); EVOS FL Auto型熒光倒置顯微鏡(美國 Life公司); KQ-700DA型數控超聲波清洗器(昆山市超聲儀器有限公司); M28563細胞計數板(日本Watson公司).
1.2 方 法
1.2.1 孢子懸浮液的制備
固體培養基: 稱取37 g馬鈴薯葡萄糖瓊脂(PDA)培養基, 加入1 000 mL蒸餾水中, 加熱煮沸溶解, 分裝, 于121 ℃高壓滅菌15 min, 備用.
液體培養基: 稱取35 g馬鈴薯葡萄糖肉湯(PDB)培養基, 加入1 000 mL蒸餾水中, 加熱煮沸溶解, 分裝, 于121 ℃高壓滅菌20 min, 備用.
實驗前將菌株轉接于PDA平板上活化7 d, 取直徑為5 mm 的菌餅接種在PDB培養基中, 在搖床上28 ℃震蕩培養3~4 d, 用8層紗布過濾, 制成9×106cfu/mL的孢子懸浮液(cfu為菌落數), 備用.
1.2.2 人參根部的接種
將4年生健康鮮人參根洗凈, 去除支根、 須根和蘆頭, 制成約8 cm長的細根, 用體積分數為75%的乙醇浸泡5 min, 無菌水沖洗1次, 將每個人參根切成3個連續的部分: 上部(Part Ⅰ)未經處理, 作為空白組; 中部(Part Ⅱ)和下部(Part Ⅲ)用質量分數為5%的次氯酸鈉浸泡10 min, 無菌水沖洗3次, 無菌針扎傷, 將中部(Part Ⅱ)浸泡在無菌水中3 min作為對照組; 下部(Part Ⅲ) 浸泡在病原菌分生孢子懸浮液(9×106cfu/mL)中3 min作為實驗組. 將處理后的人參根段置于培養皿上, 培養皿底部放有濕潤的無菌濾紙(已滿足人參正常發病程度), 最后置于25 ℃無菌培養箱中培養, 每部分重復4次.
為檢測3種人參皂苷在侵染一段時間后的質量比, 分別在接種72,96,120 h對不同處理的根部進行取樣和拍照, 并將這些根段切成1 cm×1 cm×0.5 cm的小塊, 在45 ℃約干燥3 d, 直至獲得恒定的干質量.
1.2.3 人參皂苷的提取
將3組不同處理方法的人參根部研磨成粉末, 過60目篩, 精密稱取0.500 0 g人參粉, 用50 mL水飽和正丁醇提取, 超聲40 min, 過濾, 取25 mL濾液至蒸發皿中揮發干燥, 加入體積分數為50%的甲醇水溶液溶解, 定容至5 mL, 過0.22 μm有機濾膜后, 4 ℃保存, 備用.
1.2.4 高效液相色譜條件
色譜柱Agilent Eclipse Plus C18型(4.6 mm×150 mm, 5 μm), 流動相乙腈(A)和φ(H3PO4)=0.05%(B), 梯度洗脫: 0~18 min,φ(A)=21.5%; 18~26 min,φ(A)=21.5%~28%; 26~40 min,φ(A)=28%~34%; 40~42 min,φ(A)=34%~21.5%; 42~45 min,φ(A)=21.5%; 流速1.0 mL/min; 柱溫30 ℃; 檢測波長為203 nm; 進樣量10 μL.
1.2.5 尖孢鐮刀菌分生孢子的萌發
用不同質量濃度的人參皂苷Rb1,Rg1,Re溶液處理分生孢子, 測定不同人參皂苷對尖孢鐮刀菌分生孢子萌發的影響. 將3種人參皂苷溶于無菌蒸餾水中, 分別制成質量濃度分別為5,20 mg/mL的溶液, 將尖孢鐮刀菌分生孢子懸浮液加入不同質量濃度的人參皂苷溶液中, 對照組用無菌水處理, 25 ℃孵育24 h, 在顯微鏡下計數分生孢子的數量.
1.3 數據分析
采用SPSS13.0軟件進行數據統計分析, 并通過單因素方差分析對相關性指標進行顯著性檢驗, 當p<0.05時, 具有顯著性意義, 采用Graphpad Prism 6軟件繪圖.
2 結果與討論
2.1 尖孢鐮刀菌的形態
病原菌在PDA培養基上生長7 d, 可觀察到白色稀疏的菌絲體, 在顯微鏡下可觀察到許多分生孢子, 分生孢子相對較寬, 大型分生孢子呈鐮刀形, 孢子兩端稍尖, 長度約5~15 μm, 小型分生孢子呈卵形或腎形, 菌絲細長, 有隔膜, 如圖2所示.
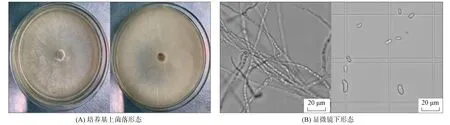
圖2 尖孢鐮刀菌菌落形態(A)及其在顯微鏡下的形態(B)Fig.2 Colony morphology (A) of Fusarium oxysporum and its morphology under microscope (B)
2.2 人參根部感染尖孢鐮刀菌的表觀分析
設置Part Ⅰ為空白組, Part Ⅱ為對照組, 這兩組處理不同時間的人參根部表觀狀態無明顯差別. Part Ⅲ為實驗組, 與空白組和對照組比較, Part Ⅲ在侵染72 h后人參根表面已有白色菌絲附著, 在侵染96 h后, 人參根部表面有大面積的白色菌絲, 并伴有輕微腐爛, 在侵染120 h后, 人參根部表面全部被白色菌絲包圍, 并伴有嚴重腐爛現象, 如圖3所示.
2.3 人參皂苷質量比的變化
利用HPLC測定健康人參根中3個不同部分皂苷的質量比, 其標準曲線方程列于表1. 健康人參的皂苷質量比如圖4所示. 由圖4可見, 人參皂苷Rb1,Rg1,Re在3個連續的根段中質量比基本相同.
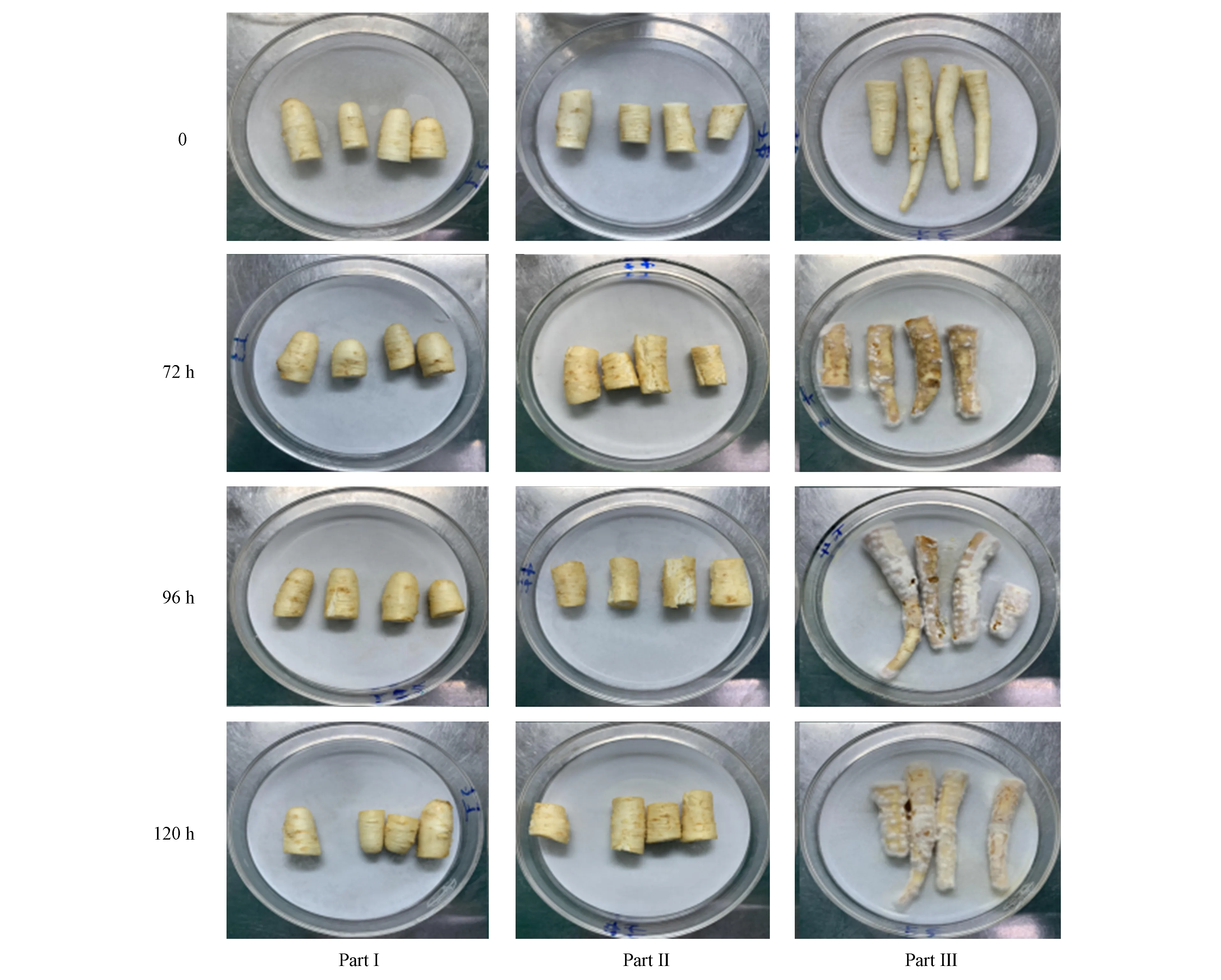
圖3 人參根部感染尖孢鐮刀菌的表觀形態Fig.3 Apparent morphology of ginseng root infected with Fusarium oxysporum

表1 HPLC分析3種人參皂苷的標準曲線方程、 回歸系數和線性范圍
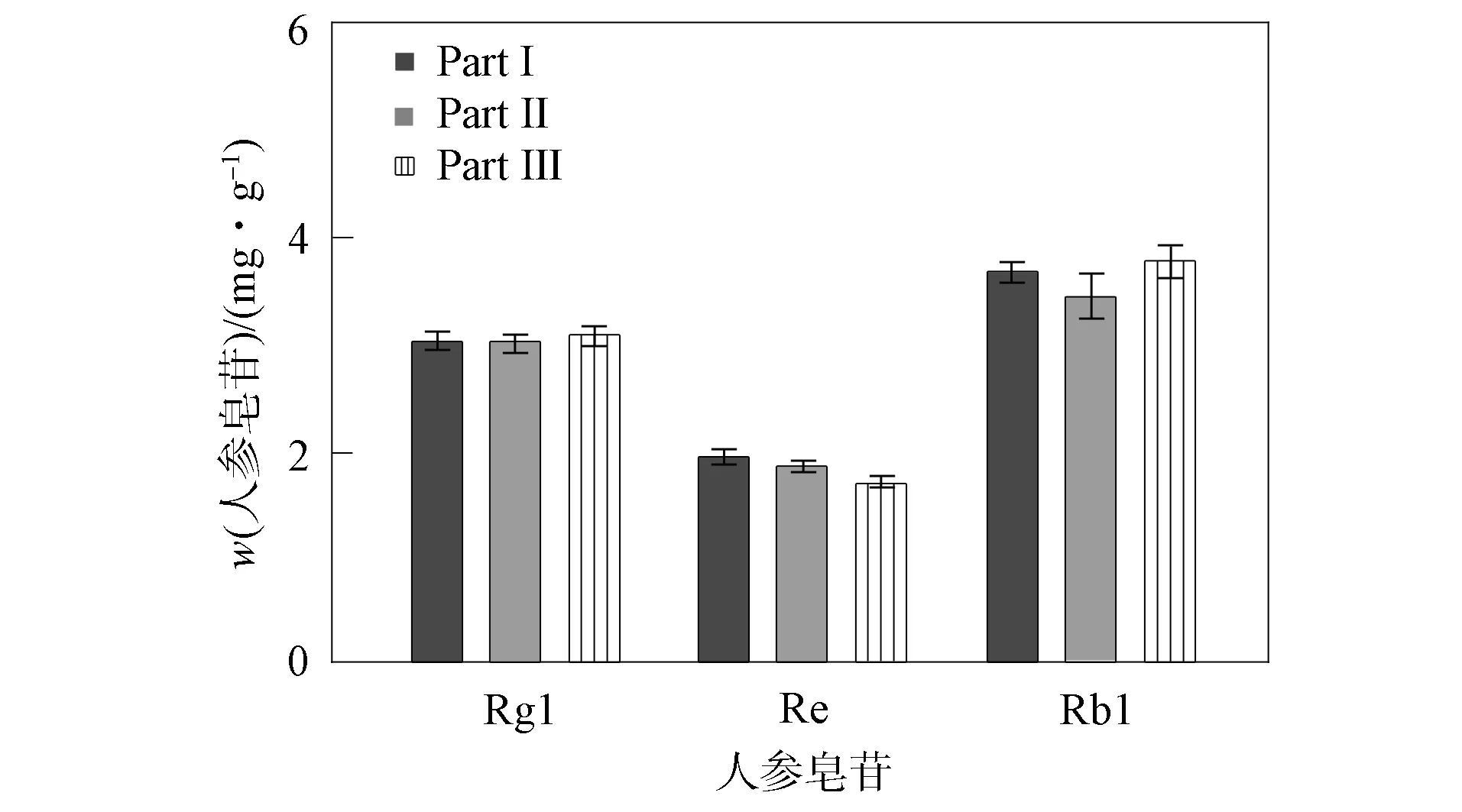
圖4 健康人參根部中3種人參皂苷的質量比Fig.4 Mass ratio of three ginsenosides in healthy ginseng roots
人參接種尖孢鐮刀菌后, 其根部不同部分中3種人參皂苷質量比隨時間的變化如圖5所示. 由圖5可見: 接種72 h時, 尖孢鐮刀菌組的Rg1質量比低于空白組但高于對照組; 接種96 h時, 尖孢鐮刀菌組的Rg1質量比顯著低于空白組和對照組; 接種120 h時, 3組間差異不顯著; 接種72 h時, 尖孢鐮刀菌組的Re質量比高于空白組和對照組; 接種96 h時, 尖孢鐮刀菌組的Re質量比低于空白組和對照組; 接種120 h時, 尖孢鐮刀菌組的Re質量比顯著高于空白組和對照組, 尖孢鐮刀菌組處于持續下降的趨勢; 接種72,96,120 h時, 尖孢鐮刀菌的Rb1質量比均高于空白組和對照組, 而接種尖孢鐮刀菌后, 人參根部的Rb1質量比顯著增加, 其中接種96~120 h時, 人參皂苷Rb1的質量比持續增加. 在72,96,120 h這3個時間點, 接種尖孢鐮刀菌組和空白組相比, 人參皂苷Rb1的質量比分別增加了6%,5%,24%, 接種尖孢鐮刀菌組和對照組相比, 人參皂苷Rb1的質量比分別增加了19%,11%,33%. 結果表明, 尖孢鐮刀菌介導的感染對人參根部Rg1,Re,Rb1質量比的影響不同. 接種尖孢鐮刀菌后, 人參皂苷Rg1的質量比基本保持不變, Re的質量比不斷降低, 而Rb1的質量比顯著增加.

圖5 人參根部接種尖孢鐮刀菌后人參皂苷質量比的變化Fig.5 Changes of mass ratio of ginsenoside in ginseng roots inoculated with Fusarium oxysporum
2.4 人參皂苷對孢子萌發的影響
根據上述實驗結果, 接種尖孢鐮刀菌后, 人參皂苷Rb1的質量比顯著增加, 推測Rb1在調節人參防御反應中起重要作用. 為驗證Rb1的作用, 研究了3種人參皂苷對尖孢鐮刀菌分生孢子萌發的影響, 結果如圖6所示. 由圖6可見: 3種人參皂苷中, 僅Rb1對尖孢鐮刀菌分生孢子有抑制作用, 其抑制率在低質量濃度時為81%、 高質量濃度時為46%, 可見Rb1質量濃度越大, 分生孢子的萌發率越低, 抑制率越高, 而不同質量濃度的Rg1和Re對尖孢鐮刀菌孢子萌發幾乎無抑制作用. 因此, Rb1可能是人參根產生的主要抗真菌病原體感染的人參皂苷.
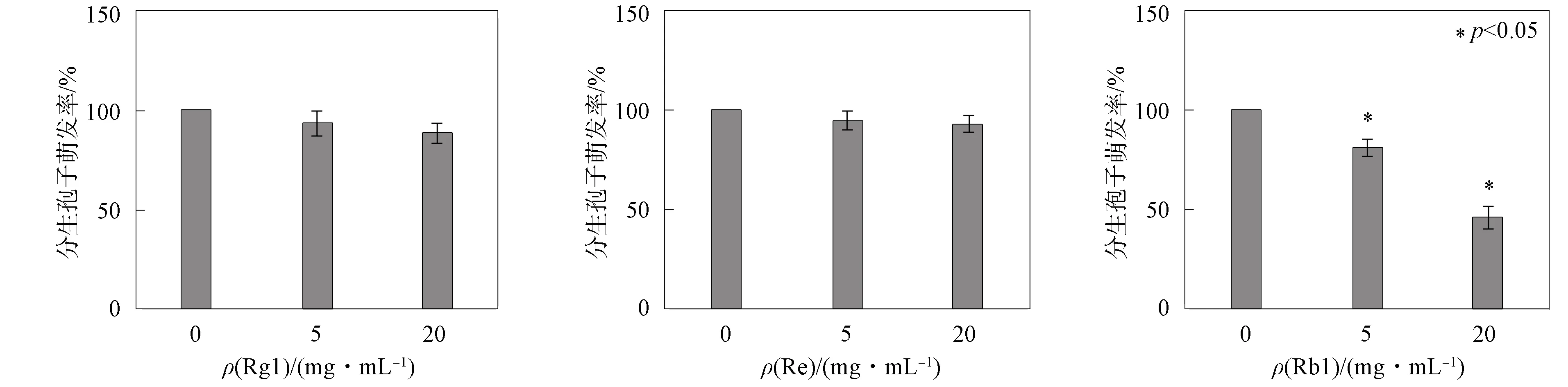
圖6 3種人參皂苷對尖孢鐮刀菌孢子萌發率的影響Fig.6 Effect of 3 ginsenosides on conidia germination rate of Fusarium oxysporum
綜上可見, 根腐病菌不僅影響植物根部的生長, 而且對植物體內化學物質水平也有一定影響[16]. 研究表明, 人參根部接種尖孢鐮刀菌后, 對人參根部3種人參皂苷Rb1,Rg1,Re的質量比具有不同影響: Rb1的質量比顯著增加; Rg1的質量比基本保持不變; Re的質量比不斷降低. Rb1是原人參二醇型皂苷, Rg1和Re是原人參三醇型皂苷, 因此推測可能是不同的化學結構導致其對病原菌侵染產生了不同響應. 人參皂苷Rb1的上調發生在尖孢鐮刀菌侵染人參根的早期階段, 僅Rb1對尖孢鐮刀菌分生孢子有明顯抑制作用, 表明Rb1可能是人參根中產生對尖孢鐮刀菌具有響應的抗病化合物.
下面分析人參皂苷結構對其抑菌活性的影響. 所選擇的3種人參皂苷具有相同的苷元和不同的糖殘基, 人參皂苷Rb1在C3和C20位上均含有糖鏈(圖1), Rb1顯著抑制了尖孢鐮刀菌分生孢子的萌發. 而Rg1和Re在C3位不含糖鏈, 僅在C20位上含有糖鏈, Rg1和Re對尖孢鐮刀菌孢子萌發的影響較小, 可見人參皂苷對尖孢鐮刀菌的抑制活性與C3位上是否有糖鏈相關. Rb1在人參根中具有最強的防御功能, Rg1和Re不具有化學抗性. 本文對人參的質量控制具有積極意義, 為更好地了解寄主與病原菌的相互作用及其對人參藥用價值的影響提供了理論依據.

