小魚際滾法對兔骨骼肌急性鈍搓傷組織機化期GDF-8/Smad2通路的影響
盧園 陳海南 楊舟 薛惠天 王蘭蘭 孫夢龍 彭亮


〔摘要〕 目的 觀察小魚際滾法干預新西蘭白兔骨骼肌急性鈍挫傷組織機化期的生長/分化因子8 (growth differentiation factor 8, GDF-8)表達、受體活化型通路限制性蛋白Smad2、Smad3的表達水平以及Smad2的磷酸化水平(p-Smad2),探究小魚際滾法干預骨骼肌急性鈍挫傷組織機化期的可能作用機制。方法 采用隨機數字表法將18只兔分為空白組、模型組、滾法組,每組6只。采用自制重力錘打擊裝置制備新西蘭白兔骨骼肌急性鈍挫傷模型,于造模后第5天進行干預,空白組和模型組進行捆綁,滾法組由經過專門培訓的專員進行小魚際滾法干預,皆為上午下午各1次,5 min/次,共3 d。干預結束后,觀察蘇木精-伊紅(hematoxylin-eosin, HE)染色組織形態學變化,采用蛋白質印跡法(Western blot, WB)檢測GDF-8、p-Smad2、Smad2/3蛋白相對表達量。結果 HE染色結果顯示,模型組的股四頭肌肌束間不規則結締樣組織明顯增多,肌纖維排列紊亂,數量減少、變小,滾法組存在少量結締組織,肌束排列緊密,肌纖維排列較為整齊,大小近似。WB檢測顯示,與空白組比較,模型組和滾法組的GDF-8表達都升高(P<0.01),滾法組表達水平低于模型組(P<0.01);Smad2/3在各組的蛋白表達一致(P>0.05);與空白組比較,模型組的p-Smad2蛋白表達、p-Smad2/Smad2/3的灰度比值都升高(P<0.01),滾法組均顯著低于模型組(P<0.01)。結論 小魚際滾法在兔急性鈍挫傷組織機化期可能通過抑制GDF-8/Smad2信號通路達到延緩組織纖維化、促進肌纖維生長以及加強骨骼肌修復的目的。
〔關鍵詞〕 骨骼肌損傷;鈍挫傷;推拿;小魚際滾法;GDF-8;Smad2
〔中圖分類號〕R244.1? ? ? ?〔文獻標志碼〕A? ? ? ?〔文章編號〕doi:10.3969/j.issn.1674-070X.2021.09.006
The Effects of Hypothenar Rolling Method on GDF-8/Smad2 in Tissue Mechanization
Stage of Acute Blunt Rubbing Injury in Skeletal Muscle of Rabbit
LU Yuan, CHEN Hainan, YANG Zhou, XUE Huitian, WANG Lanlan, SUN Menglong, PENG Liang*
(College of Acupuncture and Massage, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To investigate the effects of hypothenar rolling manipulation on the expression of growth differentiation factor 8 (GDF-8), receptor activated pathway limiting protein Smad2, Smad3, phosphorylation of Smad2 (p-Smad2) in skeletal muscle of New Zealand white rabbits during the tissue mechanization stage of acute blunt muscle contusion, and to explore the possible mechanism of hypothenar rolling in the intervention of skeletal muscle acute blunt trauma tissue during the tissue mechanization stage. Methods 18 rabbits randomly divided into blank group, model group, manipulation group according to random number table method, with 6 rabbits in each group. All rabbits except control group induced skeletal muscle acute blunt contusion model of New Zealand white rabbits by manufacture of self-made gravity hammer striking device. Different intervention methods were performed after 5th day. Blank group and model group were bundled, manipulation group was intervened by the specially trained specialists in the hypothenar rolling method, once in the morning and afternoon, 5 minutes/time for 3 days. After the intervention, hematoxylin-eosin (HE) staining was observed, and the relative protein expression levels of GDF-8, p-Smad2 and Smad2/3 were detected by Western blot (WB). Rseults HE staining results showed that the irregular connective tissue between the muscle bundles of the quadriceps femoris in the model group was significantly increased, and the muscle fibers were disordered, and the number was reduced or decreased. In the manipulation group, there was a small amount of connective tissue, the muscle bundles were closely arranged, and the muscle fibers were orderly and similar in size. WB assay showed that compared with blank group, GDF-8 expression was increased in both model group and manipulation group (P<0.01), while the expression level in manipulation group was lower than that in model group (P<0.01). The protein expression of Smad2/3 was consistent in all groups (P>0.05). Compared with blank group, p-Smad2 protein expression and p-Smad2/Smad2/3 gray ratio in model group were increased (P<0.01), while manipulation group was significantly lower than model group (P<0.01). Conclusion The hypothenar rolling method may delay tissue fibrosis, promote muscle fiber growth and enhance skeletal muscle repair by inhibiting GDF-8/Smad2 signaling pathway during the tissue mechanization stage of acute blunt contusion in rabbits.
〔Keywords〕 muscle injury; blunt injury; Tuina; hypothenar rolling manipulation; GDF-8; Smad2
骨骼肌大約占人體質量的40%,為運動系統提供動力。骨骼肌急性損傷后一般需經歷炎癥期、組織機化期(肌衛星細胞增殖分化期)和瘢痕期。骨骼肌修復階段防止其過度纖維化是損傷后康復的關鍵,成肌細胞增殖分化期在其中起到重要作用[1-3]。生長/分化因子8(growth differentiation factor 8, GDF-8)又稱為肌肉生長抑制素(myostatin, MSTN),是轉化生長因子-β(transforming growth factor-β, TGF-β)超家族中重要成員,由骨骼肌分泌,在肌肉中特異性表達,是肌肉生長的重要負性調節因子。TGF-β成員(TGF-β1和MSTN)通過不同的途徑[4-6]激活Smad家族蛋白中受體活化型通路限制性蛋白Smad2和Smad3進而發揮作用。研究[7-10]證明,推拿按摩干預急性鈍挫傷后的實驗動物,可以有效抑制TGF-β、Myostatin-Smad2/3等通路,減少Smad2/3、GDF-8等表達,降低其活性,以進一步達到幫助骨骼肌恢復、防止其過度纖維化的目的。艾玨萍等[11]認為,小魚際滾法可以減少炎性細胞,促進修復受損骨骼肌。本研究利用新西蘭白兔骨骼肌急性鈍挫傷模型,觀察小魚際滾法對兔急性鈍挫傷后組織機化期的影響,探討其作用機制是否與GDF-8/Smad2/3通路相關。
1 材料與方法
1.1? 實驗動物與分組
選取湖南中醫藥研究院實驗動物中心提供的健康清潔級成年新西蘭白兔18只(3月齡、雌雄各半),單籠飼養,飼養環境為溫度20~25 ℃,濕度50%~70%。根據隨機數字表法將其編號,并分為空白組、模型組、滾法組,每組6只。
1.2? 主要試劑與儀器
脫脂奶粉(中國北京普利萊基因技術有限公司,P1622);RIPA裂解液(中國上海碧云天生物技術有限公司,P0013B);顯影液(中國上海佳信科技有限公司,BW-61);定影液(中國上海佳信科技有限公司,BW-62);Smad2/3抗體(英國abcam公司,ab63672);p-Smad2抗體(英國abcam公司,ab188334);GDF-8抗體(美國proteintech公司,19142-1-AP);GAPDH抗體(美國proteintech公司,10494-1-AP)。
顯微鏡(麥克奧迪實業集團有限公司,BA210T);電子天平(美國雙杰兄弟有限公司,JJ224BC);臺式冷凍離心機(中國湖南湘儀實驗室儀器開發有限公司,H1650R);切片機(浙江金華益迪試驗器材,YD-315);電泳儀(中國北京六一生物科技有限公司)。
1.3? 模型制備
參考并改進侯懿烜等[7]的方法,采用自制重力錘打擊裝置制備骨骼肌急性鈍挫傷新西蘭白兔模型。重力錘重0.85 kg,打擊面為直徑1.5 cm的平滑木制圓柱,不銹鋼導向管中空,長30 cm,直徑1.8 cm。方法:新西蘭白兔適應性喂養7 d后,將其右后肢內側剃毛,腹面朝上綁于試驗臺,充分暴露實驗兔右后肢股四頭肌及其相鄰肌肉,打擊點為股四頭肌肌腹中段,以打擊點中點為圓心、1 cm為直徑畫圈標記。操作前于打擊部位覆蓋紗布防止皮膚局部受損,操作由專人控制,將重力錘沿導向管自由下落,同一部位連續打擊6次,高度40 cm,打擊面積約為1.77 cm2,動能3.33 J,沖量2.38 Ns。另有實驗人員用雙手拇食指固定實驗兔股四頭肌上下端防止其掙扎造成打擊點移位。造模成功標準:打擊部位皮膚出現明顯腫脹及淤血,無皮膚受損及骨折,觸碰實驗兔時有躲避反射。
1.4? 干預方法與標本取材
據本團隊前期探索[12],造模后第5天實驗兔進入組織機化期。空白組和模型組于造模后第5天開始捆綁,滾法組于造模后第5天由專人進行小魚際滾法操作,上午下午各1次,5 min/次,共3 d。滾法操作參考《推拿手法學》[13],干預前由專人(針灸推拿學專業研究生)先在ZTC-II 按摩手法測試儀訓練并達到標準滾法參數:前滾后滾著力輕重比3∶1,峰值壓力0.5 kg重力,操作頻率40 次/min。造模后第8天進行標本取材,采取心內注射空氣處死各組兔后取樣,觀察實驗兔后肢右股四頭肌肌腹中段,選取其損傷最嚴重處的病灶組織,大小約為1 cm×1 cm×0.5 cm。
1.5? 形態學檢測
各組兔右側后肢股四頭肌標本先60 ℃烤片12 h,再用切片機切片,將其置于二甲苯中3次、20 min/次,再依次進行梯度酒精脫水,每級放置10 min,蒸餾水浸洗5 min后進行蘇木精-伊紅(hematoxylin-eosin, HE)染色,最后置于二甲苯2次、10 min/次,中性樹膠封片、顯微鏡觀察、采集圖像。
1.6? 蛋白質印跡法(Western blot,WB)檢測
首先對標本進行蛋白提取,電子天平稱取0.030 g組織,剪碎、研磨,冰上裂解10 min,4 ℃,將上清液移入1.5 mL離心管中離心(12 000 r/min,13.5 cm)15 min。制膠并計算配置上樣蛋白以及buffer混合液等放入冰盒中速冷備用。電泳與轉膜:電泳恒定電壓78 V,時間為150 min,待溴酚藍電泳至膠底部時終止電泳。轉膜300 mA恒定電流,p-Smad2、GDF-8約80 min,Smad2/3、GAPDH約60 min。轉膜完畢后,將膜取出放入1×PBST中洗1次。封閉:1×PBST配制5%脫脂奶粉,將膜浸入后,室溫放置120 min,4 ℃過夜。一抗孵育:用1×PBST將一抗按照相應比例稀釋,Smad2/3(1∶1 000)、p-Smad2(1∶3 000)、GDF-8(1∶750)、GAPDH(1∶3 000)孵育,室溫放置90 min,孵育結束,1×PBST洗3次,10 min/次。二抗孵育:1×PBST稀釋HRP標記的二抗(HRP goat anti-mouse IgG 1∶5 000,HRP goat anti-rabbit IgG 1∶6 000)將稀釋后的二抗與膜共同室溫孵育60 min。孵育結束,1×PBST洗3次,10 min/次。ECL顯色曝光:使用ECL化學發光液與膜孵育1 min,用濾紙吸盡液體,用塑封膜將膜包裹雜交膜,在暗盒內與X膠片曝光5~120 min;顯影沖洗。
1.7? 統計學方法
本研究所得數據以“x±s”表示,采用SPSS 26.0統計學軟件進行數據分析。服從正態分布采用單因素方差分析,組間數據方差齊時,兩兩比較采用Bonferroni檢驗,方差不齊時采用Games-Howel檢驗。均以P<0.05表示差異有統計學意義。
2 結果
2.1? 各組兔形態學結果比較
空白組的兔骨骼肌HE染色圖中見肌纖維、肌束形態完整,且有少量結締組織,肌細胞間排列整齊、大小形態近似;模型組見肌束間隔增大,不規則結締組織明顯增多,存在少量水腫,無出血及炎癥,肌纖維排列紊亂,滾法組見肌束間隔小于模型組,產生結締組織數量少,無水腫、出血及炎癥,肌肉細胞排列較為規則,大小形狀相似。見圖1。
2.2? 各組兔GDF-8、p-Smad2、Smad2/3等的表達比較
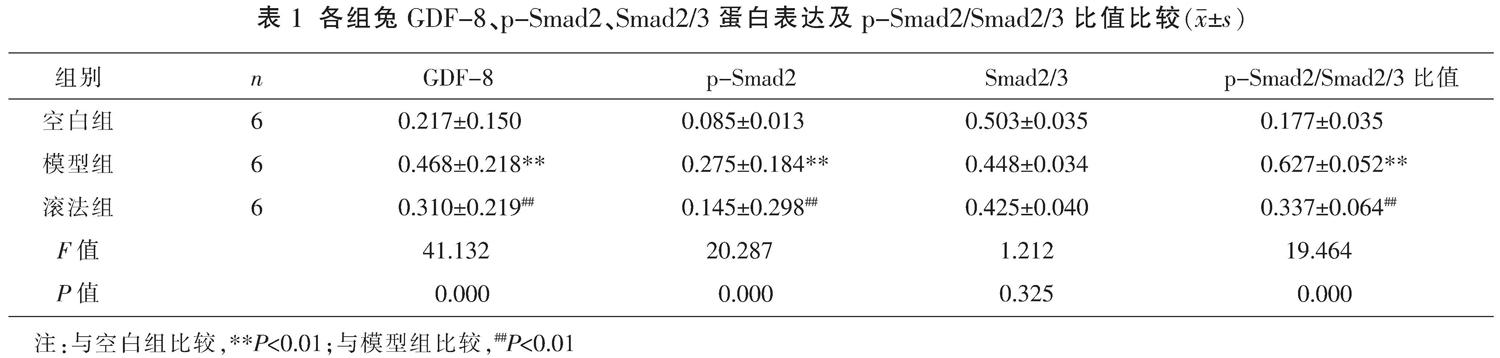
與空白組比較,模型組和滾法組的GDF-8表達均升高(P<0.01),滾法組表達水平低于模型組(P<0.01);Smad2/3在各組的蛋白表達一致(P>0.05);與空白組比較,模型組的p-Smad2蛋白表達、p-Smad2/Smad2/3的灰度比值均升高(P<0.01),滾法組顯著低于模型組(P<0.01),p-Smad2/Smad2/3的灰度比值均值分別為:17.67%、62.67%、33.67%。見圖2、表1。
3 討論
骨骼肌急性鈍挫傷后可進行自然的修復,一般表現由水腫、炎癥、出血、肌纖維壞死、成纖維細胞及肌衛星細胞增殖分化、肌管和血管再生、結締組織增多、肉芽組織及瘢痕組織形成等。鈍挫傷的骨骼肌以瘢痕修復的方式愈合,肌肉嚴重或廣泛受損的情況下,成纖維細胞過度增生,瘢痕組織形成稠密,嚴重影響肌肉組織再生,導致骨骼肌收縮功能嚴重減低,極大影響患者的日常生活。肌形成和纖維瘢痕形成之間的平衡是修復能否完全的關鍵,在纖維瘢痕形成快于肌形成的情況下會造成修復不全[8]。因此,促進肌細胞再生和抑制延緩細胞外纖維瘢痕的形成是促進骨骼肌鈍挫傷后修復的重要研究方向。
GDF-8是TGF-β超家族中重要一員,其在成熟個體的骨骼肌生長中起抑制作用,是骨骼肌質量的負調節因子,與成肌細胞和衛星細胞的增殖分化密切相關[14-18]。GDF-8強烈抑制骨骼肌發育的特點廣泛存在于人和哺乳動物當中[1-2, 19-21]。多項研究[2, 20, 22-23]表明,肌生長抑制素表達減少或活性降低皆可使肌纖維增殖或肥大,增加骨骼肌的質量。Abo等[24]研究結果表明,肌肉生長抑制素缺乏的小鼠肌細胞增生肥大,骨骼肌質量增加,而過表達的小鼠肌纖維數量減少、變小,肌肉質量比正常野生型小鼠輕18%~24%。Smad蛋白家族由9種蛋白組成,其中Smad2、Smad3蛋白是受體活化型通路限制性蛋白。Smad2/3在細胞內直接由TGF-β激活,被磷酸化后與Smad4形成異聚體轉位至細胞核進行相關的轉錄翻譯[25]。Trendelenburg、Welle等[17, 26-28]認為,降低p-Smad2/3的表達可以促進肌肉細胞中的蛋白質合成。Cortez等[27]研究發現,p-Smad2蛋白表達增加會減少肌肉質量。減少p-Smad2表達、降低Smad2蛋白的活性成為骨骼肌修復的重要方向之一。肌肉大小由肌纖維數量和大小共同決定,數量在發育時被設定,大小則隨生命過程發生適應性改變,GDF-8在這兩方面均發揮作用。GDF-8/Smad2/3信號通路在肌肉發育的負調節中起重要作用[15]。抑制肌生長抑制素可以減少Smad2的磷酸化,同時促進肌肉中蛋白的合成[28]。
本研究的結果顯示,3組中GDF-8的表達依次為模型組>滾法組>空白組,可以看出急性鈍挫傷后自然恢復的兔肌肉生長抑制素呈現高表達。在HE染色中,肌纖維排列松散,數量較少、變小,結締樣組織增多,滾法干預的組別雖然存在結締組織但較少,肌細胞和肌束間排列較為整齊緊密,大小近似,整體形態與正常組相似。各組的Smad2/3蛋白總量并未見明顯的改變,但滾法干預組的Smad2的活性卻遠遠低于模型組(P<0.01),p-Smad2/Smad2/3的比值也遠低于模型組(P<0.01),可以認為小魚際滾法干預兔骨骼肌急性鈍挫傷后組織機化期可以降低GDF-8的表達,并且通過改變Smad2的蛋白結構以降低損傷后組織機化期p-Smad2的表達水平及Smad2的活性,即可通過抑制GDF-8/Smad2通路以達到延緩組織纖維化,促進骨骼肌細胞生長、肌肉修復的目的。但在分子層面需要更進一步的研究探索。
參考文獻
[1] MCPHERRON A C,LAWLER A M,LEE S J. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member[J]. Nature, 1997, 387(6628): 83-90.
[2] MCPHERRON A C, LEE S J. Double muscling in cattle due to mutations in the myostatin gene[J]. Proceedings of the National Academy of Sciences of the United States of America,1997, 94(23): 12457-12461.
[3] LEE S J. Regulation of muscle mass by myostatin[J]. Annual Review of Cell and Developmental Biology, 2004, 20: 61-86.
[4] SARTOR R, MILAN G, PATRON M, et al. Smad2 and 3 transcription factors control muscle mass in adulthood[J]. Cell Physiology, 2009, 296(6): 1248-1257.
[5] BURKS T N, COHN R D. Role of TGF-β signaling in inheritedand acquired myopathies[J]. Burks Cohn Skeletal Muscle,2011, 1: 19.
[6] LIU D, BLACK B L, DERYNCK R. TGF-β inhibits musclediff?
erentiation through functional repression of myogenictranscription factors by Smad3[J]. Genes & Development, 2001, 15: 2950-2966.
[7] 侯懿烜,柳滿然,余? 敏,等.按摩促進兔股四頭肌損傷修復的體內研究[J].中國修復重建外科雜志,2012,26(3):346-351.
[8] 王榮國.電針促進家兔骨骼肌鈍器傷后再生的作用和機制研究[D].北京:北京中醫藥大學,2012.
[9] 龐? 賡,曾文赟,黃? 慧,等.推拿聯合電針療法對大鼠急性骨骼肌鈍挫傷后纖維化的影響[J].時珍國醫國藥,2020,31(9):2274-2277.
[10] 楊之雪,朱正威,賀? 舟,等.推拿聯合跑臺訓練對急性骨骼肌損傷大鼠肌蛋白代謝相關因子的影響[J].中華物理醫學與康復雜志,2020,42(5):385-391.
[11] 艾玨萍,羅? 婷,吳安林,等.小魚際滾法對組織機化期骨骼肌鈍性損傷家兔Fibronectin-1與CTGF-1表達的影響[J].湖南中醫藥大學學報,2020,40(2):204-208.
[12] 吳安林,艾玨萍,謝秀惠,等.兔急性骨骼肌損傷模型的建立及分期確定[J].山西中醫藥大學學報,2020,21(4):257-259.
[13] 趙? 毅,季? 遠.推拿手法學[M].北京:中國中醫藥出版社,2016: 200.
[14] THOMAS M, LANGLEY B, BERRY C, et al. Myostatin,? a negative regulator of muscle growth,? functions by inhibiting myoblast proliferation[J]. Journal of Biological Chemistry,2000, 275(51): 40235-40243.
[15] LANGLEY B, THOMAS M, BISHOP A, et al. Myostatin inhibits myoblast differentiation by down-regulating MyoD expression[J]. Journal of Biological Chemistry, 2002, 277(51): 49831-49840.
[16] MCCROSKERY S, THOMAS M, MAXWELL L, et al. Myostatin negatively regulates satellite cell activation and self-renewal[J].Journal of Cell Biology, 2003, 162(6):1135-1147.
[17] TRENDELENBURG A U, MEYER A, ROHNER D, et al. Myostatin reduces Akt/TORC1/p70S6K signaling,? inhibiting myoblast
differentiation and myotube size[J]. Cell Physiology, 2009, 296(6): 1258-1270.
[18] BEYER T A, NARIMATSU M, WEISS A, et al. The TGF-β superfamily in stem cell biology and early mammalian embryonic development[J]. Biochimica et Biophysica Acta, 2013, 1830(2): 2268-2279.
[19] GROBET L, MARTIN L J, PONCELET D, et al. A deletion in the bovine myostatin gene causes the double-muscled phenotype in cattle[J]. Nature Genetics, 1997, 17(1): 71-74.
[20] SCHUELKE M, WAGNER K R, STOLZ L E, et al. Myostatin mutation associated with gross muscle hypertrophy in a child[J]. New England Journal of Medicine, 2004, 350(26): 2682-2688.
[21] CLOP A, MARCQ F, TAKEDA H, et al.A mutation creating a potential illegitimate microRNA target site in the myostatin gene affects muscularity in sheep[J]. Nature Genetics, 2006, 38(7):813-818.
[22] KAMBADUR R, SHARMA M, SMITH T P, et al. Mutations in myostatin (GDF8) in double-muscled Belgian Blue and Piedmontese cattle[J]. Genome Research, 1997, 7(9): 910-916.
[23] MOSHER D S, QUIGNON P, BUSTAMANTE C D, et al.A mutation in the myostatin gene increases muscle mass and enhances racing performance in heterozygote dogs[J]. PLoS Genetics, 2007, 3(5): e79.
[24] ABO T, IIDA R H, KANEKO S, et al. IGF and myostatin pathways are respectively induced during the earlier and the later stages of skeletal muscle hypertrophy induced by clenbuterol, a β-adrenergic agonist[J]. Cell Biochemistry and Function, 2012, 30(8): 671-676.
[25] LIN X, CHEN Y, MENG A, et al. Termination of TGF-beta superfamily signaling through SMAD dephosphorylation--a functional genomic view[J]. Journal of Genetics and Genomics, 2007, 34(1): 1-9.
[26] WELLE S L. Myostatin and muscle fiber size. Focus on "Smad2 and 3 transcription factors control muscle mass in adulthood" and "Myostatin reduces Akt/TORC1/p70S6K signaling,? inhibiting myoblast differentiation and myotube size"[J]. Cell Physiology, 2009, 296(6): 1245-1247.
[27] CORTEZ-TOLEDO O, SCHNAIR C, SANGNGERN P, et al.Nur77 deletion impairs muscle growth during developmental
myogenesis and muscle regeneration in mice[J]. Plos One, 2017, 12(2): e0171268.
[28] CHANG F, FANG R, WANG M, et al. The transgenic expression of human follistatin-344 increases skeletal muscle mass in pigs[J]. Transgenic Research, 2017, 26(1): 25-36.

