半夏瀉心湯及不同配伍組對(duì)慢性胃炎大鼠ICC細(xì)胞相關(guān)受體表達(dá)和鈣內(nèi)流的影響
周澤華, 紀(jì)萬(wàn)里, 安 叡, 梁 琨, 王新宏
(上海中醫(yī)藥大學(xué)中藥學(xué)院,上海 201203)
慢性胃炎是一種常見(jiàn)的、多發(fā)性的消化系統(tǒng)疾病,病變分布不均勻。主要由炎性細(xì)胞(淋巴細(xì)胞和漿細(xì)胞為主)浸潤(rùn)所導(dǎo)致的胃黏膜慢性炎癥或萎縮性病變,也可同時(shí)存在中性粒細(xì)胞和嗜酸性粒細(xì)胞浸潤(rùn)。該病的發(fā)病率逐年上升,且有隨著年齡的增長(zhǎng)而升高的趨勢(shì)[1]。目前西醫(yī)治療以對(duì)癥處理為主,暫無(wú)特效藥物,而中藥治療顯示出明顯優(yōu)勢(shì),中醫(yī)強(qiáng)調(diào)辨證論治,從整體觀念出發(fā)調(diào)整機(jī)體狀態(tài)[2]。中醫(yī)學(xué)并無(wú)“慢性胃炎”病名,根據(jù)本病的主要臨床表現(xiàn)將其劃分為“胃脘痛”“痞滿”“嘈雜”等范疇。本病以脾虛為本,痰濁、瘀血、濕熱為標(biāo),為本虛標(biāo)實(shí)之證。疾病日久即可因虛致實(shí),又可因?qū)嵵绿摚瑢?dǎo)致虛實(shí)夾雜,同時(shí)多種致病因素又可郁久化熱,表現(xiàn)出寒熱錯(cuò)雜的臨床癥狀[3]。半夏瀉心湯出自張仲景的《傷寒論》,是治療寒熱錯(cuò)雜之心下痞的代表方劑之一,具有和中降逆,開(kāi)痞散結(jié)之功,臨床上主要治療急慢性胃炎。
Cajal間質(zhì)細(xì)胞(interstitial cells of Caja,ICC)作為胃腸道慢波的起搏細(xì)胞,是基本電節(jié)律的主要傳播者,參與了慢波的傳導(dǎo),同時(shí)也是胃腸神經(jīng)與平滑肌細(xì)胞聯(lián)系的重要通道,參與了胃腸神經(jīng)信息傳遞過(guò)程,在胃腸動(dòng)力的調(diào)控中起著十分重要的作用,與胃腸動(dòng)力性疾病的發(fā)病密切相關(guān)。ICC的功能結(jié)構(gòu)異常改變、發(fā)育分化障礙、凋亡或自噬引起胃腸道起搏電位、慢波節(jié)律和興奮傳導(dǎo)的異常,是多種胃腸道疾病發(fā)生的關(guān)鍵機(jī)制[4]。既往研究表明[5]慢性胃炎與胃腸功能的障礙有一定關(guān)聯(lián),文獻(xiàn)[6]報(bào)道,半夏瀉心湯具有調(diào)節(jié)胃腸道作用,但從半夏瀉心湯的配伍角度來(lái)研究作用機(jī)制的文獻(xiàn)較少。中藥配伍理論是中醫(yī)藥理論的精華之一,開(kāi)展方劑配伍規(guī)律的現(xiàn)代研究有利于闡釋中藥復(fù)方對(duì)疾病的多靶點(diǎn)治療作用,同時(shí)也有助于臨床療效的提高及應(yīng)用的推廣。因此,本實(shí)驗(yàn)研究半夏瀉心湯及各配伍組對(duì)胃腸道運(yùn)動(dòng)相關(guān)受體的影響,同時(shí),通過(guò)觀察半夏瀉心湯及各配伍組含藥血清對(duì)ICC細(xì)胞內(nèi)Ca2+濃度的影響,探究半夏瀉心湯調(diào)節(jié)慢性胃炎胃腸道功能的作用機(jī)制。
1 材料與方法
1.1 動(dòng)物 清潔級(jí)SD大鼠,雄性,體質(zhì)量160~180 g,由上海中醫(yī)藥大學(xué)實(shí)驗(yàn)動(dòng)物中心提供,動(dòng)物生產(chǎn)許可證號(hào)SCXK(滬)2014-0008,飼養(yǎng)環(huán)境溫度(22±0.5)℃,相對(duì)濕度(50±5)%,12 h/12 h光照/黑暗交替。實(shí)驗(yàn)前,所有大鼠適應(yīng)性飼養(yǎng)7 d,自由進(jìn)食飲水。
1.2 試劑與藥物 半夏瀉心湯組方藥材黃連、黃芩、人參、甘草、半夏、干姜、大棗均購(gòu)自上海康橋中藥飲片有限公司,經(jīng)上海虹橋中藥飲片有限公司陳燕軍藥師鑒定為正品,符合2020年版《中國(guó)藥典》規(guī)定。伊托必利(迪沙藥業(yè)集團(tuán)有限公司);兔抗5-羥色胺4受體(5-HT4)、兔抗多巴胺D2受體(DA2)、兔抗乙酰膽堿酯酶(AchE)多克隆抗體(北京博奧森生物技術(shù)有限公司);小鼠抗c-kit多克隆抗體(上海圣克魯斯生物技術(shù)有限公司);羊抗兔HRP標(biāo)記二抗、羊抗鼠HRP標(biāo)記二抗、Fluo-4-AM、Western blot Kit高靈敏度化學(xué)發(fā)光檢測(cè)試劑盒(上海碧云天生物技術(shù)有限公司);兔抗GAPDH多克隆抗體(美國(guó)CST公司);M199培養(yǎng)基、胎牛血清(FBS)(美國(guó)Gibco公司);干細(xì)胞因子(SCF)、Ⅱ型膠原酶(美國(guó)Sigma公司);青鏈霉素混合液(100X)、D-hanks(美國(guó)Solarbio公司);逆轉(zhuǎn)錄試劑盒(加拿大Fermentas公司);SYBR Green PCR試劑盒、BCA蛋白濃度測(cè)定試劑盒(美國(guó)Thermo公司)。
1.3 儀器 TDZ4-WS離心機(jī)(上海盧湘儀離心機(jī)儀器有限公司);BHC-1300IIB2生物安全柜(蘇州金凈凈化設(shè)備公司);Thermo Forma 3111CO2恒溫培養(yǎng)箱[賽默飛世爾科技(中國(guó))有限公司];T100 PCR儀(美國(guó)Bio-Rad公司);7500實(shí)時(shí)熒光定量PCR儀(美國(guó)ABI公司);DYCZ-24DN電泳儀(北京六一儀器廠);Eclipse Ni熒光顯微鏡(日本Nikon公司);SP8 激光掃描共聚焦顯微鏡(德國(guó)Leica公司)。
1.4 方法
1.4.1 藥液制備 按全方半夏、干姜、黃芩、黃連、人參、大棗、炙甘草12∶9∶9∶3∶9∶6∶9比例,加入10倍量水煎煮45 min,共2次,濾過(guò),合并濾液,濃縮至生藥量1.0 g/mL。按比例稱(chēng)取各配伍組飲片,包括辛開(kāi)組(半夏、干姜),苦降組(黃芩、黃連),甘補(bǔ)組(人參、炙甘草、大棗),同法煎煮。
1.4.2 動(dòng)物分組 70只大鼠遵循隨機(jī)分配原則分為正常組、模型組、全方組、苦降組、辛開(kāi)組、甘補(bǔ)組、陽(yáng)性藥(伊托必利)組,每組10只。
1.4.3 造模及給藥 空白組大鼠灌胃給予生理鹽水,其余各組大鼠建立寒熱錯(cuò)雜型慢性胃炎大鼠模型。采用苦寒瀉下法[7],大承氣湯按10 g/kg劑量灌胃,隔天1次,連續(xù)10 d,第11天開(kāi)始灌胃給予含4%辣椒的56%乙醇混懸液,劑量8 mL/kg,每3 d 1次,連續(xù)9 d,復(fù)制熱證模型[8]。造模成功后大鼠灌胃給藥(依照人單位體質(zhì)量生藥量來(lái)求得大鼠單位體質(zhì)量生藥量, 并擴(kuò)大3倍),分別為全方組15 g/kg、苦降組3 g/kg、辛開(kāi)組5.5 g/kg、甘補(bǔ)組6.5 g/kg、陽(yáng)性藥組40 mg/kg,而正常組、模型組大鼠每天灌胃給予等劑量生理鹽水,均連續(xù)7 d。
1.4.4 標(biāo)本采集及處理 大鼠按0.4 mL/100 g劑量腹腔注射20%烏拉坦溶液麻醉,分離胃部并沿胃長(zhǎng)緣剪開(kāi),生理鹽水洗去胃內(nèi)容物,濾紙吸干,4%多聚甲醛固定,使組織細(xì)胞中的蛋白變性并固化,進(jìn)行病理學(xué)檢查。另取胃組織,RT-qPCR法檢測(cè)5-HT4、AchE、DA2、c-kitmRNA表達(dá),Western blot法檢測(cè)蛋白表達(dá)。
1.4.5 HE染色 將在4%多聚甲醛中固定過(guò)夜的大鼠胃組織放到包埋盒中,自來(lái)水沖洗6 h,梯度乙醇脫水,二甲苯透明,浸蠟,包埋,切片(約4 μm厚),脫蠟至水,進(jìn)行HE染色,在光鏡下觀察其形態(tài)學(xué)。
1.4.6 RT-qPCR法檢測(cè)5-HT4、AchE、DA2、c-kitmRNA表達(dá) 取凍存的各組大鼠部分胃組織,按照說(shuō)明書(shū)提取總RNA,逆轉(zhuǎn)錄合成cDNA,采用實(shí)時(shí)熒光定量PCR儀對(duì)5-HT4、AchE、DA2、c-kit進(jìn)行相對(duì)定量分析,目標(biāo)基因通過(guò)2-△△CT公式計(jì)算,引物序列由上海基爾頓生物科技有限公司設(shè)計(jì),見(jiàn)表1。
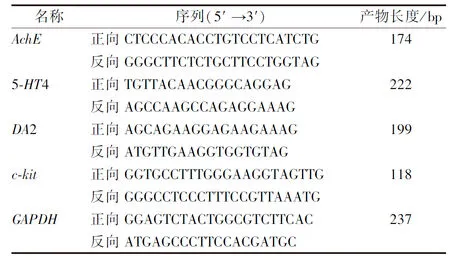
表1 RT-qPCR引物序列
1.4.7 Western blot檢測(cè)5-HT4、AchE、DA2、c-kit蛋白表達(dá) 取凍存的各組大鼠胃組織,稱(chēng)定質(zhì)量,置于2 mL離心管中,按1∶10比例加入RIPA裂解液,機(jī)械勻漿1 min,10 000×g離心5 min,取上清,BCA法定量,SDS-PAGE電泳分離,轉(zhuǎn)膜,5%BSA室溫下封閉1 h,加入5-HT4(1∶500)、AchE(1∶500)、DA2(1∶300)、c-kit(1∶500),4 ℃過(guò)夜,TBST洗膜,加入HRP標(biāo)記的二抗(1∶1 000),室溫下孵育1 h,TBST洗膜,ECL化學(xué)發(fā)光試劑盒檢測(cè),凝膠成像系統(tǒng)拍照,以GAPDH為內(nèi)標(biāo),檢測(cè)5-HT4、AchE、DA2、c-kit蛋白的相對(duì)表達(dá)量。
1.4.8 免疫熒光法檢測(cè)5-HT4、AchE、DA2、c-kit蛋白共表達(dá) 將各組大鼠胃組織切片在二甲苯中浸泡,脫蠟后切片,浸入梯度乙醇中脫二甲苯,0.01 mol/L PBS緩沖液沖洗,正常山羊血清封閉,37 ℃下放置30 min,滴加兔抗大鼠5-HT4(1∶500)、AchE(1∶500)、DA2(1∶300)抗體、小鼠抗大鼠c-kit抗體(1∶500),置于濕盒中,4 ℃下過(guò)夜,取出切片,37 ℃下復(fù)溫60 min,0.01 mol/L PBS緩沖液沖洗,免疫熒光雙標(biāo)記滴加羊抗兔HRP標(biāo)記二抗、羊抗鼠HRP標(biāo)記二抗(1∶1 000),37 ℃下放置40 min,0.01 mol/L PBS緩沖液沖洗,100 g/L緩沖甘油封固,在熒光顯微鏡下觀察拍照,并記錄熒光強(qiáng)度值。
1.4.9 ICC細(xì)胞分離與培養(yǎng) 大鼠禁食18 h后腹腔注射10%水合氯醛(3 mL/kg)麻醉,無(wú)菌條件下取胃竇組織,4 ℃預(yù)冷的D-hanks液反復(fù)沖洗胃內(nèi)容物,胃竇組織剪成1 cm3左右小塊,將呈糜狀者移入離心管中,加3 mL 4%Ⅱ型膠原酶充分吹勻,37 ℃下消化30 min,1 000 r/min離心3 min,棄去上清,加入D-hanks液反復(fù)吹打10 min,再離心棄上清,加入M199基礎(chǔ)培養(yǎng)基應(yīng)用液重懸沉淀,過(guò)200目網(wǎng)篩去除大塊組織,將所得懸液加到等體積Ficoll溶液中,離心,取中間沉淀,加到M199培養(yǎng)基中,細(xì)胞計(jì)數(shù)后將其接種至6孔板上,37 ℃、5% CO2下培養(yǎng)24 h后換液,每隔2~3 d 1次,細(xì)胞穩(wěn)定培養(yǎng)7 d后進(jìn)行后續(xù)研究。
1.4.10 ICC細(xì)胞鑒定 細(xì)胞穩(wěn)定培養(yǎng)后,0.02 mol/L PBS洗去培養(yǎng)基,4%甲醛固定30 min,0.02 mol/L PBS緩沖液沖洗,0.5% TritonX-100通透10 min,0.02 mol/L PBS緩沖液沖洗,1%BSA封閉1 h,0.02 mol/L PBS緩沖液沖洗,加入小鼠抗c-kit多克隆抗體(1∶500),置于濕盒中,4 ℃下孵育過(guò)夜,0.02 mol/L PBS緩沖液沖洗,滴加羊抗鼠HRP標(biāo)記二抗(1∶1 000),置于濕盒中孵育,室溫下放置1 h,0.02 mol/L PBS緩沖液沖洗,防淬滅封片劑與DAPI(1∶500)稀釋封片,置于-20 ℃冰箱中保存,熒光顯微鏡拍片。
1.4.11 含藥血清制備 將60只大鼠隨機(jī)分為空白血清對(duì)照組、全方組、苦降組、辛開(kāi)組、甘補(bǔ)組、陽(yáng)性藥組,灌胃給藥量與“1.4.3”項(xiàng)下相同,連續(xù)7 d,處死,腹主動(dòng)脈取血,12 000×g高速離心,取上清液,56 ℃下滅活,-80 ℃下保存?zhèn)溆谩?/p>
1.4.12 細(xì)胞分組及給藥 取對(duì)數(shù)生長(zhǎng)期的ICC細(xì)胞,稀釋成1×105個(gè)/mL單細(xì)胞懸液,接種于96孔培養(yǎng)板上,每孔0.1 mL,每組設(shè)3個(gè)復(fù)孔,RPMI 1640培養(yǎng)基常規(guī)培養(yǎng)24 h,隨機(jī)分為正常組(25%空白血清)、模型組(NO 30 μmol/L)、全方組(NO 30 μmol/L+25%含藥血清)、苦降組(NO 30 μmol/L+25%含藥血清)、辛開(kāi)組(NO 30 μmol/L+25%含藥血清)、甘補(bǔ)組(NO 30 μmol/L+25%含藥血清)、陽(yáng)性藥組(NO 30 μmol/L+25%含藥血清)。
1.4.13 Ca2+含量測(cè)定 將各組ICC細(xì)胞加到0.2 mL 5 μmol/L Fluo-4-AM中,37 ℃下避光孵育 30 min,吸出染液,D-Hanks液沖洗3次,加入0.2 mL D-Hanks液,F(xiàn)luo-4-AM溶液處理5 min,激光共聚焦顯微鏡觀察拍照,設(shè)定激發(fā)波長(zhǎng)為488 nm,發(fā)射波長(zhǎng)為522 nm,采樣頻率為488 Hz,每皿選3~5個(gè)視野及4個(gè)形態(tài)良好的細(xì)胞,采ZEN blue edition 2.5軟件進(jìn)行熒光強(qiáng)度分析,以熒光強(qiáng)度增高的比值來(lái)衡量鈣含量變化。
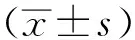
2 結(jié)果
2.1 大鼠胃組織HE染色 造模后,大鼠胃組織固有層-黏膜下-漿膜層有淋巴細(xì)胞浸潤(rùn),肌層散在少量淋巴細(xì)胞,黏膜下水腫,固有層少許充血,為慢性淺表性胃炎(非萎縮性)的典型癥狀,表明模型建立成功。給藥后,全方組、辛開(kāi)組、苦降組、甘補(bǔ)組、陽(yáng)性藥組大鼠癥狀明顯好轉(zhuǎn),胃黏膜表面上皮細(xì)胞受損、炎細(xì)胞浸潤(rùn)狀況較模型組明顯減輕,胃腺排列稍整齊平整, 黏液增厚且腺管構(gòu)造逐漸規(guī)則。見(jiàn)圖1。
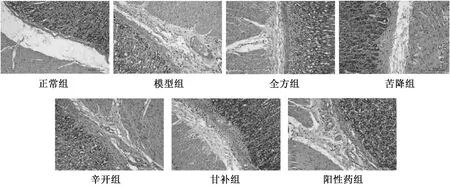
圖1 各組大鼠胃組織HE染色(×200)Fig.1 HE staining of rat gastric tissues in various groups(×200)
2.2 半夏瀉心湯對(duì)5-HT4、AchE、DA2、c-kitmRNA表達(dá)的影響 與正常組比較,模型組AchE、5-HT4、c-kitmRNA表達(dá)降低(P<0.05,P<0.01),DA2 mRNA表達(dá)升高(P<0.01),表明模型建立成功;與模型組比較,全方組及各配伍組能不同程度提高AchEmRNA表達(dá)(P<0.05,P<0.01),降低DA2 mRNA表達(dá)(P<0.01),以全方組及甘補(bǔ)組更明顯;全方組可提高5-HT4、c-kitmRNA表達(dá)(P<0.05,P<0.01);除辛開(kāi)組可提高5-HT4 mRNA表達(dá)(P<0.01)外,其他各配伍組均無(wú)明顯變化(P>0.05),表明半夏瀉心湯及配伍組可調(diào)節(jié)大鼠胃腸動(dòng)力,有利于恢復(fù)其正常功能。見(jiàn)圖2。
注:與模型組比較,*P<0.05,**P<0.01。圖2 半夏瀉心湯對(duì)5-HT4、AchE、DA2、c-kit mRNA表達(dá)的影響Fig.2 Effects of Banxia Xiexin Decoction on mRNA expressions of 5-HT4, AchE, DA2 and
2.3 半夏瀉心湯對(duì)5-HT4、AchE、DA2、c-kit蛋白表達(dá)的影響 模型組大鼠胃組織中AchE蛋白表達(dá)與正常組比較降低(P<0.05),而全方組及配伍組可提高其蛋白表達(dá)(P<0.05)。與正常組比較,模型組大鼠胃組織中5-HT4蛋白表達(dá)降低(P<0.01),而全方組及配伍組可提高其蛋白表達(dá)(P<0.05,P<0.01),以全方組和辛開(kāi)組更明顯(P<0.01);DA2蛋白表達(dá)升高(P<0.05),而全方組及配伍組可降低其蛋白表達(dá)(P<0.05,P<0.01),以全方組更明顯(P<0.01);c-kit蛋白表達(dá)降低(P<0.01),而全方組及配伍組可升高其蛋白表達(dá)(P<0.01)。見(jiàn)圖3。
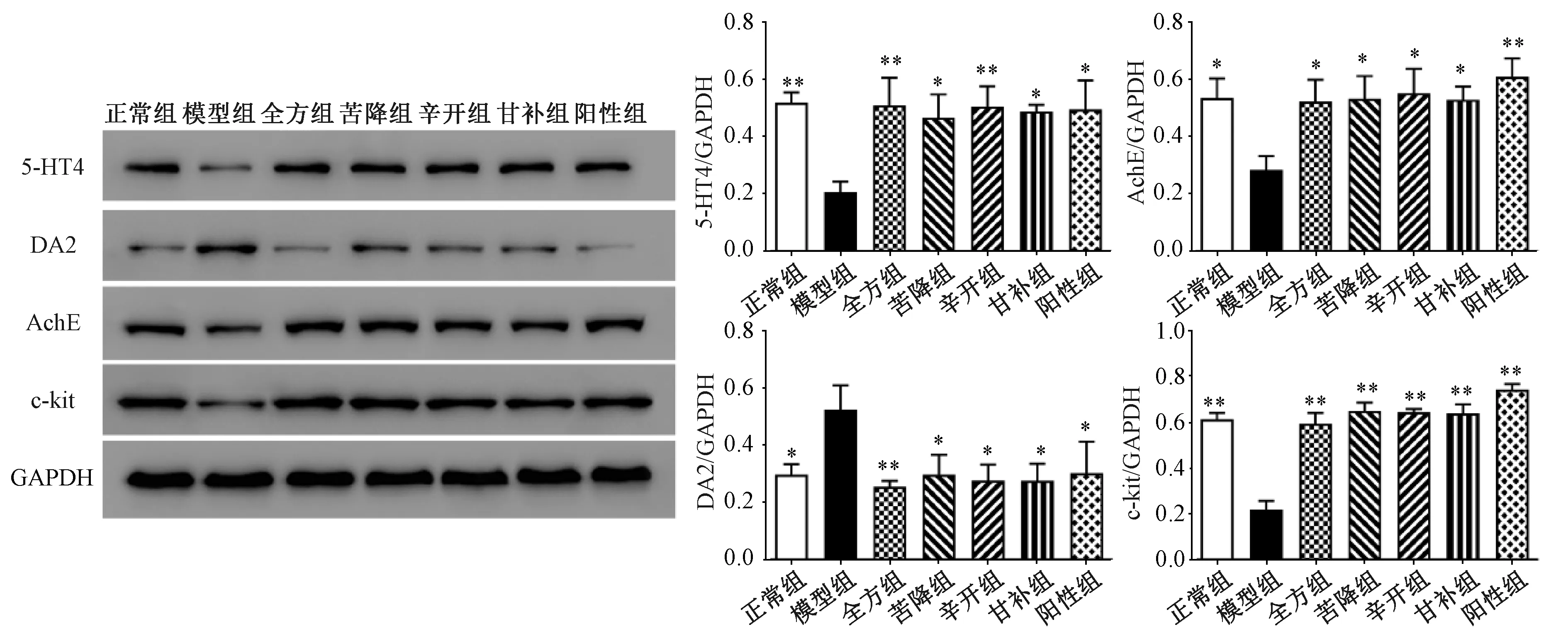
注:與模型組比較,*P<0.05,**P<0.01。圖3 半夏瀉心湯對(duì)5-HT4、AchE、DA2、c-kit蛋白表達(dá)的影響Fig.3 Effects of Banxia Xiexin Decoction on protein expressions of 5-HT4, AchE, DA2 and
2.4 半夏泄心湯對(duì)5-HT4/AchE/DA2、c-kit蛋白共表達(dá)的影響 與正常組大鼠比較,模型組大鼠胃組織5-HT4、c-kit熒光強(qiáng)度水平降低,經(jīng)全方組及配伍組干預(yù)后明顯升高(圖4A);AchE熒光強(qiáng)度水平低于正常組,而全方組及配伍組能提高其水平,同時(shí)還可提高c-kit熒光強(qiáng)度值(圖4B);DA2熒光強(qiáng)度高于正常組大鼠,出現(xiàn)了DA2/c-kit蛋白共表達(dá),而全方組及配伍組可降低其熒光強(qiáng)度(圖4C)。
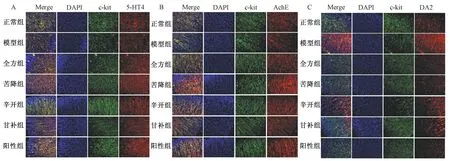
圖4 各組5-HT4(A)、AchE(B)、DA2(C)與c-kit蛋白共表達(dá)Fig.4 Co-expressions of 5-HT4 (A), AchE (B), DA2 (C) and c-kit protein in various groups
2.5 ICC細(xì)胞形態(tài)及鑒定 穩(wěn)定培養(yǎng)7 d后,在倒置顯微鏡下可見(jiàn)ICC細(xì)胞呈三角形、梭形或多邊形、核大,周?chē)錆M胞漿,胞體發(fā)出多條大小不等的樹(shù)枝狀突起,突起與周?chē)?xì)胞的胞體和突起相互連接,見(jiàn)圖5。免疫熒光染色后,細(xì)胞表面c-kit呈綠色陽(yáng)性顯性,胞體和突起均明顯熒光染色,見(jiàn)圖6。

圖5 光鏡下ICC細(xì)胞形態(tài)Fig.5 Morphologies of ICC cells under light microscope
圖6 熒光顯微鏡下ICC細(xì)胞形態(tài)Fig.6 Morphologies of ICC cells under fluorescencemicroscope
2.6 半夏瀉心湯全方對(duì)ICC鈣流的影響 與正常組比較,模型組ICC細(xì)胞鈣離子熒光強(qiáng)度增強(qiáng)(P<0.05);與模型組比較,全方組及配伍組能降低ICC內(nèi)鈣離子熒光強(qiáng)度(P<0.05,P<0.01),以全方組更明顯(P<0.01),表明全方組及各配伍組能不同程度抑制ICC鈣離子內(nèi)流的作用。見(jiàn)圖7。
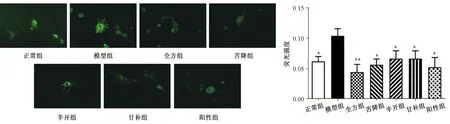
注:與模型組比較,*P<0.05,**P<0.01。圖7 各組ICC細(xì)胞中Ca2+的Fluo-4-AM熒光染色及熒光強(qiáng)度值Fig.7 Fluo-4-AM fluorescence staining and fluorescence intensity of Ca2+ in ICC cells in various
3 討論
ICC被稱(chēng)為胃腸動(dòng)力的“起搏者”和“調(diào)節(jié)者”[9],c-kit表達(dá)是在胃腸肌ICC中存在的主要標(biāo)志物[10]。ICC中上述受體與胃腸神經(jīng)系統(tǒng)釋放的神經(jīng)遞質(zhì)和肽類(lèi)物質(zhì)結(jié)合,將神經(jīng)信息傳送給平滑肌細(xì)胞,從而調(diào)控胃腸道平滑肌的舒縮是ICC細(xì)胞發(fā)揮功能的主要機(jī)制之一。本研究發(fā)現(xiàn),半夏瀉心湯及不同配伍可通過(guò)調(diào)節(jié)AchE、5-HT4、DA2及c-kit的mRNA表達(dá)、蛋白表達(dá),達(dá)到改善慢性胃炎的目的。其中,全方組在調(diào)節(jié)各受體及c-kit的mRNA和蛋白表達(dá)方面的效果皆極顯著,這與之前的研究結(jié)果相符[11-14]。其他各配伍組間效果則較為接近。其中,辛開(kāi)組可極顯著提高5-HT4的mRNA和蛋白表達(dá),推測(cè)是由于組中半夏和干姜均屬味辛性溫的中藥,而此前王鵬等[15]發(fā)現(xiàn),溫?zé)嵝灾兴幠軌蛏险{(diào)大鼠血清5-HT的作用。苦降組和甘補(bǔ)組則能極顯著提高AchE的mRNA表達(dá),可能源于苦降組中黃芩與黃連,據(jù)報(bào)道[16],黃芩可使大鼠血清中乙酰膽堿(Ach)升高,進(jìn)而增加Ach水解酶AchE的活性。黃連則可提高大鼠外周組織中乙酰膽堿轉(zhuǎn)移酶(ChAT)活性而間接增強(qiáng)AchE的活性。此外,甘補(bǔ)組能極顯著提高AchE的mRNA表達(dá)的原因,可能與人參具有提高AchE活性的作用有關(guān)[17]。
ICC細(xì)胞還可通過(guò)起搏胃腸道慢波產(chǎn)生自發(fā)電節(jié)律變化并參與慢波的傳導(dǎo)發(fā)揮功能。本研究顯示,半夏瀉心湯及各配伍組能不同程度降低ICC細(xì)胞內(nèi)Ca2+的熒光強(qiáng)度,其中全方組效果較各配伍組更好。提示半夏瀉心湯及各個(gè)配伍組可通過(guò)降低ICC細(xì)胞內(nèi)的Ca2+濃度,抑制ICC鈣超載,防止ICC興奮節(jié)律失常,從而調(diào)節(jié)胃腸道運(yùn)動(dòng),與文獻(xiàn)[14]報(bào)道相符。
ICC的兩個(gè)功能間可能也具有一定的關(guān)聯(lián)性。如胃腸道的5-HT4可激活腺苷環(huán)化酶[18],黃棪等[19]就曾發(fā)現(xiàn),旋覆代赭湯可使5-HT4表達(dá)增加,促進(jìn)cAMP釋放,打開(kāi)電壓門(mén)控鈣通道,最終使胞內(nèi)Ca2+濃度升高。至于半夏瀉心湯降低ICC細(xì)胞內(nèi)的Ca2+濃度并調(diào)節(jié)胃腸道神經(jīng)遞質(zhì)的進(jìn)一步機(jī)制,以及ICC細(xì)胞內(nèi)Ca2+與這些神經(jīng)遞質(zhì)之間是否也存在類(lèi)似的關(guān)聯(lián)性,還有待深入研究。

