基于網絡藥理學、分子對接、體外細胞實驗預測珠子參保肝機制
張海潮, 周 瑞, 唐志書, 蘇 潔, 劉妍如, 潘亞磊, 劉紅波, 宋忠興
[陜西中醫藥大學/陜西中藥資源產業化省部共建協同創新中心/秦藥特色資源研究開發國家重點實驗室(培育)/陜西省創新藥物研究中心,陜西 咸陽 712083]
珠子參為五加科植物珠子參PanaxjaponicusC. A. Mey. var.Major(Burk.)C. Y. Wu et K. M. Feng 或羽葉三七PanaxjaponicusC. A. Mey. var.Bipinnatifidus(Seem)C. Y. Wu et K. M. Feng的干燥根莖,是秦巴特色中草藥資源“太白七藥”之一[1],據《中國藥典》記載,珠子參歸肝經、胃經、肺經,早在《本草綱目拾遺》就記載其具有止血、活絡、養陰等功效[2],其熟品常用于氣血雙虧。研究報道,珠子參中主要成分為珠子參總皂苷,其具有保肝、抗炎鎮痛、抗氧化損傷和誘導人肝癌細胞SMMC-7721凋亡等藥理作用[3-4]。
肝臟是維持人體新陳代謝穩定的重要器官,具有抵抗病原菌感染,產生多種凝血因子,維持血液循環以及排毒解毒等生理功能[5]。藥源性損傷,輻射、環境污染等外部損傷,酗酒、飲食不規律等生活中的不良生活習慣以及糖尿病等疾病并發癥均會導致肝臟損傷。肝疾病進行到終末期肝硬化等癥狀時,常會使肝實質細胞發生病變,結果導致肝再生能力降低,功能減弱,最終發展到肝功能衰竭。肝損傷是各種類型肝病的病理基礎,因此抑制以及治療肝損傷是防止肝病進一步發展的重要措施之一[6]。
中藥是多組分的天然藥物,其機制復雜,各種組學技術、高內涵技術等為分析中藥作用機制提供了技術支撐[7]。有研究表明珠子參總皂苷對CCl4導致大鼠肝纖維化具有保護作用[8],但珠子參保肝的作用機制尚不清楚。近幾年,網絡藥理學研究發展迅速,它是基于現代藥理學研究藥物開發設計的新方法和新策略[9],可通過構建生物分子“疾病-藥物-靶點-通路”網絡來對機體復雜生物系統進行分析,預測藥物的作用機理,發現和優化先導化合物以及藥物臨床前安全性有效性評估[10]。因此,本研究采用網絡藥理學的研究技術構建“成分-靶點-通路”網絡,探討珠子參保肝的活性成分及作用機制,并通過分子對接和細胞實驗進一步驗證珠子參的保肝作用。
1 方法
1.1 珠子參活性化合物及相應靶點的獲取 借助ETCM(http://www.tcmip.cn/ETCM/index.php/Home/Index/index.htm)數據庫以及現有文獻,以“珠子參”為關鍵詞檢索,獲得其化學成分,利用中醫藥百科全書數據庫ETCM、SwissTargetPrediction(http://www.swisstargetpred iction.ch/)、中醫藥證候關聯數據庫SymMap(https://www.symmap.org/)數據庫獲得候選化合物的相應靶點,并在Uniprot數據庫(https://www.uniprot.org/)對靶點校正。
1.2 疾病潛在靶點的獲取 在人類疾病數據庫(Melacards)(https://www.genecards.org/)中,以“肝炎(hepatitis)、乙肝(hepatitis B)、酒精性及非酒精性肝炎(alcoholic /non-alcoholic hepatitis)、病毒性肝炎(viral hepatitis)、脂肪肝(fatty liver disease)、肝硬化(liver cirrhosis)以及急性肝衰竭(acute liver failure)”等為關鍵詞檢索其相關靶點,刪除重復靶點后,通過Venny 2.1.0(http://bioinfogp.cnb.csic.es/tools/venny/index.html)在線作圖,收集珠子參保肝的潛在靶點。
1.3 蛋白互作網絡的構建 將篩選后的潛在靶點導入到蛋白互作分析平臺STRING 11.0(https://string-db.org/),選擇種屬為“人類(Homosapiens)”,獲取蛋白互作關系的PPI網絡,PPI網絡中線的粗細表示互相作用的強弱,靶點的度值表示節點的連接情況,度值越大,代表此節點在蛋白互作網絡中越重要。
1.4 “活性化合物-疾病-靶點”網絡的構建 利用Cytoscape3.7.2構建“活性化合物-疾病-靶點”可視化網絡。借助“網絡分析(network analyzer)”功能,獲得參與互作蛋白的度值(Degree)和介數(Betweenness),篩選出珠子參中潛在的具有保肝作用的活性化合物和相應的疾病靶點。
1.5 GO和KEGG功能富集分析 將篩選后的靶點導入蛋白質互作分析平臺STRING 11.0,設定物種為“Homosapiens”,經上述數據庫檢索和轉化操作,對生物學過程(biological Process,BP)、分子功能(molecular function,MF)及細胞組成(cellular component,CC)進行GO(gene ontology)富集分析,通過京都基因與基因組百科全書(KEGG)對代謝通路進行富集分析,并應用微生信(http://www.bioinformatics.com.cn/)在線作圖,將結果分別繪制成柱狀圖和氣泡圖。
1.6 “活性化合物-靶點-通路”網絡的構建 通過文獻挖掘,對KEGG通路進行分析,并利用Cytoscape3.7.2軟件構建“活性化合物-靶點-通路”網絡,獲得珠子參保肝的相關通路、靶點以及有效成分。
1.7 分子對接 應用UCSF Chimera軟件將上述網絡中度值靠前的5個靶點分別與5個度值靠前的活性化合物進行分子對接驗證。在PDB數據庫(http://www.rcsb.org/)中分別下載5個靶點的蛋白結構,并導入到UCSF Chimera軟件進行蛋白預處理成mol2格式。在SciFinder-Explore數據庫(https://scifinder.cas.org/scifinder/view/scifinder/scifinderExplore.jsf)中下載保存活性化合物mol格式,利用ChemBioDraw Ultra 14.0軟件將其轉化成cdx格式,再使用Chem3D 19.0軟件進行能量最小化處理并保存mol2格式。將處理成mol2格式的靶點和分子在UCSF Chimera軟件中進行分子對接,得到結合能(affinity)。
1.8 珠子參總苷對L02細胞炎癥損傷模型的影響
1.8.1 MTT法檢測珠子參總苷對細胞炎癥損傷模型的保護作用 將L02細胞以1.5×105個/mL密度接種于96孔板中,培養24 h后,吸出培養基,給藥,將細胞分為空白組(基礎培養基)、脂多糖(LPS)(1 μg/mL)組、(LPS)(1 μg/mL)+珠子參(50、100 μg/mL)組,放入培養箱培養2 h后加入10 μL LPS,24 h后進行MTT檢測。
1.8.2 酶聯免疫法(ELISA)檢測細胞上清中IL-6、NO水平 按“1.8.1”項下方法培養細胞,24 h后收集細胞上清,根據IL-6 ELISA試劑盒(批號H201211-007b,欣博盛生物科技有限公司)、Griess試劑盒(批號DC15BA0731,BBI Life Science Corporation)說明書操作,分別檢測L02各組細胞上清中白介素6(IL-6)和一氧化氮(NO)的水平。
1.8.3 DAPI染色觀察L02細胞形態 將L02細胞以1.5×106個/mL的密度接種于6孔板中,培養24 h后給藥,2 h后取出在LPS組和LPS+珠子參組加入1 μg/mL LPS。經過24 h的培養,用 DAPI染色劑染色,分別在明場和熒光成像模式下,對細胞形態進行拍照。
2 結果
2.1 珠子參活性化合物的篩選 通過ETCM數據庫以及文獻檢索整理得到珠子參的候選活性化合物有43個,同時將其編號,并在ETCM、SwissTargetPrediction、SyMmap中獲得靶點247個。珠子參中活性化合物的基本信息見表1。

表1 珠子參中活性成分
2.2 疾病潛在靶點分析 通過Melacards數據庫檢索與保肝相關的靶點,獲得了309個。再將珠子參候選活性化合物的靶點和保肝相關靶點通過Venny 2.1.0取交集,得到共同靶點27個(圖1),對應成分37個。

圖1 珠子參成分和疾病的共有靶點Fig.1 Common targets of Panacis majoris Rhizoma components and diseases
2.3 珠子參成分靶點與疾病靶點蛋白互作網絡的構建 通過查找資料,得到珠子參保肝的18個相關靶點,分別為AKT1、ALB、CASP3、CD81、F2、F3、IL1B、IL2、IL6、IKBKB、JAK1、JUN、NFKBIA、NR1H4、PRKAB1、STAT3、TNF、TP53,將上述靶點導入STRING 11.0 數據庫中,構建PPI網絡(圖2)。其中,節點代表靶點,有94條邊相互連接,圖中越接近中心的節點即連接靶點較多的節點,在整個網絡中起到重要作用,可能是蛋白互作網絡中的核心靶點。

圖2 PPI網絡Fig.2 PPI network
2.4 “活性化合物-疾病-靶點”網絡的構建 將篩選到的18個靶點與對應的35個活性化合物進行映射并生成關聯表,將數據導入Cytoscape3.7.2軟件中構建“活性化合物-疾病-靶點”可視化網絡(圖3)。其中,節點大小代表度值(Degree)大小,度值越大,該節點在網絡中越重要,參與藥理作用越明顯。
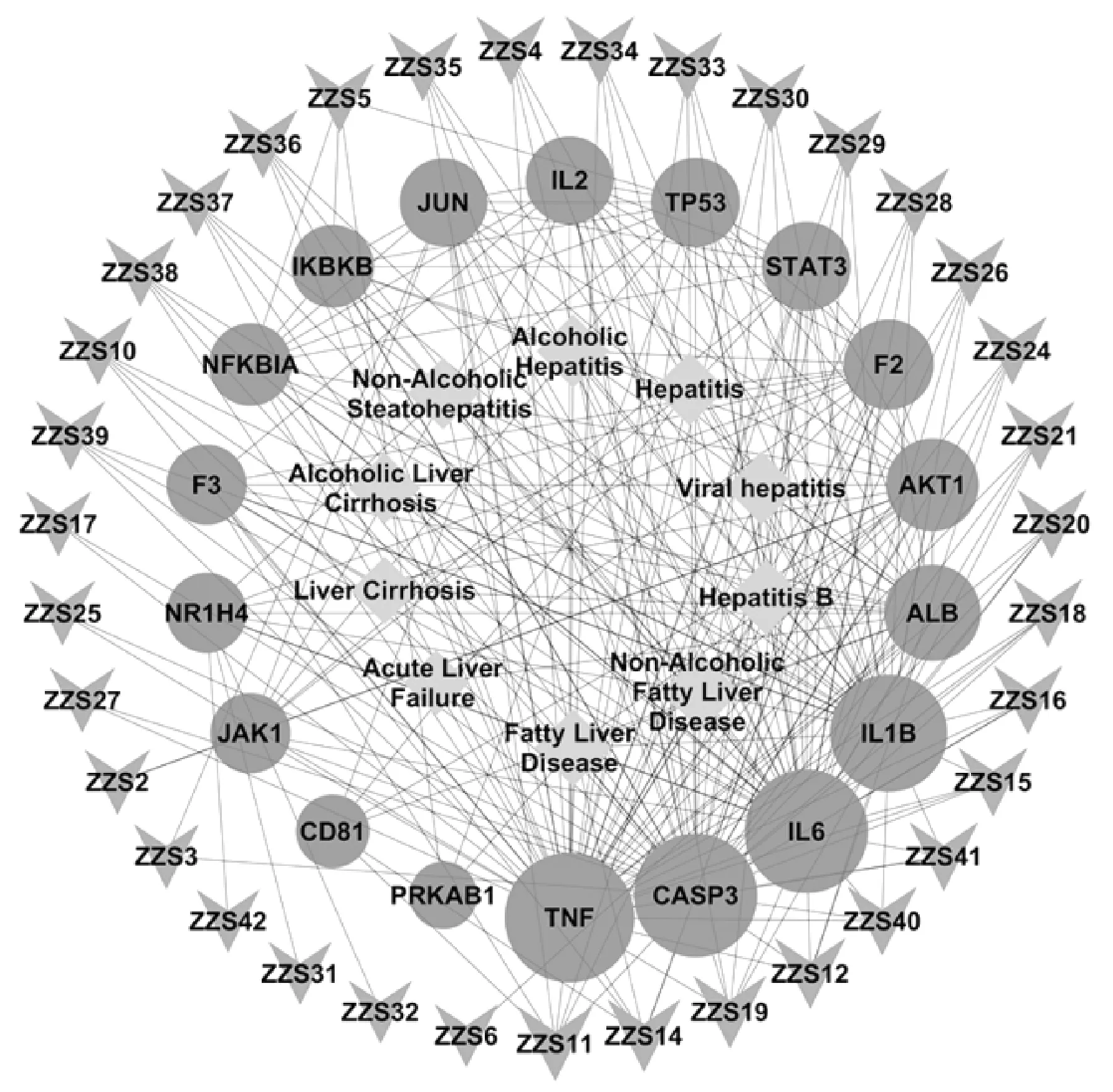
注:綠色菱形節點代表疾病,藍色圓形節點代表靶點,橘紅色倒三角節點代表活性化合物。圖3 “活性化合物-疾病-靶點”網絡Fig.3 Active Compound-disease-targets network
結果,竹節參皂苷Ⅳa(Chikusetsusaponin Ⅳa,ZZS11)、人參皂苷Ro(Ginsenoside Ro,ZZS14)、人參皂苷Re(Ginsenoside Re,ZZS19)、人參皂苷Rb2(Ginsenoside Rb2,ZZS12)、人參皂苷Rd2(Ginsenoside Rd2,ZZS40)度值比較大,分別為7、6、6、5、4,說明這些活性成分可能在珠子參發揮保肝作用的過程中起重要作用;排名靠前的靶點還有腫瘤壞死因子(TNF,Uniprot ID P01375)、白細胞介素6(IL6,Uniprot ID P05231)、半胱天冬酶3(CASP3,Uniprot ID P42574)、白細胞介素1B(IL1B,Uniprot ID P01584)、白蛋白(ALB,Uniprot ID P02768),分別為50、45、45、40、23,說明珠子參活性成分可能通過抗炎、調節免疫和凋亡等作用來參與保肝,并具有多成分、多靶點的特點。
2.5 GO和KEGG通路富集分析 將上述18個基因導入STRING數據庫,經檢索和轉化操作,進行GO和KEGG富集分析,共得到GO條目616條(P<0.05),包括生物學過程(BP)550條,分子功能(MF)47條,細胞組成(CC)19條,繪制各類別前10的條目(圖4),表明蛋白大部分在細胞外空間(GO 0005615,extracellular space)、細胞外泌體(GO 0070062,extracellular exosome)以及核染色質(GO 0000790,nuclear chromatin)等位置;進行細胞因子受體結合(GO 0005126,cytokine receptor binding)、蛋白質結合(GO 0005515,protein binding)以及信號受體結合(GO 0005102,signaling receptor binding)等分子功能;并參與細胞表面受體信號通路(GO 000716,cell surface receptor signaling pathway)、凋亡過程的負調控(GO 0043066,negative regulation of apoptotic process)以及調節免疫系統過程(GO 0002682,regulation of immune system process)等生物學過程。
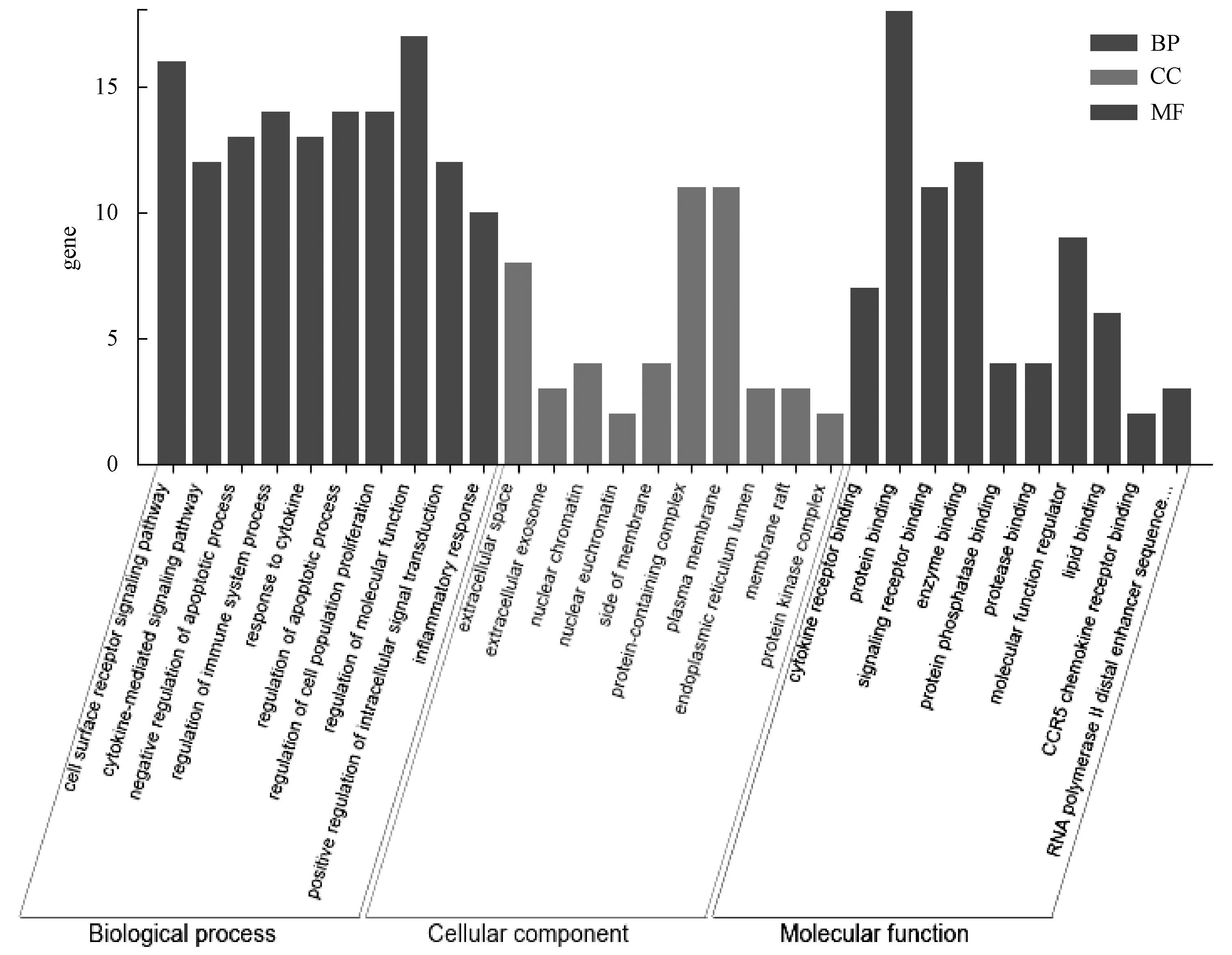
圖4 珠子參保肝靶點的GO富集分析Fig.4 Gene ontology enrichment analysis of the hepatoprotective targets of Panacis majoris Rhizoma
富集共得到KEGG信號通路122條可能與珠子參保肝作用機制有關(前20 條通路氣泡圖見圖5),其中與肝疾病相關通路3條,分別是乙型肝炎(hsa05161,hepatitis B)、丙型肝炎(hsa05160,hepatitis C)及非酒精性脂肪性肝病(hsa04932,NAFLD,non-alcoholic fatty liver disease);與炎癥相關通路5條,分別是Th17細胞分化(hsa04659,Th17 cell differentiation)、TNF 信號通路(hsa04668,TNF signaling pathway)、糖尿病并發癥中的AGE-RAGE信號通路(hsa04933,AGE-RAGE signaling pathway in diabetic complications)、IL17 信號通路(hsa04657,IL17 signaling pathway)及Toll樣受體信號通路(hsa04620,Toll-like receptor signaling pathway);與凋亡相關通路有1條為凋亡通路(hsa04210,Apoptosis);與癌癥相關通路有1條為癌癥通路(hsa05200,pathways in cancer),說明這些通路可能與珠子參的保肝作用有很大關系。
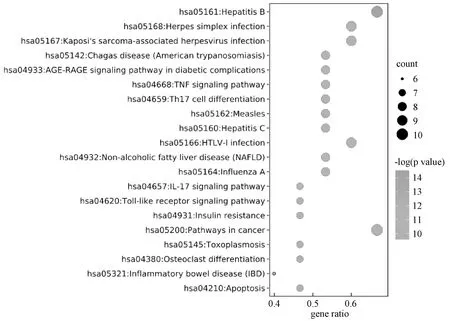
圖5 珠子參保肝靶點的KEGG通路富集分析Fig.5 KEGG pathway enrichment analysis of the hepatoprotective targets of Panacis majoris Rhizoma
2.6 “活性化合物-靶點-通路”網絡的構建 將上述通路及其基因整理得到15個基因以及對應活性成分31個,利用Cytoscape3.7.2構建“活性化合物-靶點-通路”網絡(圖6),得到珠子參保肝的主要活性成分有竹節參皂苷Ⅳa、人參皂苷Re、人參皂苷Ro、越南皂苷R4(Vina-ginsenosides R4,ZZS35)、三七皂苷R1(notoginsenoside R1,ZZS36)等,核心靶點主要包括TNF、CASP3、IL6、IL1B、原癌基因蛋白(JUN,Uniprot ID:P05412)等,通過乙型肝炎通路、Th17細胞分化通路、TNF 信號通路、AGE-RAGE信號通路、非酒精性脂肪性肝病通路、IL17 信號通路等來發揮作用。

注:綠色圓形節點代表靶點,紫色菱形節點代表通路,藍色三角形節點代表活性化合物。圖6 “活性化合物-靶點-通路”網絡Fig.6 Active Compound-targets-pathways network
2.7 分子對接 將“2.6”項下度值前5個重要靶點蛋白TNF(PDB ID 2AZ5)、CASP3(PDB ID 5KFA)、IL6(PDB ID 1ALU)、IL1B(PDB ID 3LTQ)、JUN(PDB ID 2P33),以及排名靠前的5個活性化合物竹節參皂苷Ⅳa、人參皂苷Re、人參皂苷Ro、越南皂苷R4、三七皂苷R1進行分子對接驗證。由表2可知,珠子參中重要化合物、靶點的結合能均<-5.0 kcal/mol,即結合性較好,主要為皂苷類化合物。由圖7可知,這些化合物主要與蛋白受體結合位點發生氫鍵作用。

表2 珠子參重要成分、靶點分子對接結果
2.8 珠子參總苷對L02細胞炎癥損傷模型的保護作用 由表3可見,珠子參總苷對LPS損傷的L02細胞有一定的保護作用,LPS組細胞活性較空白組下降;而LPS+珠子參組較LPS組細胞活性升高,損傷細胞恢復了25%~29%,并且對細胞沒有明顯損傷。由表4可見,與空白組比較,LPS組IL-6、NO水平升高(P<0.01);與模型組比較,LPS+珠子參100 μg/mL組兩者水平降低(P<0.01)。如圖8所示,空白組、LPS+珠子參50 μg/mL組、LPS+珠子參100 μg/mL組中細胞核幾乎沒有彌散現象及細胞表面損傷現象,但在LPS組中細胞數目少,細胞核有彌散現象。

注:粉色球棍模型為候選化合物分子,紅色為氧原子,藍色為氮原子。圖7 珠子參重要化合物與關鍵靶點相互作用圖Fig.7 Interaction diagrams of core Panacis majoris Rhizoma compounds and key targets
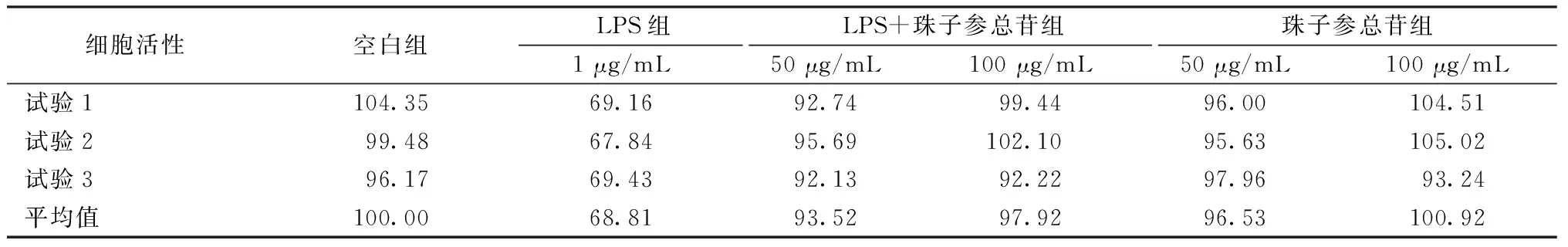
表3 珠子參總苷對LPS損傷L02細胞的保護作用(%,n=3)

表4 珠子參總苷對L02細胞中IL-6、NO水平的影響
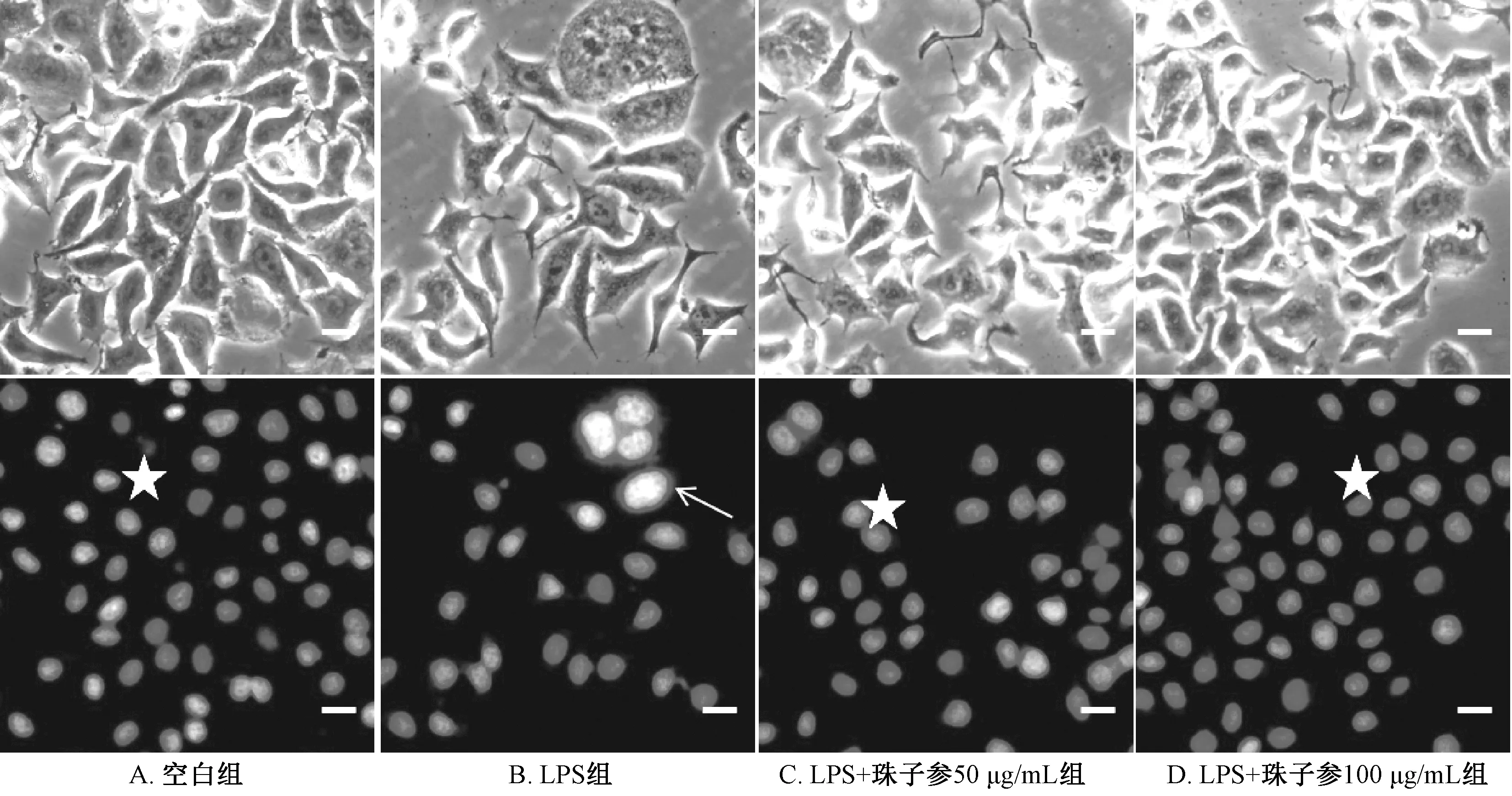
注:星號表示細胞正常生長,箭頭指示細胞受到LPS損傷后的細胞核。圖8 DAPI染色后各組細胞形態(×200)Fig.8 Cell morphologies in various groups after DAPI staining (×200)
3 討論
藏象學說認為,肝的生理功能主要有“肝主疏泄”和“肝主藏血”兩方面[11],它可促進人體的消化和氣、血、水的正常運行[12]。本研究基于網絡藥理學方法,建立成分-疾病-靶點的關聯研究網絡,從微觀的分子角度系統預測分析珠子參保肝的作用機制,為其進一步研究提供理論參考。
據報道[13],珠子參總皂苷是珠子參保肝的有效部位,其中竹節參皂苷Ⅳa和人參皂苷Ro是其主要有效成分,已有研究表明竹節參皂苷Ⅳa在原代培養大鼠肝細胞體外免疫性肝損傷的保護模型中顯示出肝保護活性[14]。李聰等[15]研究發現竹節參皂苷Ⅳa通過miR-17-5p/mitofusin 2 信號通路抑制線粒體功能障礙,使得轉化生長因子-β(TGF-β)、TNF-α、IL-1β等細胞因子的表達和合成降低,從而降低IL-6等炎性因子表達,另一方面也降低肝星狀細胞的活化,改善了非酒精性脂肪性肝炎、肝細胞炎癥、肝纖維化及肝細胞壞死等癥狀[16-18]。有研究[19]表明人參皂苷Ro對急慢性肝炎均有抑制作用。肝纖維化是肝硬化的早期階段,其中乙型肝炎是其最主要的病因之一。在肝纖維化形成過程中,三七皂苷R1可通過降低TGF-β等的表達減少肝星狀細胞的活化,降低細胞外基質積累來減輕肝纖維化[20]。本研究通過“成分-疾病-靶點”網絡關聯分析,發現珠子參發揮保肝作用的主要活性成分為竹節參皂苷Ⅳa、人參皂苷Re、人參皂苷Ro、越南皂苷R4和三七皂苷R1等。
TNF、IL-6、IL-1β是細胞促炎因子,目前認為,在脂肪肝的發病機制中TNF-α是主要因子,它誘導肝臟脂質合成,同時還促進脂肪細胞分解,從而加快肝細胞發生脂肪變性[21]。IL-6能夠促進細胞毒性淋巴細胞(CTL)、自然殺傷細胞(NK)的分化并增強殺瘤活性,且肝細胞壞死程度與IL-6、TNF-α的高表達密切相關[22]。IL-1β在炎性反應過程中起繼發作用,IL-1β增多可增加慢性炎癥反應和組織破壞[23]。CASP3主要參與凋亡過程,但在炎癥過程中也起著重要作用[24]。轉錄因子c-Jun能夠參與多種細胞過程,包括細胞增殖與凋亡,且可調控凋亡基因也可調控促凋亡基因。研究表明,從正常肝組織到肝硬化再到肝發生癌變,c-fos、c-jun因子的表達水平呈上升趨勢[25]。因此,TNF、CASP3、IL6、IL1B、JUN靶點對于保肝作用的研究非常重要。本研究通過KEGG通路富集發現,珠子參主要是通過TNF信號通路、AGE-RAGE信號通路、Th17細胞分化等通路中的TNF、CASP3、IL6、IL1B、JUN等靶點來進行保肝。
TNF能誘導細胞凋亡從而使機體產生炎癥反應,TNF信號通路、AGE-RAGE信號通路的激活,能夠激活誘導NF-κB入核,促進TNF-α、IL-6、IL-8等炎癥因子的釋放,從而引起和加重機體炎癥反應[26-27]。Th17細胞是一種CD4+T細胞亞群,具有獨立的分化和調節機制。Th17細胞主要分泌 IL-17和IL-21等標志性細胞因子[28]。乙型肝炎(HBV)主要通過自身免疫系統對已感染HBV的肝細胞進行攻擊而致肝細胞損傷,此時具有強大促炎作用的Th17細胞發揮著重要作用。近年研究發現慢性乙型肝炎患者外周血Th17數目和IL-17表達水平顯著升高,表明Th17與HBV感染后引起的肝細胞損傷有關[29-30]。另有研究顯示,IL-17不僅參與肝纖維化過程[31],還參與了肝細胞炎癥損傷過程。結合以往的研究以及本文研究結果,竹節參皂苷IVa和人參皂苷Ro和三七皂苷R1保肝作用預測分析機制圖見圖9。分子對接結果顯示,與TNF、CASP3和IL1B結合性較好的是竹節參皂苷Ⅳa和人參皂苷Ro,與IL6結合性較好的是竹節參皂苷Ⅳa、人參皂苷Ro和人參皂苷Re,與JUN結合性較好的是人參皂苷Re和三七皂苷R1,因此,與這5種重要蛋白受體作用的主要成分是竹節參皂苷Ⅳa、人參皂苷Ro和人參皂苷Re。由此表明,竹節參皂苷Ⅳa、人參皂苷Ro、人參皂苷Re有可能是珠子參中起保肝作用的核心成分。

圖9 竹節參皂苷Ⅳa、人參皂苷Ro和三七皂苷R1保肝作用預測機制圖Fig.9 Diagram for the predictive mechanism of the hepatoprotective effect of Chikusetsusaponin Ⅳa, Ginsenoside Ro and Notoginsenoside R1
本研究通過采用不同濃度梯度的珠子參總苷提取液對脂多糖誘導L02細胞的炎性損傷進行細胞實驗,結果表明珠子參總苷可以在一定程度上恢復L02細胞的炎性損傷,進一步驗證了珠子參總苷對炎性損傷的肝細胞具有保護作用,但只是從網絡藥理學、分子對接和細胞實驗初步證明了珠子參總苷對于炎性損傷的肝細胞有一定保護作用,對于更深層次的研究還需要更多實驗去證明。綜上所述,珠子參發揮保肝作用是主要通過活性成分竹節參皂苷Ⅳa、人參皂苷Re、人參皂苷Ro、越南皂苷R4以及三七皂苷R1等,與TNF、CASP3、IL6、IL1B、JUN等靶點相互作用,并調控乙型肝炎通路、Th17細胞分化、TNF信號通路和IL17信號通路等來發揮作用。通過分子對接技術和細胞實驗進一步驗證,珠子參可通過多成分、多靶點、多通路實現保肝作用。

