肝硬化食管胃靜脈曲張出血患者胃鏡治療術后再出血的影響因素分析
連 佳, 韓 濤, 向慧玲, 楊言開, 李庭紅, 劉 磊, 徐佰國, 孫立霞, 王 菲, 付彥超
天津市第三中心醫院 消化肝病科, 天津醫科大學三中心臨床學院, 天津市肝膽疾病研究所, 天津 300170
食管胃靜脈曲張出血是肝硬化患者最常見的嚴重并發癥,是導致死亡的主要原因之一。靜脈曲張出血后存活的肝硬化患者,1~2年內再出血率超過60%[1],每次出血病死率約為20%[2]。隨著治療方法與技術的發展,食管胃靜脈曲張出血患者胃鏡治療的有效率不斷提高,明顯改善了患者預后。但仍有部分患者行胃鏡治療后再出血,增加了患者的病死率及經濟負擔。本研究通過對肝硬化食管胃靜脈曲張出血行胃鏡治療的患者進行回顧性研究,篩選胃鏡治療術后再出血的影響因素,比較各因素在預測再出血方面的作用,以實現對肝硬化食管胃靜脈曲張出血患者行胃鏡治療后再出血的早期預測。
1 資料與方法
1.1 研究對象 選取2017年1月1日—2018年12月31日于本院住院的肝硬化食管胃靜脈曲張出血并行胃鏡治療的患者。診斷標準符合《肝硬化門靜脈高壓食管胃靜脈曲張出血的防治指南》[3]。納入標準:(1)經胃鏡診斷急性食管胃靜脈曲張出血的肝硬化患者,首次行胃鏡治療;(2)年齡≥18歲。排除標準:(1)非靜脈曲張出血患者;(2)曾行經頸靜脈肝內門體分流術、脾栓塞、脾切除等門靜脈高壓干預治療者;(3)合并心、肺、腦等重要臟器嚴重疾病者;(4)未能完成隨訪的患者。根據術后是否再發食管胃靜脈曲張出血,分為未出血組與出血組,并記錄再出血時間,分析影響再出血的危險因素。
1.2 治療方法 給予質子泵抑制劑、血管加壓素及其類似物和/或生長抑素及其類似物、抗生素等治療。若出現上消化道活動性出血,予三腔兩囊管壓迫止血,并依據出血量予輸懸浮紅細胞。生命體征穩定后立即行胃鏡檢查及內鏡下治療:食管靜脈曲張患者可采取以下3種治療方案之一,即單獨結扎治療、三明治法或結扎聯合三明治法;如果合并胃靜脈曲張則應用三明治法治療。三明治法是指聚桂醇+氰基丙烯酸酯注射液+聚桂醇注射治療方案。
1.3 數據收集 記錄患者年齡、性別,入院時基礎特征指標[ALT、AST、TBil、Alb、PT、國際標準化比值(INR)、WBC、PLT、Hb、血肌酐(Cr)、尿素氮(BUN)、血Na]、影像學指標(B超或CT/MRI增強掃描記錄脾長,是否存在肝癌)、并發癥(腹水、肝性腦病等);患者出院后,記錄是否進行胃鏡下食管胃靜脈曲張治療及治療次數;記錄隨訪時間,以患者入院時間為臨床觀察起點,以再發食管胃靜脈曲張出血/死亡/最后一次隨訪為觀察終點。
1.4 評分計算 患者入院時分別計算Child-Turcotte-Pugh(CTP)評分、PLT/脾長徑(PLTSLE)評分、AST/PLT(APRI)評分、肝纖維化4因子指數(FIB-4)、格拉斯哥-布拉奇福德出血評分(GBS)、白蛋白-膽紅素(ALBI)評分、終末期肝病模型(MELD)評分。CTP評分包括以下參數:肝性腦病、腹水、Alb、TBil、PT;PLTSLE=PLT(109/L)/脾長(mm);APRI=[AST(U/L)/ULN×100]/PLT(109/L);FIB-4=年齡(歲)×AST(U/L)/[PLT(109/L)×ALT(U/L)1/2];GBS評分包括以下參數:BUN、Hb、收縮壓、心率、性別、黑便、暈厥、肝臟疾病、心力衰竭;ALBI=[log10TBil(μmol/L)×0.66]+[-0.085×Alb(g/L)];MELD評分=9.57×ln(Cr)+3.78×ln(TBil)+11.2×ln(INR) +6.43×(肝硬化病因:酒精性、膽汁淤積性為0,其余為1)。
1.5 倫理學審查 本研究方案經由天津市第三中心醫院醫學倫理委員會審批,批號: IRB2020-016-01。
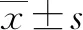
2 結果
2.1 一般資料 共納入267例肝硬化伴食管胃靜脈曲張出血患者,其中未出血組148例,出血組119例,兩組基線特征詳見表1。

表1 未出血組與出血組患者基線特征比較
2.2 再出血情況 共119例患者發生再出血,總再出血率為44.6%,中位再出血時間為11.0(0~39.0)個月。其中6周內發生再出血者37例(13.9%),6周~6個月39例(14.6%),7~12個月22例(8.2%),13~24個月18例(6.7%),3例(1.1%)患者超過24個月發生再出血。
2.3 再出血影響因素分析 以基線特征為自變量,靜脈曲張治療術后再出血及隨訪時間為因變量,進行Cox回歸分析。單因素分析結果顯示:肝癌、AST、Na、FIB-4均與再出血有關(P值均<0.05);多因素分析結果顯示:整體模型χ2值為46.536,P<0.001;肝癌、AST、PT、CTP、FIB-4、ALBI為再出血的獨立影響因素(P值均<0.05)(表2)。

表2 再出血影響因素Cox回歸分析
2.4 評分系統預測能力比較 ROC曲線分析結果如圖1所示,CTP、FIB-4、ALBI評分系統預測靜脈曲張治療術后再出血的AUC分別為0.711(95%CI:0.647~0.776)、0.705(95%CI:0.640~0.770)、0.730(95%CI:0.667~0.793);3項評分的AUC比較,差異均無統計學意義(Z值分別為0.494、1.154、1.251,P值均>0.05)。

圖1 CTP、FIB-4、ALBI評分系統預測再出血的ROC曲線
3 討論
肝硬化是一種具有較高病死率的慢性疾病,代償期無明顯臨床特征,失代償期則以門靜脈高壓和肝功能嚴重損傷為特征,常因食管胃靜脈曲張出血、肝性腦病、肝腎綜合征、肝癌、感染等導致多臟器功能衰竭而死亡[4]。6周內與急性靜脈曲張出血相關的再出血率和病死率均較高,分別為24%~30%[5-6]和12%~20%[7]。推薦胃鏡檢查用以篩選和診斷食管胃靜脈曲張及評估出血風險[8],但反復檢測會導致患者依從性差,給臨床觀察帶來困難。肝靜脈壓力梯度(hepatic venous pressure gradient, HVPG)的測定是門靜脈高壓診斷和療效評價的金標準[9],可有效預測食管胃靜脈曲張出血風險,但其為有創檢測,對設備及操作者的技術水平有一定要求,且成本較高,臨床推廣較難。目前,無創指標預測肝硬化合并靜脈曲張的血清學標志物不斷涌現,常見的有PLT、血清Alb、ALT以及CTP、FIB-4、APRI、ALBI評分系統等,其具有簡單、經濟、可重復等優點[10]。積極探索無創指標來預測胃鏡治療術后再出血的風險,具有重要的臨床意義。
本研究納入267例肝硬化伴食管胃靜脈曲張出血并行胃鏡治療的患者,觀察是否發生再出血及出血時間,并對臨床基線資料及CTP、MELD、PLTSLE、APRI、FIB-4、ALBI、GBS等評分系統進行統計學分析,比較各因素預測再出血的作用,篩選再出血高危患者,以進一步采取有效措施監測靜脈曲張程度及評估再出血風險,實施選擇性干預措施,降低再出血率,減輕患者的痛苦和經濟負擔,改善預后。本研究結果顯示,經胃鏡治療后共有119例(44.6%)患者發生再出血,其中6周內有37例(13.9%)、6周~6個月有39例(14.6%)發生再出血。通過Cox回歸分析發現,肝癌、AST、PT、CTP評分、FIB-4、ALBI是再出血的獨立影響因素(P值均<0.05)。應用ROC曲線分析,CTP、FIB-4、ALBI對再出血均有較好的預測價值,AUC分別為0.711、0.705、0.730。
CTP和MELD是臨床上最常用的肝硬化分期評分系統。在本研究中,CTP評分對再出血有較好的預測價值,而MELD評分未顯示出較好的預測能力,CTP優于MELD評分可用以識別胃鏡治療術后再出血的高危患者。目前研究[11-14]顯示,FIB-4不僅是肝硬化患者食管靜脈曲張的獨立預測因子,還是肝癌患者經肝動脈化療栓塞術后發生靜脈曲張出血的獨立預測因素。ALBI最初用于評估肝癌患者肝功能不全的嚴重程度,預測其生存率及總體預后[15]。目前相關研究[16-20]認為ALBI與HVPG有很好的相關性,可用于預測肝硬化急性上消化道出血患者的病死率,是肝硬化患者再出血的預測因子。本研究也同樣發現,FIB-4和ALBI對再出血具有較好的預測價值,預測能力與臨床常用的CTP評分無差異。目前已有證據[3]顯示,肝硬化CTP C級、門靜脈血栓或癌栓、重度靜脈曲張(直徑>20 mm)或伴紅色征、血皰征是食管胃靜脈曲張再出血的高危因素,而腹水、Alb、INR與臨床顯著門靜脈高壓癥相關。FIB-4與ALBI是臨床容易獲得的無創指標,計算簡單,可應用于臨床來篩選胃鏡治療術后再出血的高危患者,降低再出血風險。
綜上所述,肝癌、AST、PT、CTP、FIB-4、ALBI是肝硬化伴食管胃靜脈曲張出血行胃鏡治療術后再出血的獨立影響因素,CTP、FIB-4、ALBI評分系統對再出血結局均有較好的預測價值。雖然本研究對象具有不同的肝硬化病因,避免了針對單一病因的選擇偏倚,但仍需多中心前瞻性研究來進一步驗證結論。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:連佳、李庭紅、劉磊負責課題設計,資料分析,撰寫論文;徐佰國、孫立霞、王菲、付彥超參與收集數據,修改論文;韓濤、向慧玲、楊言開負責擬定寫作思路,指導撰寫文章并最后定稿。

