雙酚A 對PK-15 豬腎細胞DNA 損傷和細胞凋亡的影響
張 卓,孔艷彪,高斌戰(zhàn),宋寶敏,趙 婷,袁建琴
(1.山西農(nóng)業(yè)大學生命科學學院,山西太谷 030801;2.山西省獸用生物制品試驗推廣中心,山西太谷 030800)
雙酚A(Bisphenol A,BPA)是一種環(huán)境內(nèi)分泌干擾物[1-2],在化學工業(yè)產(chǎn)品中使用十分廣泛,主要用來生產(chǎn)聚碳酸酯和環(huán)氧樹脂塑料,并廣泛用于制造人們生活中經(jīng)常接觸到的物品,如食品罐、奶瓶和飲料容器等[2-5]。在惡劣的環(huán)境下,如高溫、酸或堿等條件下,這些塑料制品中的BPA 會釋放,并滲入到環(huán)境中[1,6]。目前,在人的羊水、血液、母乳、胎盤、汗液和尿液中都檢測到BPA,在許多其他生物中也可檢測到BPA[6-7]。環(huán)境污染可影響人的社會行為、焦慮水平、神經(jīng)功能及神經(jīng)遞質(zhì)含量等[1,6]。越來越多的研究表明,BPA 與動物健康異常有關(guān),表現(xiàn)為中樞神經(jīng)系統(tǒng)和肝臟內(nèi)源性大麻素系統(tǒng)的改變、精子質(zhì)量和數(shù)量指數(shù)性下降、神經(jīng)內(nèi)分泌紊亂、糖尿病、心臟病、肥胖癥以及惡性腫瘤等疾病[1,8-12],并發(fā)現(xiàn)BPA 可通過不同的作用機制發(fā)揮其毒性效應(yīng)[8-10,13-15]。單細胞凝膠電泳又稱彗星試驗,是一種在單細胞水平上檢測DNA 鏈損傷的方法,目前已成為全球研究熱點[16-17]。
健康的腎臟對機體的內(nèi)環(huán)境穩(wěn)態(tài)和正常代謝是必不可少的。在病理狀態(tài)下,多種因素在慢性腎病患者體內(nèi)積聚,導(dǎo)致尿毒癥和死亡率增加,以及包括虛弱、厭食、嘔吐、睡眠障礙、神經(jīng)病變、心血管疾病和進行性腎功能喪失在內(nèi)的癥狀。因此,尿液毒素的清除伴隨著臨床癥狀的改善[18-20]。HUANG等[21]研究表明,氧化應(yīng)激是BPA 毒性的一種基本機制。也有研究表明,BPA 可通過降低HepG2 細胞內(nèi)超氧化物歧化酶(Superoxide dismutase,SOD)活性,提高活性氧(Reactive oxygen species,ROS)水平以及硫代巴比妥酸反應(yīng)物(Thiobarbituric acid reactive substances,TBARS)含量誘導(dǎo)細胞氧化應(yīng)激[22]。ROS也會導(dǎo)致DNA 損傷[23]。在患不育癥的男性中,接觸BPA 有可能對精子DNA 的完整性和精子質(zhì)量造成潛在損害[24]。受損的DNA 可影響細胞功能,導(dǎo)致癌癥和各種慢性病疾病[25]。最近的研究表明,BPA 在細胞凋亡、增殖和遷移過程中具有毒性作用[6,26]。YUAN 等[26]證實了暴露于BPA 的Marc-145 細胞系中凋亡細胞和細胞核的數(shù)量明顯高于Marc-145 細胞系對照組,表明BPA 可更加特異的影響Marc-145細胞凋亡,同時BPA 誘導(dǎo)的細胞凋亡可能與Marc-145 細胞炎癥損傷有關(guān)。然而,目前有關(guān)BPA暴露對腎臟系統(tǒng)的毒性影響研究很少。
為了探究BPA 的腎毒性作用機制,本研究在前期研究的基礎(chǔ)上選擇10-3~10-6mol/L BPA[26]進行PK-15 豬腎細胞單細胞凝膠電泳試驗和Hochest 細胞凋亡檢測,分析BPA 對PK-15 豬腎細胞DNA 損傷和細胞凋亡的影響,為探討B(tài)PA 對豬腎細胞損傷的可能作用途徑,研究BPA 的腎毒性作用機制提供理論依據(jù)。
1 材料和方法
1.1 試驗材料
1.1.1 細胞系 PK-15 豬腎細胞系,由山西隆克爾生物制藥有限公司提供。
1.1.2 主要試劑 BPA 為上海阿拉丁生化科技股份有限公司產(chǎn)品(將2.282 9 g BPA 溶于10 mL 二甲基亞砜(DSMO,北京索萊寶公司提供),制成1 mol/L BPA 溶液,經(jīng)0.22 μm 濾器過濾除菌后貯存于4 ℃冰箱備用。試驗當天制備從1×10-6mol/L 到1×10-3mol/L 的BPA 稀釋液);胎牛血清、正常熔點瓊脂糖、低熔點瓊脂糖、肌氨酸鈉、溴化乙錠、Triton-X-100、雙抗和Hoechst 33342 染料(即用型)購自北京索萊寶科技有限公司。MEM液體培養(yǎng)基由北京通正生物技術(shù)有限公司提供。其他試劑均為分析純,由山西農(nóng)業(yè)大學生命科學學院細胞生物學實驗室提供。
1.2 試驗方法
PK-15 豬腎細胞在含有6%胎牛血清、100 U/mL青霉素和100 μg/mL 鏈霉素的MEM 中于5%二氧化碳培養(yǎng)箱中37 ℃孵育培養(yǎng)48 h。對照組為上述配方下含有0.1%DMSO 的PK-15 豬腎細胞MEM培養(yǎng)液。在相同條件下,所有試驗都為6 個重復(fù)。
1.3 DNA 損傷檢測
分別向每組PK-15 豬腎細胞培養(yǎng)瓶中接入2 mL 不同濃度梯度的BPA(分別含BPA 10-3、10-4、10-5、10-6mol/L)的MEM 液體(含3%胎牛血清和100 U/mL 的雙抗),繼續(xù)在37 ℃5%的二氧化碳培養(yǎng)箱中培養(yǎng)PK-15 豬腎細胞。24 h 后,倒掉培養(yǎng)瓶中液體,分別向?qū)φ战M和BPA 攻毒組加入2 mL 的細胞分散液,消化約3 min,倒掉分散液。取5 mL(含3%胎牛血清)MEM培養(yǎng)液將細胞吹散開,然后吸取0.5 mL 細胞懸液置于1.5 mL 離心管中,貼好標簽,放于4 ℃冰箱中備用。
1.3.1 三明治膠板的制備 第1 層凝膠的制備:取80 μL 保存于56 ℃正常熔點瓊脂糖(0.5%)滴在磨砂載玻片的中心處,拿一片蓋玻片從左到右緩慢放下,使蓋玻片下的膠體內(nèi)無氣泡,4 ℃下凝固10 min;第2 層凝膠的制備:取事先配好的保存于37 ℃的低熔點瓊脂糖(0.5%)75 μL 加入10 μL 含有不同濃度梯度的BPA 細胞懸液(105個/mL),用移液槍緩慢吸打混勻,取適量細胞懸液滴在第1 層凝膠上,放置蓋玻片,4 ℃下凝固10 min;第3 層凝膠的制備:取85 μL 37 ℃預(yù)熱的低熔點瓊脂糖(0.5%)滴在已經(jīng)制備好的第2 層凝膠上,蓋上蓋玻片,避免產(chǎn)生氣泡,4 ℃下凝固10 min。
1.3.2 裂解PK-15 豬腎細胞 將完全凝固的載玻片放入4 ℃預(yù)冷的細胞裂解液中,在4 ℃下裂解3 h 左右(注意:細胞裂解液臨用前再加入1%體積的Triton-X-100 和10%的DMSO)。
1.3.3 堿解旋 3 h 后,取出三明治膠板,PBS 反復(fù)沖洗后晾干。把晾干后的三明治膠板水平置于凝膠電泳槽陽極端,向電泳槽中緩慢倒入4 ℃預(yù)冷的堿性電泳緩沖液,堿解旋20 min(注意:堿性電泳緩沖液液面要在膠板上方0.25 cm 左右)。
1.3.4 電泳與染色 常溫下,膠板在25 V、30 mA下電泳20 min。電泳結(jié)束后,將載玻片按照從高到低的BPA 濃度放入托盤中,向托盤中緩慢倒入4 ℃預(yù)冷的Tris-HCl 中和液,待液體完全浸沒膠板后中和15 min。最后在膠板上懸空滴入適量的30 μg/mL的EB 染色液,暗室染色10 min,并立即在熒光倒置顯微鏡下觀察。
1.4 細胞凋亡評估
為了評估BPA 誘導(dǎo)的細胞凋亡情況,將PK-15豬腎細胞以密度為1×105個/孔接種在96 孔細胞培養(yǎng)板中培養(yǎng)48 h,將細胞暴露于10-3、10-4、10-5、10-6mol/L 的BPA 中24 h。然后,用PBS 清洗并用-20 ℃預(yù)冷丙酮固定30 min,再用PBS 清洗。之后,將100 μL Hoechst 33342 染料(2 mg/mL)加入培養(yǎng)基中,37 ℃孵育5 min。在熒光顯微鏡下,統(tǒng)計3 個不同區(qū)域出現(xiàn)高度凝聚(濃縮)或碎裂的PK-15 豬腎細胞核。共檢測了200 個PK-15 豬腎細胞并計算各組細胞凋亡百分率。
1.5 數(shù)據(jù)處理與統(tǒng)計分析
所有數(shù)據(jù)都以平均值±標準誤表示。采用彗星分析軟件1.2.2(Comet Assay Software Project,CASP)對每張載玻片25 個隨機選擇的非重疊細胞進行顯微鏡下檢測和分析。使用GraphPad Prism 5.0 軟件對數(shù)據(jù)進行統(tǒng)計分析。采用單因素方差分析檢測處理組之間的差異,之后用Turkey's 多重比較作為事后檢驗。P<0.05 被認為具有統(tǒng)計學意義。
2 結(jié)果與分析
2.1 BPA 對PK-15 豬腎細胞彗星細胞率的影響
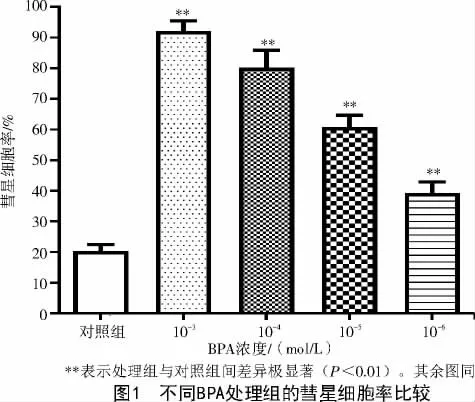
每張載玻片隨機選25 個細胞,計數(shù)彗星(拖尾)細胞數(shù)并計算彗星細胞率。試驗結(jié)果顯示,4 個BPA處理組(10-3、10-4、10-5、10-6mol/L)PK-15 豬腎細胞的彗星細胞率分別為93.10%±2.22%、81.05%±4.91%、61.02%±4.01%、38.99%±3.59%,均比對照組的彗星細胞率(20.19%±1.98%)極顯著提高(P<0.01),并且隨著BPA 濃度的升高,彗星細胞率顯著增加(圖1)。
2.2 BPA 對PK-15 豬腎細胞拖尾長度 (尾長)的影響
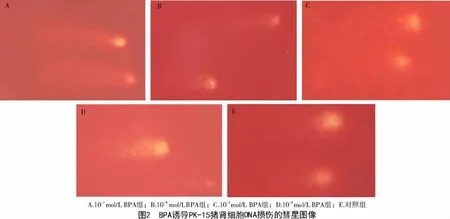
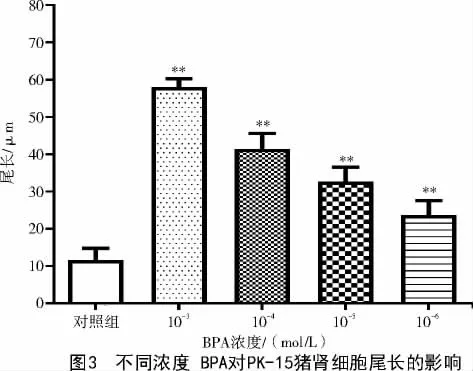
對PK-15 豬腎細胞在標準條件下進行堿性單細胞凝膠電泳,圖2 為BPA 誘導(dǎo)PK-15 豬腎細胞典型的彗星結(jié)構(gòu)圖像和DNA 單鏈斷裂情況。彗星細胞的典型圖像清楚地顯示,隨著BPA 劑量的增加,從彗星頭部釋放出來的DNA 斷裂程度增加(圖2);且隨著BPA 濃度(10-3、10-4、10-5、10-6mol/L)的減小,PK-15 豬腎彗星細胞尾長縮短,分別為(57.86±2.21)μm、(41.01 ±4.13)μm、(33.02 ±3.79)μm、(23.66±3.94)μm,與對照組相比(尾長為(11.61±3.12)μm)差異顯著(P<0.01)(圖3)。
2.3 BPA 對PK-15 豬腎細胞尾部DNA 含量的影響
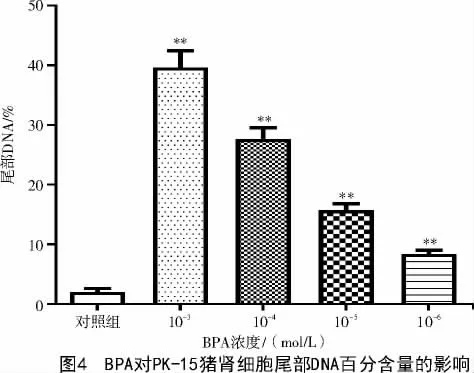
采用Comet Assay Software Project(CASP)1.2.2和GraphPad Prism 5.0 軟件對對照組以及10-3~10-6mol/LBPA 處理的試驗組進行了PK-15 豬腎細胞彗星細胞尾部DNA 百分含量分析。由圖4 可知,與對照組尾部DNA 百分含量(2.04%±0.62%)相比,不同濃度BPA(10-3、10-4、10-5、10-6mol/L)激發(fā)的PK-15 豬腎細胞彗星細胞尾部DNA 百分含量分別為39.59%±2.81%、27.68%±1.92%、16.03%±1.09%、8.41%±0.64%,呈劑量依賴性升高,均極顯著高于對照組(P<0.01)。
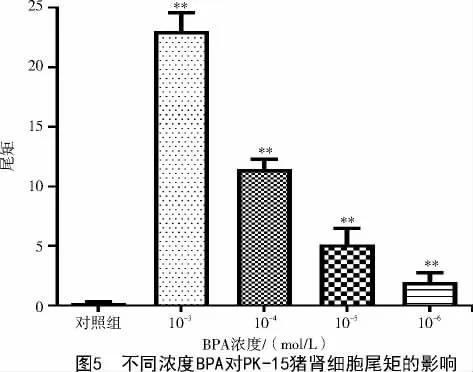
2.4 BPA 對PK-15 豬腎細胞尾矩的影響
尾矩是彗星細胞尾長與細胞尾部DNA 百分含量的乘積。在細胞高度損傷劑量下,尾矩與細胞損傷程度呈線性關(guān)系。從圖5 可以看出,10-3、10-4、10-5、10-6mol/L BPA 處理的PK-15 豬腎細胞尾矩分別為23.11±1.49、11.52±0.78、5.14±1.36、1.96±0.79,與對照組(0.21±0.12)相比差異極顯著(P<0.01),并且隨著BPA 濃度的降低,尾矩下降,相應(yīng)的細胞損傷程度下降。
2.5 BPA 誘導(dǎo)PK-15 豬腎細胞的細胞凋亡
凋亡細胞出現(xiàn)萎縮或凝聚的細胞核。從圖6 可以看出,對照組中幾乎沒有凋亡的PK-15 豬腎細胞。由圖7 可知,暴露于不同濃度(10-3、10-4、10-5、10-6mol/L)BPA 的PK-15 豬腎細胞凋亡率隨著BPA濃度的升高而升高,BPA 暴露組PK-15 豬腎細胞細胞凋亡呈劑量依賴性增加(P<0.01)。
3 結(jié)論與討論
BPA 被廣泛用于生產(chǎn)環(huán)氧樹脂和聚碳酸酯塑料。在惡劣的環(huán)境下,這些塑料可能會釋放可滲入環(huán)境的BPA,但是,關(guān)于BPA 對動物慢性腎病的有害影響及其作用機制的報道很少。通過研究得知,隨著BPA 濃度的升高,PK-15 豬腎細胞細胞核DNA 損傷增強;彗星細胞率、彗星細胞DNA 尾長、細胞尾部DNA 百分含量和尾矩均比對照組顯著提高。表明隨著BPA 濃度的升高,相應(yīng)的細胞核DNA損傷程度也在加劇。研究結(jié)果也證實了,暴露于BPA的PK-15 豬腎細胞凋亡細胞的數(shù)量明顯高于對照組,表明BPA 可特異地誘發(fā)PK-15 豬腎細胞凋亡,即暴露于BPA 可誘導(dǎo)PK-15 豬腎細胞DNA 損傷和細胞凋亡。
彗星試驗是一種檢測單細胞中DNA 鏈斷裂的電泳技術(shù)。由于其簡便、快速、靈敏、無需放射免疫和檢測細胞數(shù)量少等優(yōu)點,適用于不同類型的體內(nèi)外試驗和各種類型的細胞DNA 損傷研究。通常,細胞核的DNA 分子量很大,是一種超螺旋結(jié)構(gòu),并且附著在細胞核的基質(zhì)中[16,26]。用正常熔點瓊脂糖和低熔點瓊脂糖凝膠呈三明治夾心法將PK-15 豬腎細胞包埋在磨砂的載玻片上,在堿性裂解液的作用下,細胞膜和核膜被破壞,使PK-15 豬腎細胞內(nèi)的蛋白質(zhì)、RNA 以及其他成分進入瓊脂糖凝膠,并進一步擴散到堿性裂解液中,只有PK-15 豬腎細胞的細胞核DNA 仍然附著在其核骨架上且留在原位。若PK-15 豬腎細胞未受到BPA 損傷,電泳時細胞核DNA 就會因其分子量較大而留在PK-15 豬腎細胞細胞核基質(zhì)中,經(jīng)EB 染色后呈現(xiàn)圓形的橘紅色熒光團,無彗星拖尾現(xiàn)象;若PK-15 豬腎細胞受到BPA 損傷,則在堿性的凝膠電泳液中,首先是PK-15 豬腎細胞核DNA 雙鏈解螺旋成為單鏈,之后單鏈斷裂的碎片因其分子量較小可進入瓊脂糖凝膠中,在凝膠電泳時斷裂或碎片DNA 離開PK-15 豬腎細胞核DNA 向陽極遷移,并形成拖尾。PK-15 豬腎細胞受到BPA 損傷愈嚴重,細胞核DNA 損傷也愈嚴重,產(chǎn)生的DNA 斷鏈愈多,其短片段或斷鏈也就愈小,在凝膠電泳電場作用下遷移的PK-15 豬腎細胞細胞核DNA 的百分含量越高,遷移的距離也越長,表現(xiàn)為PK-15 豬腎細胞核DNA 尾長增加和尾部橘紅色熒光強度增強。因此,通過測定PK-15 豬腎細胞核中DNA 的彗星細胞率、尾長、尾部DNA 百分含量和尾矩就可定量測定單個PK-15 豬腎細胞DNA 的損傷程度。
在本研究中,BPA 可引起嚴重的PK-15 豬腎細胞DNA 片段損傷和明顯的拖尾,隨著BPA 濃度的升高,可發(fā)現(xiàn)DNA 損傷增強,彗星細胞率、尾長、彗星細胞尾部DNA 和尾矩增加,可能的原因是BPA 通過提高氧化應(yīng)激損傷和抑制DNA 損傷的修復(fù)途徑影響了PK-15 豬腎細胞核DNA 雙鏈的穩(wěn)定性。
此外,BPA 可誘導(dǎo)組織細胞內(nèi)自由基含量增多,造成脂質(zhì)過氧化程度加劇,抗氧化酶(SOD)活性和谷胱甘肽(Glutathione,GSH)的產(chǎn)量降低[26]。組織細胞內(nèi)自由基增多,可促使細胞中的多種物質(zhì)發(fā)生氧化,進一步影響細胞內(nèi)生物酶的活性,導(dǎo)致細胞凋亡率增加。所以,自由基產(chǎn)生增加與BPA 毒性密切相關(guān),是BPA 損傷組織細胞的中心環(huán)節(jié)。
在本研究中,隨著BPA 濃度的升高,自由基直接作用于核酸,引起核內(nèi)DNA 雙鏈斷裂程度增加,進而引發(fā)脂質(zhì)過氧化作用而造成DNA 鏈損傷增強,出現(xiàn)明顯的拖尾現(xiàn)象,彗星細胞率、尾長、彗星細胞尾部DNA 百分含量、尾矩和細胞凋亡率增加,說明暴露于BPA 細胞的遺傳毒性是不容忽視的。
綜上所述,本研究選擇4 個不同濃度BPA(10-3、10-4、10-5、10-6mol/L)處理PK-15 豬腎細胞,24 h 后進行單細胞凝膠電泳和Hoechst 細胞凋亡檢測和分析,發(fā)現(xiàn)隨著BPA 濃度的升高,豬腎細胞DNA 損傷和細胞凋亡加劇。本研究為BPA 對動物腎臟的毒性作用研究提供了一定的信息,下一步實驗室將進行BPA 對小鼠腎臟的影響及分子損傷機制研究。

