一貫煎對急性肝竇阻塞綜合征大鼠模型的干預作用及其部分效應機制
高思琦 肖準 王曉檸 劉偉 陳佳美 劉平
肝竇阻塞綜合征(hepatic sinus obstruction syndrome,HSOS),即肝小靜脈閉塞性阻塞(hepatic veno-occlusive disease,HVOD),是由肝竇內皮細胞損傷導致的肝竇流出道梗阻的肝內門靜脈高壓綜合征,可進展為多器官衰竭,其死亡率極高[1]。在中國,攝入含有天然毒性吡咯里西啶生物堿的土三七是導致HSOS的主要原因[2-4]。目前,臨床尚無有效的治療藥物,現行可用的僅有去纖苷,在歐洲被批準用于治療造血干細胞移植后的重癥HSOS,但其治療具有一定局限性[5]。現有研究表明,中藥的一些活性成分具有改善HSOS的作用,如芝麻酚、川芎嗪等[6-7],其主要作用機制可能與抗炎抗氧化相關。中醫名方一貫煎出自清代醫家魏之秀的《續名醫類案》,由生地黃、麥冬、北沙參、枸杞、當歸、川楝子六味中藥組成,主治“脅痛,吞酸,吐酸,疝瘕,一切肝病”,有滋陰養肝之效。現代研究表明,一貫煎具有良好的抗肝纖維化作用,其主要作用機制與抗炎抗氧化,抗肝細胞損傷,改善肝竇毛細血管化以及抑制肝星狀細胞活化有關[8-9]。然而一貫煎對于HSOS的干預作用尚未見報道。本研究探究中藥復方一貫煎對野百合堿(monocrotaline,MCT)誘導的急性HSOS大鼠模型的干預作用,觀察氧化應激、炎癥及細胞凋亡相關指標并探討其可能的作用機制。
1 材料與方法
1.1 實驗動物
SPF級雄性Sprague-Dawley(SD)大鼠,體質量180~200 g,購自上海斯萊克實驗動物有限責任公司動物中心。動物許可證編號:XYXK(滬)2020-0009。飼養于上海中醫藥大學實驗動物中心,自由飲食飲水,恒溫恒濕,晝夜交替。動物實驗經上海中醫藥大學實驗動物倫理委員會批準(PZSHUTCM190315007)。
1.2 藥物、試劑和儀器
一貫煎由生地黃(18 g)、麥冬(10 g)、北沙參(10 g)、枸杞子(12 g)、當歸(10 g)、川楝子(4.5 g)六味中藥組成,浸膏粉(含生藥3.021 g/g)由上海中醫藥大學附屬曙光醫院制劑中心(國家中醫藥管理局三級實驗室)一次性制備。
野百合堿購自Sigma公司(C2401);丙氨酸/天冬氨酸氨基轉移酶(alanine aminotransferase/aspartate aminotransferase, ALT/AST)、總超氧化物歧化酶(total superoxide dismutase,T-SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽-S-轉移酶(glutathione s-transferase,GST)活性檢測以及蘇木素—伊紅(hematoxylin-eosin staining,HE)染色的試劑盒均購自南京建成生物工程研究所;免疫組化試劑盒購自基因科技(GK500705,批號:2018082901);TUNEL細胞凋亡檢測試劑盒(顯色法)購自碧云天(C1091,批號:031819190703);逆轉錄試劑盒購自日本Toyobo公司;BCA蛋白質測定試劑盒購自Thermo 公司;甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體購自Proteintech公司。PCR引物由生工生物工程(上海)股份有限公司合成,引物序列見表1。

表1 引物序列
F200PRO型酶標儀(瑞士Tecan集團公司);VIIA7型PCR儀(美國ABI公司);041BR127719型電泳儀及轉膜儀(美國Bio-Rad公司);OdysseyCLX雙色紅外熒光成像系統(美國LI-CORBiosciences公司); SCN400型數據切片掃描機(德國Leica公司); QUANTA FEG 250環境掃描電子顯微鏡(荷蘭飛利浦公司生產)。
1.3 動物模型制備與分組
將SD大鼠適應性飼養后根據體質量隨機分為正常對照組、模型組及一貫煎組,每組8只,模型組及一貫煎組大鼠采用90 mg/kg MCT灌胃制備HSOS模型,正常對照組同時灌胃等量的蒸餾水。造模后6小時、30小時對一貫煎組大鼠予一貫煎(劑量為1.139g/kg)灌胃兩次,模型組灌胃等量的蒸餾水,灌胃藥液量為10 mL/kg。48小時后,各組均未見死亡,以3%戊巴比妥鈉腹腔注射麻醉后處死取材,采集血液(靜置3小時后,轉速1000 g/分鐘,離心15分鐘獲取血清)和肝組織樣本用于后續實驗。
1.4 血清生化分析及組織病理學觀察
將血清樣本室溫解凍,振蕩混勻,按照試劑盒說明書步驟檢測ALT和AST活性。肝組織病理學樣品取肝臟大葉同一部位肝組織,置于10%中性甲醛緩沖液固定,自動脫水機脫水,石蠟包埋,切片,HE染色,封片,使用數據切片掃描機自動掃描,觀察肝細胞損傷、炎癥反應程度等。掃描電子顯微鏡觀察樣品制備:先用PBS通過大鼠腹主動脈灌注,后用含有2.5%戊二醛的固定液灌注、取樣,樣本處理后用QUANTA FEG 250環境掃描電子顯微鏡觀察。
1.5 MDA含量、T-SOD及GST活性檢測
在預冷的PBS中勻漿肝組織,采用MDA試劑盒測定。BCA法檢測肝組織蛋白質濃度,MDA量表示為nmol/mg蛋白。肝臟T-SOD、GST活性檢測同上,均根據試劑盒說明書測定。
1.6 實時熒光定量聚合酶鏈式反應(Real-time PCR)檢測mRNA表達
稱取肝組織,加入Trizol試劑對組織總RNA進行提取后,使用逆轉錄試劑盒對總RNA進行逆轉錄,得到cDNA。用Real-time PCR檢測肝組織mRNA的表達水平,采用2-ΔΔCt法計算各mRNA的表達量。
1.7 蛋白免疫印跡法(Western Blot,WB)檢測肝組織蛋白表達
稱取肝組織,加RIPA蛋白裂解液后,使用全自動研磨儀勻漿,提取上清液,BCA蛋白定量并加上樣緩沖液。制備10%聚丙烯酰胺凝膠進行電泳,轉膜,膜封閉及抗體反應,使用odydssey紅外圖像系統檢測,采用Image J軟件分析各條帶灰度值。
1.8 免疫組化染色
肝組織石蠟切片常規脫蠟復水,置于檸檬酸緩沖液(檸檬酸三鈉3 g+檸檬酸0.4 g,定容至1000 mL)中,微波爐高溫抗原修復,自然冷卻至室溫。將切片取出浸泡于3%過氧化氫溶液滅活內源性過氧化物酶,室溫避光孵育10分鐘,滴加10%山羊血清封閉30分鐘,滴加一抗,4℃過夜。次日使用免疫組化試劑盒孵育二抗,37℃,30分鐘,DAB顯色,然后用蘇木素染細胞核,梯度酒精脫水,二甲苯透明后用中性樹膠封片,顯微鏡下觀察。
1.9 TUNEL法檢測肝組織細胞凋亡
根據碧云天TUNEL試劑盒說明書操作。
1.10統計學分析
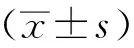
2 結果
2.1 一貫煎對MCT誘導的大鼠HSOS病理學變化及干預作用
模型組血清ALT及AST活性較正常對照組顯著升高(P<0.01),一貫煎組可顯著降低MCT誘導的血清ALT、AST活性(P<0.05)。見表2。
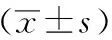
表2 各組HSOS大鼠血清ALT、AST活性比較
肝組織HE染色可見正常組肝臟組織結構正常,肝板排列整齊,匯管區未見擴大及炎癥細胞浸潤。而模型組則見肝臟結構破壞嚴重,肝細胞大面積壞死,匯管區周圍炎性細胞浸潤,肝竇內紅細胞大量聚集,“瘀血”現象明顯,一貫煎組肝組織損傷明顯減輕。見圖1。
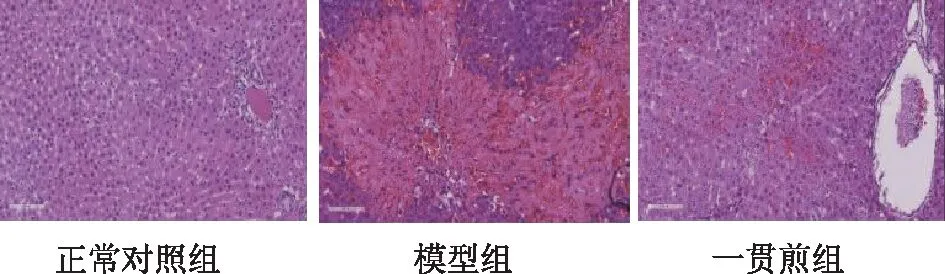
圖1 各組HSOS大鼠肝組織HE染色結果(×200)
肝組織掃描電鏡結果可見,與正常對照組相比,模型組肝竇內皮呈現連續性破壞,肝竇內皮窗孔擴大,“篩狀”結構消失,甚至脫落,使Disse空間暴露;而一貫煎組的肝竇內皮損傷病變明顯改善,表明一貫煎可顯著改善MCT誘導的HSOS大鼠的肝竇內皮細胞損傷、肝細胞壞死等病理改變。見圖2。

圖2 各組HSOS大鼠肝組織掃描電鏡結果(×20,000)
2.2 一貫煎對MCT誘導的HSOS大鼠肝臟氧化應激及炎性因子的影響
與正常對照組相比,模型組肝組織GST活性和MDA含量顯著升高(P<0.05),一貫煎組肝組織GST活性較模型組有所降低,MDA較模型組顯著降低(P<0.05)。模型組T-SOD活性較正常對照組顯著降低(P<0.01);與模型組相比,一貫煎組肝組織T-SOD有升高的趨勢。見表3。
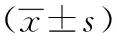
表3 各組HSOS大鼠肝組織GST活性、T-SOD活性和MDA含量比較
與正常對照組相比,模型組肝組織炎癥相關因子如腫瘤壞死因子α(tumor necrosis factor α,TNF-α)、白細胞介素1β(interleukin-1β,IL-1β)、血紅加氧酶(heme oxygenase 1,HO-1)及炎癥小體(nod-like receptor protein 3,NLRP3)的mRNA表達顯著增加(P<0.01),而一貫煎干預組肝組織中這些基因的表達較模型組顯著降低(IL-1β:P<0.05,HO-1:P<0.01)。見表4。
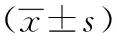
表4 各組HSOS大鼠肝組織TNF-α、IL-1β、HO-1及NLRP3的mRNA表達比較
與正常對照組相比,模型組肝組織TNF-α蛋白表達顯著升高(P<0.01),而一貫煎組肝組織TNF-α的蛋白表達較模型組顯著降低(P<0.01)。見圖3、表5。此外,肝組織巨噬細胞標志物F4/80免疫組化染色結果顯示,與正常組相比,模型組F4/80的陽性面積顯著增加,一貫煎干預后F4/80的陽性面積明顯減少(見圖4)。以上結果提示一貫煎可改善MCT誘導的HSOS大鼠肝臟氧化應激及炎癥反應。

圖3 各組HSOS大鼠肝組織TNF-α蛋白表達
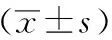
表5 各組HSOS大鼠肝組織TNF-α蛋白表達比較
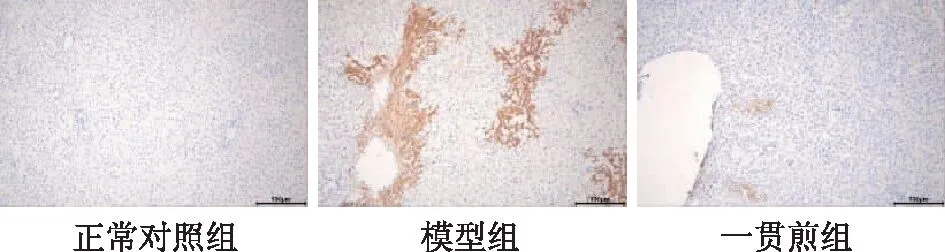
圖4 各組HSOS大鼠肝組織F4/80蛋白表達(×200)
2.3 一貫煎對MCT誘導的HSOS大鼠肝細胞凋亡的影響
肝組織經TUNEL染色可見,正常組肝組織幾乎沒有TUNEL陽性表達;模型組肝組織TUNEL主要表達在肝細胞上,TUNEL陽性細胞顯著增多;一貫煎組肝組織TUNEL陽性細胞數較模型組明顯減少(見圖5)。進一步檢測凋亡相關蛋白B淋巴細胞瘤-2(B-cell lymphoma-2,Bcl2)和Bcl-2相關X蛋白(Bcl-2 associated X,Bax)的表達發現,模型組肝組織Bcl2的蛋白表達及Bcl2/Bax的比值較正常組顯著降低(P<0.01,P<0.05),而一貫煎組干預后均有所提高(見圖6、表6),提示一貫煎可顯著減輕MCT誘導的HSOS大鼠肝細胞凋亡。
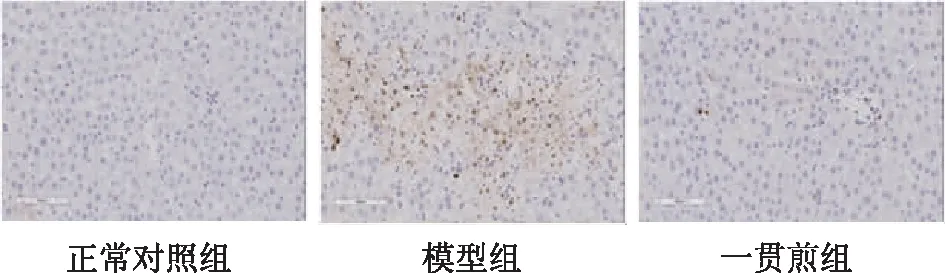
圖5 各組HSOS大鼠肝組織凋亡TUNEL染色(×200)

圖6 各組HSOS大鼠肝組織Bcl2/Bax蛋白表達
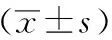
表6 各組HSOS大鼠肝組織Bcl2/Bax蛋白表達比較
3 討論
HSOS作為一種肝病的危重癥,常因肝腫大、腹水、黃疸、門靜脈高壓甚至嚴重的肝衰竭而導致死亡,其在臨床上目前尚無可用的治療藥物。現行可用的去纖苷,臨床報道數據顯示,治療HSOS的治愈率僅25.5%[10]。除去纖苷外,一些單克隆抗體、索拉菲尼等也具有治療HSOS的作用,但仍處于實驗室研究階段[11-14]。國內提出的“吡咯生物堿相關肝竇阻塞綜合征診斷和治療專家共識意見(2017年, 南京)”[15]對該病的治療也僅限于對癥支持療法,因而探求HSOS的有效治療藥物具有十分重要的臨床意義。天然產物MCT屬于PAs,其代謝產物脫氫野百合堿可通過與肝竇內皮細胞上的F-actin共價結合,導致F-actin解聚,并進一步造成肝竇充血以及微循環障礙,引起廣泛的炎癥和組織壞死,最終形成HSOS。MCT誘導的HSOS模型具有典型的HSOS病理學特點,被廣泛用于HSOS的研究[16-18]。
HSOS疾病發生的關鍵環節在于肝竇內皮細胞損傷,電鏡下可見MCT造成的肝血竇擴張,內皮窗孔擴大,“篩狀”結構消失,甚至脫落而致竇內皮的不連續,以及Disse空間暴露等一系列肝竇內皮細胞嚴重損傷的表現,而一貫煎可顯著減輕肝竇內皮細胞的損傷。且一貫煎顯著降低MCT誘導的大鼠血清谷丙轉氨酶及谷草轉氨酶活性,顯著改善MCT大鼠肝組織病理改變。此外,TUNEL檢測結果還顯示一貫煎可顯著抑制HSOS大鼠肝組織的肝細胞凋亡。
強烈的氧化應激與HSOS的發生發展密切相關。MDA作為脂質過氧化的終產物,可影響線粒體鏈復合物及相關酶活性,加劇細胞損傷,是公認的有效評估組織氧化應激反應的標志物[19]。本研究中,MCT處理后造成肝臟內MDA的大量蓄積是強烈氧化應激的反映,而在予以一貫煎干預后則顯著下降。已有研究表明,中藥中的一些活性單體如黃芩素、綠原酸、兒茶素、甘草素與甘草苷均可通過調控相關代謝酶,提高機體抗氧化能力以發揮對MCT誘導的HSOS的改善作用[18, 20-21]。其中,GST可促進GSH與有親電子物質的結合,并清除體內脂質過氧化物。本研究中,MCT處理后造成肝臟急性損傷導致GST活性應激性的升高,而一貫煎干預后其活性降低。T-SOD的結果也提示一貫煎減弱了MCT誘導的大鼠肝臟氧化應激損傷。即結果均表明可能是通過減輕肝臟氧化應激損傷而改善MCT誘導的HSOS。
炎癥反應是HSOS發生發展中起關鍵作用的環節,其中TNF-α作為重要促炎因子[22],可響應氧化應激而被激活,可作為平衡細胞存活、凋亡和壞死中的主要調節劑,是聯系氧化應激反應與細胞死亡的重要環節。在本實驗中,MCT處理后肝組織TNF-α的mRNA和蛋白表達顯著增加,這與HSOS發生的嚴重的炎癥風暴及細胞死亡相一致。同時,在肝臟急性損傷后,巨噬細胞的浸潤一方面可介導炎癥的發生,另一方面對肝臟的血管及肝竇內皮細胞的修復具有十分重要的作用[23-24]。肝組織免疫組化染色顯示MCT造模后巨噬細胞標志物F4/80在損傷區域的大量陽性表達,提示肝組織發生了嚴重的炎癥反應。同時,MCT引起的氧化應激使得炎癥小體NLRP3和促炎因子IL-1β的mRNA表達顯著增加,而一貫煎干預后TNF-α、F4/80及IL-1β的表達顯著下降,表明一貫煎具有良好的抗炎作用。然而本實驗MCT處理后HO-1的mRNA表達顯著增加,而一貫煎干預后HO-1的mRNA表達顯著下降,該結果似乎與既往研究[25-26]不同。考慮導致差異的主要原因可能是由于體內實驗的復雜性,并且全身的反應不僅限于肝臟。MCT導致HO-1的mRNA表達的增加可能是由于強烈的氧化應激反應而誘發機體的自我防御能力,而一貫煎可顯著改善HSOS的病理變化,炎癥反應也顯著減輕,因此HO-1的mRNA表達隨之降低。
此外,細胞死亡也是HSOS的重要表現之一[1],其中由強烈的氧化應激引起的凋亡途徑是其中重要的環節。Bcl2家族蛋白在該途徑中發揮著重要的作用,包括抗凋亡蛋白Bcl2及促凋亡蛋白Bax[27]。MCT誘導的大鼠HSOS肝組織中可見嚴重的大面積的細胞死亡,而一貫煎干預后肝組織HE染色及TUNEL染色顯示出細胞凋亡明顯減輕,且Bcl2的表達和Bcl2/Bax升高,提示一貫煎可能是通過提高抗凋亡蛋白Bcl2的表達抑制肝細胞的凋亡進而改善HSOS。
綜上,一貫煎可顯著改善野百合堿誘導的大鼠HSOS,其作用機制可能與抗過氧化抗炎性損傷,抑制肝細胞凋亡有關。本研究為中醫古籍方劑一貫煎治療HSOS的臨床應用發展提供部分實驗基礎。
致謝 特別感謝上海中醫藥大學科技實驗中心陸雄、陸敏兩位老師對課題組的電鏡技術及病理解讀方面提供的幫助與支持!

