UHPLC-MS/MS法同時測定腸激安方凍干粉中10種成分
吳映秀, 唐洪梅, 王永福, 張毅靖, 黃育生, 甘劍峰
(1.佛山市中醫院,廣東 佛山 528000;2.廣州中醫藥大學第一附屬醫院,廣東 廣州 510405;3.廣州中醫藥大學第一臨床醫學院,廣東 廣州 510405;4.廣州中醫藥大學嶺南醫學研究中心,廣東 廣州 510405)
腸激安方由白芍、白術、黃芪、黃連、陳皮、防風、延胡索等13味藥材組成,為四君子湯、痛瀉要方加減而來,具有益氣健脾、止痛止瀉的功效[1-2],也是廣州中醫藥大學第一附屬醫院用于治療肝郁脾虛腹瀉型腸易激綜合征的臨床驗方,療效確切,含有豐富的生物堿、黃酮、苷類等成分,具有較強的藥理活性。方中白芍活性成分芍藥苷具有抗抑郁、免疫調節等藥理作用[3],黃芪中毛蕊異黃酮葡萄糖苷抗氧化、抗腫瘤、保護神經細胞[4-5],陳皮、枳殼中黃酮苷保肝、促進胃腸動力[6-8],防風中升麻素苷、5-O-甲基維斯阿米醇苷、升麻素具有鎮痛解熱、抗菌、抗炎等作用[9-10],黃連中鹽酸小檗堿止瀉、巴馬汀抗菌[11-12],延胡索中延胡索乙素具有鎮痛止痛等作用[13-14]。課題組前期測定了腸激安方中芍藥苷、白術內酯I、鹽酸小檗堿的含量[15],但尚未涉及其他成分,并且也無其他相關報道。因此,本實驗通過UHPLC-MS/MS法同時測定腸激安方凍干粉中芍藥苷、毛蕊異黃酮葡萄糖苷、橙皮苷、柚皮苷、升麻素苷、升麻素、5-O-甲基維斯阿米醇苷、鹽酸小檗堿、鹽酸巴馬汀、延胡索乙素的含量,為該方質量標準建立奠定基礎,也為含有相同成分其他制劑的含量檢測提供參考。
1 材料
1.1 儀器 TSQ-Quantum高效液相色譜-三重四極桿質譜聯用儀(配置Accela型高壓泵、ESI離子源、Accela型自動進樣器)、低溫高速離心機(美國Thermo Fisher公司);Advantage A10超純水系統(美國Millipore公司);XS205DU型電子分析天平(十萬分之一,瑞士Mettler-Toledo公司);恒溫數控超聲波清洗器(昆山市超聲儀器有限公司)。
1.2 試劑與藥物 橙皮苷(批號C-006-180216)、5-O-甲基維斯阿米醇苷(批號J-002-170731)、升麻素(批號S-007-170426)對照品均購于成都瑞芬思生物科技有限公司;毛蕊異黃酮葡萄糖苷(批號AF8060408)、芍藥苷(批號AF9030313)、升麻素苷(批號AF9012102)、鹽酸小檗堿(批號AF8062709)、柚皮苷(批號AF9072221)、鹽酸巴馬汀(批號AF9102703)、延胡索乙素(批號AF8111993)對照品均購于成都埃法生物科技有限公司;胡椒堿對照品購于中國食品藥品檢定研究院,批號110775-201405,以上對照品純度均≥98.0%。腸激安方中各藥材飲片均購于廣州中醫藥大學第一附屬醫院中藥房,經醫院藥檢室專家鑒定為正品,各3批,具體信息見表1。甲醇、乙腈、甲酸均為色譜純,購于德國Merck公司。

表1 各飲片信息
2 方法與結果
2.1 色譜條件 Phenomenex-C18色譜柱(2 mm×50 mm,5 μm);流動相乙腈(A)-水(含0.1%甲酸)(B),梯度洗脫(0~2.0 min,5%A;2.0~3.0 min,5%~30%A;3.0~4.0 min,30%A;4.0~5.0 min,30%~95%A;5.0~5.5 min,95%~5%A;5.5~7.0 min,5%A),每次進樣前以5%A預平衡15 min;體積流量0.7 mL/min;柱溫35 ℃;進樣量10 μL。
2.2 質譜條件 電噴霧離子源(ESI),噴霧電壓3 000 V(負離子)、3 500 V(正離子);鞘氣(N2)壓力30 psi(1 psi=0.133 kPa);輔氣(Ar)壓力10 psi;汽化室溫度350 ℃;離子傳輸管溫度300 ℃;全掃描、選擇離子監測(SRM)模式,正負離子同時掃描。質譜參數見表2,色譜圖見圖1。

表2 各成分質譜參數

1.芍藥苷 2.毛蕊異黃酮葡萄糖苷 3.橙皮苷 4.柚皮苷 5.升麻素苷 6.升麻素 7.5-O-甲基維斯阿米醇苷 8.鹽酸小檗堿 9.鹽酸巴馬汀 10.延胡索乙素 11.胡椒堿(內標)1.paeoniflorin 2.calycosin-7-O-β-D-glucoside 3.hesperidin 4. naringin 5.prim-O-glucosylcimifugin 6.cimifugin 7.4′-O-β-glucopyranosyl-5-O-methylvisamminol 8.berberine hydrochloride 9.palmatine hydrochloride 10.tetrahydropalmatine 11.piperine (internal standard)圖1 各成分提取離子流色譜圖Fig.1 Extracted ion current chromatograms of various constituents
2.3 對照品、內標溶液制備 精密稱取芍藥苷、毛蕊異黃酮葡萄糖苷、橙皮苷、柚皮苷、升麻素苷、升麻素、5-O-甲基維斯阿米醇苷、鹽酸小檗堿、鹽酸巴馬汀、延胡索乙素、胡椒堿對照品適量,甲醇分別制成345、211、248、260、282、262、234、242、245、325、114 μg/mL貯備液,置于4 ℃冰箱中密封保存。分別精密吸取上述對照品適量,甲醇稀釋至10、1 μg/mL溶液。將內標同法制得10 μg/mL溶液,備用。
2.4 供試品溶液制備 按組方稱取藥材,加入4倍量超純水浸泡30 min,加熱煮沸后小火煎煮40 min,過濾藥液,藥渣加3倍量超純水煮沸后小火煎煮30 min,濾出藥液,濾液合并濃縮至稠膏狀,-80 ℃下保存,按凍干機操作制成凍干粉(批號分別為CJA20180101、CJA20180301、CJA20180401),得率分別為20.0%、19.40%、18.98%,-20 ℃下保存備用。精密稱取腸激安方凍干粉0.5 g,置于具塞錐形瓶中,精密加入10 μg/mL內標溶液1 mL、70%甲醇9 mL,稱定質量,超聲(功率300 W、頻率40 kHz)提取30 min,放冷,70%甲醇補足減失的質量,3 000 r/min離心10 min,取上清液,過0.22 μm微孔濾膜,精密吸取1.0 mL濾液,置于10 mL量瓶中,甲醇定容至刻度,即得。
2.5 方法學考察
2.5.1 線性關系考察 精密吸取“2.3”項下對照品溶液適量,甲醇逐級稀釋,加入內標溶液混勻,制得系列質量濃度的標準曲線工作液。以待測成分與內標峰面積比值為縱坐標(Y),待測成分質量濃度為橫坐標(X)進行回歸,結果見表3,可知各成分在各自范圍內線性關系良好。
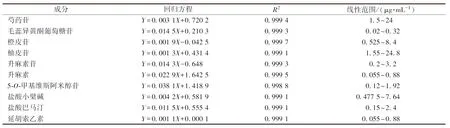
表3 各成分線性關系
2.5.2 精密度試驗 精密吸取“2.3”項下對照品溶液,在“2.1”“2.2”項條件下進樣測定6次,測得芍藥苷、毛蕊異黃酮葡萄糖苷、橙皮苷、柚皮苷、升麻素苷、升麻素、5-O-甲基維斯阿米醇苷、鹽酸小檗堿、鹽酸巴馬汀和延胡索乙素含量RSD分別為1.21%、1.88%、1.78%、2.17%、2.03%、1.32%、2.84%、1.65%、1.92%、2.36%,表明儀器精密度良好。
2.5.3 重復性試驗 精密稱取同一批凍干粉(CJA20180101)0.5 g,按“2.4”項下方法平行制備6份供試品溶液,在“2.1”“2.2”項條件下進樣測定,測得芍藥苷、毛蕊異黃酮葡萄糖苷、橙皮苷、柚皮苷、升麻素苷、升麻素、5-O-甲基維斯阿米醇苷、鹽酸小檗堿、鹽酸巴馬汀、延胡索乙素含量RSD分別為2.05%、2.43%、0.76%、2.47%、2.23%、2.32%、2.52%、2.15%、1.98%、1.81%,表明該方法重復性良好。
2.5.4 穩定性試驗 取同一份供試品溶液(CJA20180101),室溫下放置0、2、4、8、12、24 h后在“2.1”“2.2”項條件下進樣測定,測得芍藥苷、毛蕊異黃酮葡萄糖苷、橙皮苷、柚皮苷、升麻素苷、升麻素、5-O-甲基維斯阿米醇苷、鹽酸小檗堿、鹽酸巴馬汀、延胡索乙素含量RSD分別為2.23%、1.29%、1.30%、2.80%、2.53%、1.68%、2.96%、2.23%、1.88%、2.05%,表明溶液在24 h內穩定性良好。
2.5.5 加樣回收率試驗 稱取各成分含量已知的同一批凍干粉(CJA20180101)0.25 g,共6份,精密加入對照品溶液適量(芍藥苷0.065 9 mg、毛蕊異黃酮葡萄糖苷0.001 5 mg、橙皮苷0.034 9 mg、柚皮苷0.056 8 mg、升麻素苷0.011 5 mg、升麻素0.002 1 mg、5-O-甲基維斯阿米醇苷0.005 8 mg、鹽酸小檗堿0.030 4 mg、鹽酸巴馬汀0.009 8 mg、延胡索乙素0.001 9 mg),按“2.4”項下方法制備供試品溶液,在“2.1”“2.2”項條件下進樣測定,計算回收率。結果,芍藥苷、毛蕊異黃酮葡萄糖苷、橙皮苷、柚皮苷、升麻素苷、升麻素、5-O-甲基維斯阿米醇苷、鹽酸小檗堿、鹽酸巴馬汀、延胡索乙素平均加樣回收率分別為89.71%、90.68%、86.64%、85.92%、88.75%、92.86%、95.52%、101.12%、98.76%、86.78%,RSD分別為2.91%、2.31%、1.15%、1.56%、1.78%、2.85%、3.64%、4.13%、3.57%、2.88%。
2.6 樣品含量測定 精密稱取不同批次凍干粉0.5 g,按“2.4”項下方法制備供試品溶液,在“2.1”“2.2”項條件下進樣測定,計算含量,結果見表4。

表4 各成分含量測定結果(mg/g,n=3)
3 討論
3.1 色譜條件篩選 本實驗考察甲醇-水、甲醇-水(含0.1%甲酸)、乙腈-水、乙腈-水(含0.1%甲酸)對色譜峰的影響,發現以乙腈-水(含0.1%甲酸)為流動相時響應值高,峰形較好,故選其作為流動相。
3.2 質譜條件篩選 本實驗先將各對照品溶液在全掃描模式(Full scan)下確定母離子、碎片離子信息及離子模式(正或負),再根據各成分的離子對在SRM掃描模式下進行樣品的分析[16]。在離子檢測模式考察中發現,芍藥苷、橙皮苷、柚皮苷在負離子模式下響應較好,其余成分在正離子模式下響應較好,故采用正負離子同時掃描,以確保各成分能在各自最佳電離模式下檢測,而且靈敏度高。
3.3 提取條件篩選 本實驗先采用不同提取溶劑進行優化,結果確定為甲醇。再考察50%甲醇、70%甲醇、甲醇對樣品提取的影響,發現70%甲醇效果最佳,故選擇其作為提取溶劑。另外,為了使測定結果更準確,減少因操作條件等變化引起的誤差,本實驗采用內標法進行含量測定。
4 結論
本實驗建立了UHPLC-MS/MS法同時測定腸激安方凍干粉中芍藥苷、毛蕊異黃酮葡萄糖苷、橙皮苷、柚皮苷、升麻素苷、升麻素、5-O-甲基維斯阿米醇苷、鹽酸小檗堿、鹽酸巴馬汀、延胡索乙素的含量,該方法靈敏、簡便、快速,可為該方藥效物質基礎研究提供參考,也可用于相關制劑的質量控制與評價。

