響應(yīng)面法優(yōu)化高壓均質(zhì)破碎重組大腸桿菌的條件
游思亮 王裔娜 田瑞平 王青


摘要:通過單因素試驗,分析了均質(zhì)壓力、均質(zhì)次數(shù)和菌液濃度3個因素對大腸桿菌蛋白破碎率的影響。然后利用響應(yīng)面試驗擬合出大腸桿菌蛋白破碎率的回歸方程,優(yōu)化了高壓均質(zhì)法破碎大腸桿菌的試驗條件。結(jié)果表明,各因素對大腸桿菌蛋白破碎率影響順序為均質(zhì)次數(shù)(B)>均質(zhì)壓力(A)>菌液濃度(C)。在均質(zhì)壓力140 MPa、均質(zhì)次數(shù)4次、菌液濃度60 g/L時,大腸桿菌蛋白破碎率達到最高,為13.98%。
關(guān)鍵詞:響應(yīng)面;高壓均質(zhì);蛋白破碎率;大腸桿菌
中圖分類號: S182? 文獻標志碼: A
文章編號:1002-1302(2021)17-0071-04
收稿日期:2021-01-10
基金項目:國家自然科學基金(編號:31801350)。
作者簡介:游思亮(1984―),男,湖北武漢人,碩士,實驗師,主要從事大型儀器設(shè)備管理和功能開發(fā)。E-mail:yousl@njau.edu.cn。
在生物學領(lǐng)域,經(jīng)過改造過的細菌系統(tǒng)經(jīng)常用來表達各種外源重組產(chǎn)物,如蛋白質(zhì)、酶和抗體,大腸桿菌(Escherichia coli,簡稱E. coli)是其中最常見的寄主材料。這主要是由其特點決定的,大腸桿菌表達系統(tǒng)具有遺傳背景清楚、繁殖快、培養(yǎng)成本低、表達量高、表達產(chǎn)物容易純化、穩(wěn)定性好、抗污染能力強以及適用范圍廣等優(yōu)勢[1]。
但是重組蛋白通常在大腸桿菌細胞內(nèi)部表達,不能被大腸桿菌分泌到細胞外部,要提取純化蛋白還需要將大腸桿菌細胞破碎[2]。目前,用于提取大腸桿菌外源蛋白的常用細胞破碎方法主要有高壓均質(zhì)法、珠磨法、超聲波破碎法、滲透壓法、反復凍融法、酶解法和化學降解法[3-8]。高壓均質(zhì)法破碎細胞的原理是在高壓條件下使溶液通過均質(zhì)閥,溶液內(nèi)細胞經(jīng)過閥門的撞擊力、通道內(nèi)高速流體剪切力和瞬時壓力差3個不同的作用力后被破碎,釋放胞內(nèi)物質(zhì)達到細胞破碎的目的[9]。高壓均質(zhì)法作為一種物理破碎方式,具有破碎效率高[3-4]、無試劑消耗和污染[5]、可用于工業(yè)化生產(chǎn)等諸多優(yōu)點[10],正在被越來越多的研究者采用。
有學者利用高壓均質(zhì)法研究破碎大腸桿菌的試驗條件[7],但主要是探討單個因素對破碎結(jié)果的影響,沒有考慮到因素之間的交互作用,也沒有探討最優(yōu)化的試驗條件。本研究在單因素試驗的基礎(chǔ)上,利用響應(yīng)面法探討因素之間的交互作用以及最優(yōu)化的試驗條件。
1 材料與方法
1.1 材料與試劑
材料:E. coli DH5α為南京農(nóng)業(yè)大學小麥研究所保存,重組質(zhì)粒pCold-10477為小麥研究所構(gòu)建,按常規(guī)方法轉(zhuǎn)化獲得相應(yīng)重組工程菌。
試劑:蛋白胨、酵母提取物、氯化鈉、瓊脂糖、異丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素、二硫蘇糖醇(DTT),購自Sigma公司;Bradford蛋白質(zhì)濃度檢測試劑盒,購自上海碧云天生物公司;PBS緩沖液(pH值7.2),購自英濰捷基公司。
儀器:高壓均質(zhì)機(JN-Mini,廣州聚能納米公司)、酶標儀(Infinite200,TECAN)、離心機(CR21,Hitachi)、搖床(Ks4000,IKA)。
1.2 試驗方法
1.2.1 菌液的培養(yǎng)和收集 重組基因的E. coli DH5α工程菌采用兩步法培養(yǎng),取3 μL重組工程菌液接種到3 mL新鮮LB培養(yǎng)基(含50 μg/mL卡那霉素) 中,于37? ℃、220 r/min過夜培養(yǎng)15 h獲得種子液。隨后將種子也按照1%比例接種到新鮮LB培養(yǎng)基(含50 μg/mL卡那霉素)中,37 ℃、220 r/min 繼續(xù)培養(yǎng)至D600 nm達到0.6左右,加誘導劑后繼續(xù)16 ℃,150 r/min振蕩培養(yǎng)15 h。每 100 mL 誘導后的菌液于10 000 r/min 離心5 min,收集菌體,加入預(yù)冷的PBS緩沖液(pH值7.2) 50 mL 洗滌1次,然后加入預(yù)冷的PBS緩沖液 15 mL,充分懸浮,懸浮液置于-4 ℃待用。
1.2.2 菌液濃度測定 當菌液在600 nm時的吸光度值D600 nm小于0.7時,D600 nm與菌液濃度呈線性關(guān)系[11],可用來監(jiān)測菌體生長情況,濃縮之后的菌液濃度用每升菌液中菌體濕質(zhì)量(g/L)表示。
1.2.3 蛋白質(zhì)濃度標準曲線的繪制 破碎之后上清液中可溶性蛋白的濃度用Bradford染色法測得[12]。將蛋白標準溶液分別稀釋成1.500、1.000、0.750、0.500、0.250、0.125 mg/mL的濃度梯度,然后分別取5 μL不同濃度的蛋白標準溶液到96孔酶標板,每個孔各加250 μL的G250染色液,反應(yīng) 5 min 后,用酶標儀測定595 nm處的吸光度,重復3次,得到標準曲線的方程為y=0.632 9x+0.532 5,相關(guān)系數(shù)r2=0.992 3,表明標準曲線相關(guān)性很好,可用于檢測樣品的蛋白質(zhì)濃度。
1.2.4 蛋白破碎率的測定 用上清液中可溶性蛋白的濃度與菌體濃度的比值表示蛋白破碎率。
1.2.5 單因素試驗設(shè)計 根據(jù)已有研究[7],選取高壓均質(zhì)過程中關(guān)鍵影響因素均質(zhì)壓力、均質(zhì)次數(shù)、菌液濃度,設(shè)計單因素試驗,研究每個因素對破碎結(jié)果的影響,試驗方案如下:(1)在菌液濃度為100 g/L,均質(zhì)次數(shù)為3次時,分別用80、100、120、140、160 MPa均質(zhì)壓力破碎菌液,分析均質(zhì)壓力對大腸桿菌破碎結(jié)果的影響。(2)在均質(zhì)壓力為 120 MPa,菌液濃度為100 g/L時,分別均質(zhì)1、2、3、4、5次,分析均質(zhì)次數(shù)對大腸桿菌破碎結(jié)果的影響。(3)在均質(zhì)壓力為120 MPa,均質(zhì)次數(shù)為3次時,分別用60、80、100、120、140 g/L濃度的菌液進行破碎,分析菌液濃度對大腸桿菌破碎結(jié)果的影響。
1.2.6 響應(yīng)面試驗設(shè)計 根據(jù)單因素試驗結(jié)果,利用Design Expert V8.0.6軟件中Box-Behnken試驗設(shè)計方法,以均質(zhì)壓力(A)、均質(zhì)次數(shù)(B)、菌液濃度(C)為試驗因素,以蛋白破碎率為響應(yīng)值設(shè)計三因素三水平響應(yīng)面試驗,并用方程對結(jié)果進行擬合及優(yōu)化,各因素及水平見表1所示。
1.3 數(shù)據(jù)處理
單因素試驗每個試驗點做3次重復,使用Excel 2016處理數(shù)據(jù)及制作圖表。響應(yīng)面結(jié)果用Design Expert V8.0.6進行擬合,方差分析并優(yōu)化參數(shù)。
2 結(jié)果與分析
2.1 單因素試驗結(jié)果分析
2.1.1 不同均質(zhì)壓力對破碎結(jié)果的影響 由圖1可知,在均質(zhì)壓力達到120 MPa之前,隨著壓力的增大,大腸桿菌蛋白破碎率明顯升高,100 MPa和 120 MPa 處理之間差異達到顯著水平(P<0.05)。當均質(zhì)壓力達到120 MPa之后,隨著均質(zhì)壓力上升,大腸桿菌蛋白破碎率緩慢升高,但是處理之間差異不顯著,說明壓力達到120 MPa時,樣品的破碎已經(jīng)接近完成,升高壓力對結(jié)果的影響已經(jīng)不明顯,因此,選用的均質(zhì)壓力為120 MPa。
2.1.2 不同均質(zhì)次數(shù)對破碎結(jié)果的影響 由圖2可知,樣品破碎前期(次數(shù)≤3)增加均質(zhì)次數(shù)可以顯著提高大腸桿菌蛋白破碎率,處理之間差異達到顯著水平(P<0.05)。但是均質(zhì)3次之后,繼續(xù)增加均質(zhì)次數(shù),結(jié)果的增加幅度明顯放緩,均質(zhì)3、4和5次處理之間差異均不顯著。過長時間的破碎有可能導致釋放出的蛋白質(zhì)降解,并且考慮時間成本,選擇的均質(zhì)次數(shù)為3次。
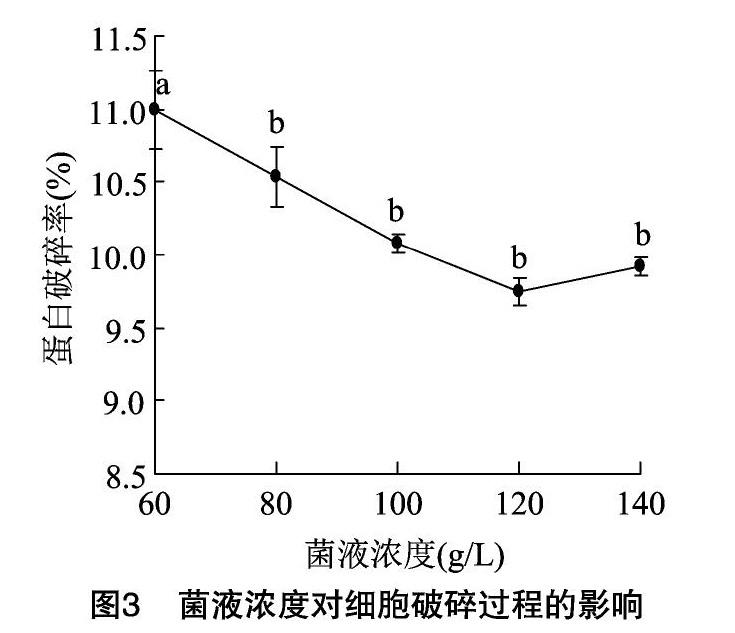
2.1.3 不同菌液濃度對破碎結(jié)果的影響 由圖3可知,隨著菌液濃度的提高,大腸桿菌的蛋白破碎率呈緩慢下降的趨勢,但各處理的結(jié)果基本維持在較高的水平(>9.5%),除了濃度最低的60 g/L處理,其他處理之間差異都不顯著,說明菌液濃度對大腸桿菌蛋白破碎率的影響較小。因此,選取差異不顯著的第1個處理,也就是80 g/L作為后續(xù)試驗條件。
2.2 響應(yīng)面試驗結(jié)果分析
根據(jù)試驗設(shè)計,一共安排響應(yīng)面試驗15組,試驗順序及結(jié)果如表2所示。通過軟件對結(jié)果進行二元多次回歸擬合,得到蛋白破碎率的回歸方程為Y=11.55+0.82A+1.5B+0.18C-0.38AB-0.59AC+0.055BC+0.25A2-0.12B2+0.062C2。該回歸方程模型的P模型=0.000 8<0.01,表明模型極顯著;失擬項p失擬=0.155 4>0.05,表明模型失擬項不顯著;模型的確定系數(shù)R2=0.9820,調(diào)整確定系數(shù)R2adj=0.949 5,說明該模型能解釋94.95%的響應(yīng)值變化,因此,該模型擬合良好,可以用此模型對最優(yōu)破碎參數(shù)進行分析和預(yù)測。
從表3可知,一次項A、B達到極顯著水平(P<0.01),而C不顯著,表明均質(zhì)壓力和均質(zhì)次數(shù)對蛋白破碎率影響極大,菌液濃度對蛋白破碎率的影響相對不顯著。二次項中除了AC因素之間交互作用顯著外,其他因素之間交互作用都不顯著,表明因素之間的交互作用對蛋白破碎率的影響較小。而且各因素對大腸桿菌蛋白破碎率影響大小順序為均質(zhì)次數(shù)(B)>均質(zhì)壓力(A)>菌液濃度(C)。
通過觀察兩因素之間的響應(yīng)曲面圖可以預(yù)測變量的響應(yīng)值以及確定變量之間的相互關(guān)系,響應(yīng)面越陡,反映兩因素之間的交互作用越顯著[13]。三因素兩兩之間的響應(yīng)面曲面見圖4,可見圖4-a的響應(yīng)曲面較陡,表明均質(zhì)壓力和均質(zhì)次數(shù)之間交互作用較顯著,對蛋白破碎率的影響較大。圖4-b、圖4-c的響應(yīng)曲面較平緩,表明均質(zhì)壓力與菌液濃度、均質(zhì)次數(shù)與菌液濃度之間的交互作用較不顯著,對響應(yīng)值的影響較小。
2.3 最優(yōu)參數(shù)的確定及驗證
在選取的因素范圍內(nèi),通過DesignExpert V8.0.6軟件提取的最優(yōu)條件:均質(zhì)壓力140 MPa、均質(zhì)次數(shù)4次、菌液濃度60 g/L,在此條件下,回歸模型預(yù)測的理論蛋白破碎率為14.04%。為了驗證預(yù)測結(jié)果的可靠性,根據(jù)預(yù)測試驗條件,經(jīng)過3次重復,得到大腸桿菌實際蛋白破碎率為13.98%,這與預(yù)測值非常接近。說明該模型能較好地擬合實際情況,有一定的實踐指導意義。
3 結(jié)論
本研究通過單因素試驗,分析了均質(zhì)壓力、均質(zhì)次數(shù)和菌液濃度3個因素對大腸桿菌蛋白破碎率的影響。然后根據(jù)單因素試驗結(jié)果,利用響應(yīng)面試驗擬合出大腸桿菌蛋白破碎率的二元多次回歸方程,各因素對大腸桿菌蛋白破碎率影響順序為均質(zhì)次數(shù)(B)>均質(zhì)壓力(A)>菌液濃度(C),并確定最優(yōu)化的試驗參數(shù):均質(zhì)壓力140 MPa、均質(zhì)次數(shù)4次、菌液濃度60 g/L,在此條件下的大腸桿菌實際蛋白破碎率為13.98%。該結(jié)果可為高壓均質(zhì)法破碎大腸桿菌,提取胞內(nèi)外源蛋白提供一定的方法借鑒,并適用于大規(guī)模工業(yè)生產(chǎn)。
參考文獻:
[1]Tripathi N K. Production and purification of recombinant proteins from Escherichia coli[J]. Chembioeng Reviews,2016,3(3):116-133.
[2]Eggenreich B,Rajamanickam V,Wurm D J,et al. A combination of HPLC and automated data analysis for monitoring the efficiency of high-pressure homogenization[J]. Microbial Cell Factories,2017,16(1):134.
[3]趙燁清,石 莉,歐陽臻,等. 化學-滲透壓法溫和破碎處理下大腸桿菌細胞胞內(nèi)蛋白質(zhì)的釋放率[J]. 江蘇農(nóng)業(yè)科學,2017,45(19):146-149.
[4]謝 琦,劉永明. 滲透休克法從大腸桿菌中提取GST-Tα1-TP5融合蛋白[J]. 華夏醫(yī)學,2016,29(4):9-12.
[5]沈徐凱,周 斌,王云艷,等. 丙酮破碎法提取重組大腸桿菌表達的轉(zhuǎn)谷氨酰胺酶酶原[J]. 生物技術(shù)通報,2011(5):223-226.
[6]劉 紅,潘紅春,蔡紹皙,等. 酶解-超聲法破碎大腸桿菌提純包含體[J]. 重慶大學學報(自然科學版),2004,27(10):75-78.
[7]吳 蕾,洪建輝,甘一如,等. 高壓勻漿破碎釋放重組大腸桿菌提取包含體過程的研究[J]. 高校化學工程學報,2001,15(2):191-194.
[8]徐 龍,曹小安,劉永生,等. 布魯氏菌BP26蛋白對鼠源樹突狀細胞分化及抗原提呈作用[J]. 江蘇農(nóng)業(yè)學報,2020,36(4):984-991.
[9]梁蕊芳,徐 龍,岳明強. 細胞破碎技術(shù)應(yīng)用研究進展[J]. 內(nèi)蒙古農(nóng)業(yè)科技,2013(1):113-114.
[10]Pekarsky A,Spadiut O,Rajamanickam V,et al. A fast and simple approach to optimize the unit operation high pressure homogenization-a case study for a soluble therapeutic protein in E. coli[J]. Preparative Biochemistry & Biotechnology,2019,49(1):74-81.
[11]Glazyrina J,Materne E M,Dreher T,et al. High cell density cultivation and recombinant protein production with Escherichia coli in a rocking-motion-type bioreactor[J]. Microbial Cell Factories,2010,9(1):42.
[12]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[13]魯 龍,畢生雷,金洪波,等. 高壓勻質(zhì)法破碎小球藻細胞工藝優(yōu)化[J]. 食品工業(yè)科技,2017,38(6):304-307,349.

