守恒思想在高中化學教學中的應用
——探討守恒法解題技巧
包曉玥
(福建省長汀縣第一中學 366300)
守恒法不僅是高中化學解題中的重要技巧與方法,而且還是高考解題中常用的解題方法,其特點就是抓住相關變化的始態與終態,忽視其中間的過程,通過其中的不變量構建關系式,以實現思路簡化與迅速解題.因此,高中化學的教學當中,守恒思想是極其重要的,將守恒思想應用到化學試題解題中,不僅能夠使解題速度得到顯著提升,而且還能使學生實現輕松學習.基于此,化學教師需注重引導學生通過守恒思想構建起相應的關系式,將解題技巧提供給學生,從而使學生自身的解題效率得到顯著提升.
一、質量守恒的應用
高中化學的教學中,守恒思想當中的質量守恒通常是其關鍵,且在化學的解題教學中得到廣泛應用.質量守恒的定律主要指直接參與到化學反應的質量總和等于反應后各生成物質的質量總和.對于質量守恒定律而言,其主要表現為:(1)反應物的質量總和等于反應生成物質量綜合;(2)溶液在稀釋或濃縮的過程中,原溶液中的物質質量和變化后溶液中的物質質量相等;(3)反應物的減少總質量與產物增加的總質量是相等的.根據上述的相關關系式,就能構建起試題已知條件與未知條件之間的關系,忽略化學反應和變化過程,直接從質量守恒角度進行未知量的求解,有效解決過程復雜、混合物質比例未知的問題.
例1有一包鋁粉和鐵粉組成的混合物,先將其倒入足量鹽酸中完全反應,然后往反應后的溶液中加入過量NaOH溶液,直至溶液中沉淀無變化為止,將沉淀進行灼燒得到紅色粉末,干燥后,紅色粉末的質量與原鋁粉和鐵粉組成混合物質量一致,求原鋁粉和鐵粉組成混合物中鋁的質量分數( ).
A.40% B.30% C.60% D.50%
解析鐵與鋁都能夠與鹽酸進行反應,通入氫氧化鈉以后,生成物都能夠與氫氧化鈉反應產生沉淀,在氫氧化鈉過量的情況下,氫氧化鋁沉淀會再次反應溶解,這樣對穩定后的沉淀進行灼燒處理,得到只還有鐵元素的三氧化二鐵.由于紅色粉末的質量與原鋁粉和鐵粉組成混合物質量一致,因此,元混合物中鋁的質量分數即是三氧化二鐵中的氧元素質量分數,經過計算可得30%.
二、原子守恒的應用
化學的本質就是原子的重新排列組合,產生新物質,但是不產生新原子,即抓住原始反應物與最后的生成物當中的某個原子的不變規律,找出其中的等量關系實施求解.
例2在適量的濃硝酸溶液中加入38.4mg的銅,當反應不再進行的時候,得到22.4mL的氣體,那么,參與反應的HNO3的物質的量最可能的是( ).
A.1.6×10-3mol B. 1.0×10-3mol
C.2.4×10-3mo1 D.2.2×10-3mol
解析銅與硝酸的反應比較復雜,產物中的氣體可能是NO、NO2或是二者的混合物,如果運用化學方程式的方法,不僅繁瑣而且在不確定NO、NO2二者比例的情況下,也不易于計算,通過原子守恒,構建N與HNO3之間的關系,即一個氮原子對應一個硝酸分子,那么只要計算氣體的物質的量,就能夠得到硝酸物質的量,通過計算得出D選項,2.2×10-3mol.在對該題進行解答時,就需注重審題,看其是消耗,還是被還原.
三、電荷守恒法在高中化學教學中的應用
電解質的溶液或者離子化合物當中,含有的陽離子、陰離子電荷數是相等的,也就是陽離子的物質的量×陽離子的電荷數=陰離子的物質的量×陰離子的電荷數,根據該點可知:(1)離子化合物當中,陽、陰離子電荷數是相等的;(2)電解質的溶液中,陽、陰離子電荷數是相等的.
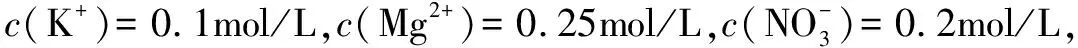
A. 0.15mol B. 0.20mol
C. 0.25mol D. 0.40mol
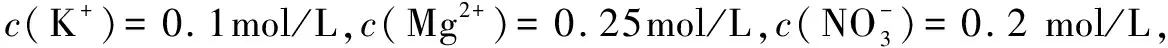
四、電子守恒法在高中化學教學中的應用
電子守恒的思想主要表示為化學反應物的電子失去的總數與得到的總數相一致,通常會運用在氧化還原反應當中的電子得失的反應求解,根據有關的關系方程可對化學問題進行有效解答.
例4Fe2(SO4)3和50.0mL羥胺酸性溶液(0.10mol/L)通過煮沸的條件進行全面反應,其反應后所生成的二甲鐵離子和50.0mL酸性的高錳酸鉀溶液(0.04mol/L)產生發生氧化反應,得出的羥胺氧化產物是( ).
A. NO2B. N2O C. NO D. N2
解析本題中,三價的鐵離子和羥胺及二價的鐵離子和酸性高錳酸鉀產生氧化反應,因此,羥胺電子所失去的數目是通過高錳酸鉀所獲取的.這個時候,羥胺酸的N是-1價,因此,氧化后的產物N是x價,根據電子守恒得出[x-(-1)]×50.00mL×0.10mol/L=(7-2)×50.00mL×0.04mol/L,由此可得:x=1,因此,本題的答案為B.
五、能量守恒法的運用
化學反應中,計算反應熱的過程當中,始終需注重節能的思想,明確何為能量守恒,其主要是兩種或者多種方式的互相轉變,或者物體間的互相轉變,而對總能量的保持卻是不變的.能量守恒的定律屬于普遍且基本的規律.

ΔH3=+0.33kJ·mol-1
B.正交硫相較于單斜硫更穩定
C.相同物質量正交硫相較于單斜硫含的能量更高
D.(1)式是表示斷裂的1mol O2當中的共價鍵吸收的能量所形成的1mol SO2當中共價鍵放出的能量要多297.16kJ.
解析本題所給的兩個熱化學的方程式是相減的,單斜硫就能轉化成正交硫所釋放的能量,因此,等物質量的單斜硫相較于正交硫的含量更高,且正交硫相較于單斜硫更穩定;熱化學的方程式所表示的破壞的反應物當中的化學鍵需要的能量和生成的產物中化學鍵釋放的能量差,D中忽略了單斜硫,因此答案是B.
綜上所述,高中化學的教學中,各種化學反應中,守恒思想屬于較為常見的一種解決化學問題的思路與方法,且在高考化學的試題當中,守恒類的習題占據愈來愈大,因此,學生在具體學習時,需勤奮練習,準確掌握相關化學反應的規律,在解題時,能夠積極運用守恒思想,對問題當中的相關變量關系進行建立,并揭示出各種守恒的規律與特征,從而實現解題高效且簡化的同時,實現學生學習化學知識的興趣提高.

