LR6型堿性鋅錳電池兩節串聯放電特性研究
徐 偉,張奇堯
(中銀(寧波)電池有限公司,浙江 寧波 315040)
1 引言
堿性鋅錳電池是目前應用范圍較廣的電池品種之一,在家用電器、通信、醫療器械、電動玩具等領域均有廣泛應用。電性能的提升[1-2]、安全和防漏性能的改善[3-4]以及新材料、新工藝的應用[5-6]也一直是電池行業研究的熱點。
隨著科技的發展,用電器功耗逐步降低,要求電池在較低的工作電壓下也能正常使用。而多數用電器無低電壓報警提示功能,一直放置于用電器內的電池會引起過度放電造成漏液[7-8]。為提升客戶滿意度,電池的過度放電、小電流放電[9]近年來也逐漸得到了關注。但這些研究往往以單節電池作為試驗對象,而實際用電器使用中,電池使用多以串、并聯組合形式出現,單節使用的情況較少。這就造成實驗室研究與實際應用場景之間往往會出現不匹配的情況。
數字電視機頂盒遙控器是日常生活中最為常見的用電器之一,多為兩節AA電池串聯使用。本文以遙控器的使用為切入點,對LR6堿錳電池兩節串聯及單節使用情況下的電壓變化、漏液及內部反應情況進行對比,并從電化學角度對放電特性進行分析,以期對堿性鋅錳電池的串聯使用特性引起關注。
2 實驗部分
2.1 遙控器使用模式測試
選取使用兩節AA電池的數字電視機頂盒遙控器一只(DZ40-1A,浙江產)。恒溫(20±2) ℃條件下,使用直流穩壓電源(IT6121,ITECH)自3.2 V開始并以0.2 V遞減進行電壓輸出,電流表(C31/1-A型,上海良表儀器儀表有限公司)測量相應電壓下的工作電流,直至遙控器無法工作為止。
2.2 電壓變化測試
選取市場上常見的電池品牌:S(保質期10年,有效期:03-2029)、N(2019-01生產),分別按以下(1)、(2)進行測試,數量各10組。
(1)恒溫(20±2) ℃條件下,取兩節同品牌電池(1#、2#)搭載負載R(蘇州產)按圖1(a)方式進行連接,測量每節電池的電壓變化情況。
(2)恒溫(20±2) ℃條件下,取一節電池(3#)搭載負載R′(R′=1/2R,蘇州產)按圖1(b)方式進行連接,測量電池的電壓變化情況。
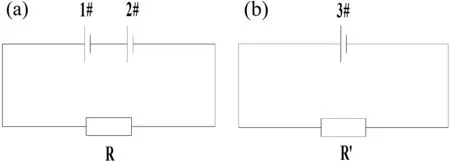
圖1 實驗裝置圖Fig.1 Scheme of experiment.
2.3 電池漏液及解剖情況
測試結束后,將電池從試驗裝置中取出,恒溫(20±2) ℃條件下放置30天,統計漏液率。同時對電池進行解剖,分離正極、負極、銅釘,觀察反應情況。
3 結果與討論
3.1 遙控器使用模式測試
圖2為不同輸出電壓下遙控器工作電流的變化曲線。圖中數據點相連曲線的趨勢線為直線,斜率為0.082。由此推斷遙控器使用為大電阻恒阻模式,阻值R為82 Ω。
3.2 電壓變化曲線
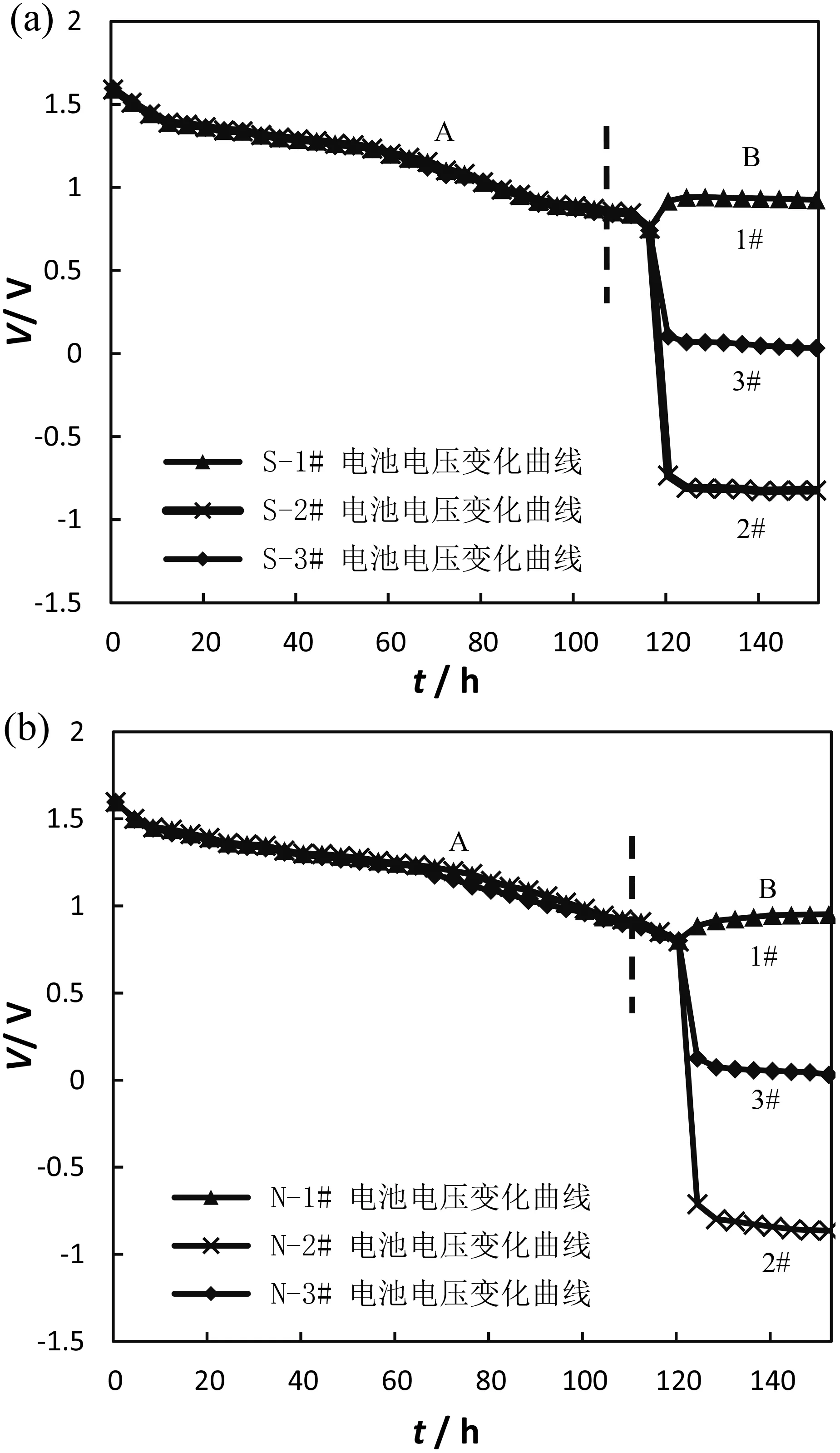
圖3 電壓特性變化曲線Fig.3 Curves of voltage characteristics.
圖3分別是S、N電池實驗過程中的電壓變化曲線。從曲線的變化情況來看,S、N電池具備相同的反應特征,均可分為A、B兩段。為方便討論,兩節串聯使用中電壓上升的電池統一標識為1#,電壓下降的電池統一標識為2#,單節使用的電池統一標識為3#。
A段,即起始至電壓0.9 V。這一階段,1#、2#、3#電池電壓呈現均勻下降,無明顯差異。
正負極活性物質被緩慢消耗,電化學極化和濃差極化使得電壓逐步下降,電池正負極反應機理一致。一般認為,正極中二氧化錳的放電機理,分為兩步進行[10],這一階段以第一步反應(式1)為主。該反應是由一種固體結構(MnO2)轉化成另一種固體結構(MnOOH)。真正發生的是電子與質子進入晶格中而未改變其基本的(或本質的)結構,過程是一個均相反應。MnO2還原速度較大,但質子在固相中擴散速度較慢,質子堆積在表面層來不及擴散到內部,電極極化增大,電極電位負移。
MnO2+H2O+e-→MnOOH+OH-
(1)
負極中鋅在OH-作用下主要發生氧化反應(式2和3),Zn表面OH-濃度下降,產生濃差極化。但同時,Zn的粒徑逐漸變小,反應活性增強。總體來看,這一階段負極電位基本保持不變[11]。
Zn+4OH-→[Zn(OH)4]2-+2e-
(2)
[Zn(OH)4]2-→Zn(OH)2+2OH-
(3)
在B段,即電壓0.9 V至結束。這一階段,串聯使用與單節使用的差異性開始顯現。串聯的兩節電池電壓逐步分化,其中1#電池略微升高,最終維持在0.8 V~1.0 V;2#電池則急劇下降,并出現負電壓,最終維持在-0.8 V~-1.0 V;3#電池電壓快速下降,最終維持在0.03 V~0.2 V。
二氧化錳這一階段以第二步反應為主(式4)[10],分為三個連串步驟:(1)Mn3+自MnOOH中以諸如Mn(OH)4-鉻離子的形式溶液于電解質溶液中;(2)在碳表面上,Mn(OH)4-電化學還原為[Mn(OH)4]2-(相當于Mn3++e-→Mn2+);(3)Mn(OH)2自[Mn(OH)4]2-飽和溶液中沉淀。這個過程是一個多相反應,因為包括兩個不同的固相,一個初始固相(MnOOH)轉化成另一個終了固相[Mn(OH)2]。電化學反應是通過溶解了的離子物質而進行的。反應過程中伴隨著反應式(5)的發生,Mn(OH)2逐漸生成非活性的Mn3O4,生成的Mn3O4既不能被氧化,也不能被還原[12]。
MnOOH→Mn(OH)4-+e-→[Mn(OH)4]2-→Mn(OH)2
(4)
2MnOOH+Mn(OH)2→Mn3O4+2H2O
(5)
負極中一方面隨著Zn的進一步消耗,以及OH-濃度的進一步降低,反應活性降低,另一方面,負極產物ZnO、Zn(OH)2等大量形成(式6),附著在Zn粉表面,阻礙了Zn與OH-的接觸,從而增大了電化學反應阻力。負極電位迅速正移。
Zn(OH)2→ZnO+H2O
(6)
由于堿錳電池設計一般為負極過剩正極限容的形式。正極中活性錳首先耗盡,繼續放電則會出現過放。負極中過剩的Zn的溶解和析氫反應(式7)替代了原來的放電過程[13-14]。此時電壓出現陡降。
2H2O+2e-→2OH-+H2↑
(7)
串聯電池中,2#電池首先失效成為負載,未失效的1#電池對2#電池進行充電。這時2#電池出現反極,嚴重過放。內部反應劇烈,OH-氧化生成O2(式8),電壓表現為負值[15-16]。
4OH-→2H2O+O2↑+4e-
(8)
1#電池電壓略有上升。原因可能是隨著電池輸出能力的降低,電流下降。反應劇烈程度降低,電化學極化和濃差極化降低,質子固相得到擴散的結果。
電池單獨使用時,3#電池在正極活性錳消耗后電壓也出現快速下降現象,負極中過剩的Zn同樣會出現溶解和析氫反應,但內部堿液還沒被氧化。總體反應程度較2#電池輕微,表現為曲線下降幅度較2#電池小。
3.3 電池漏液及解剖情況
將測試結束后的S、N電池從試驗裝置中取出,在恒溫(20±2) ℃條件下放置30天,漏液率情況列于表1所示。由表1可知,2#電池漏液率均最高,3#電池次之,1#電池最低。這是由于2#、3#電池在反應后期均有析氫反應發生,生成的氫氣使得電池內部壓力持續增大,直至超過密封圈防爆壓力,泄壓閥打開,出現漏液。其中2#電池在負電壓情況下發生析氧反應,生成的氧氣與氫氣疊加,使得內部壓力增長較多,漏液也越多。3#電池由于未出現過放情況,內部產生氣體較少,故無漏液情況發生。
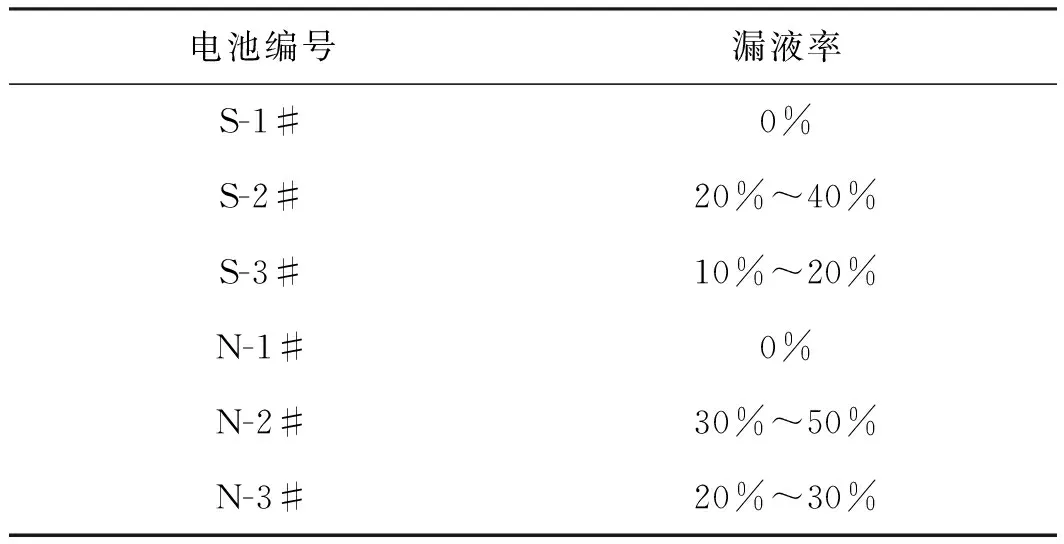
表1 S、N電池貯存30天的漏液率Table 1 Leakage of S and N batteries after 30 days storage.
測試結束后對電池進行解剖,觀察各部位反應情況,發現S、N電池情況一致,具體見表2。其中2#電池反應最劇烈、最徹底,3#電池次之,1#電池相對最輕微。特別是銅釘部分,2#電池除表面有黑色斑點外表面還存在凹凸不平、露銅情況。推測在過放及反充過程中,銅釘(Cu-Zn合金)在負電壓狀態下也參與反應,銅和鍍層溶解脫落。

表2 電池不同部位解剖情況Table 2 Reaction situation of battery for different parts.
4 結論
以數字電視機頂盒遙控器使用模式為切入點,對LR6堿性鋅錳電池在兩節串聯及單節使用情況下的電壓變化情況進行測試。試驗結果表明:兩節LR6電池串聯使用時,部分電池會出現嚴重過放、反充現象,電池電壓特征表現為負電壓;與單節LR6電池使用相比,串聯使用中出現負電壓的電池內部反應更劇烈,也更容易引起漏液。

