蛋白質氧化對中華管鞭蝦肌肉品質特性的影響
祁雪兒,毛俊龍,姚 慧,齊 賀,武天昕,水珊珊,張 賓*
(浙江海洋大學食品與藥學學院,浙江 舟山 316022)
中華管鞭蝦(Solenocera crassicornis)俗稱紅蝦,因其外殼呈橙紅色、各腹節后緣有紅色橫帶及尾扇結尾處為紅色而得名。中華管鞭蝦為亞熱帶、熱帶暖水品種,在我國東海、黃海南部及南海均有分布,是浙江近海海域的優勢蝦類資源品種[1]。中華管鞭蝦水分含量高,營養價值豐富,氨基酸、脂類、微量元素含量多,對心臟活動和心血管系統有重要的調節、保護作用,并且有降低膽固醇、舒張動脈等功效[2]。中華管鞭蝦肉質紅潤,肥嫩鮮美,容易消化,老小皆宜,深受消費者青睞[3]。但是,在加工、流通和貯藏過程中,中華管鞭蝦不可避免地受到溫度、光、射線、氧、水分和催化劑等外界環境的影響,導致營養成分和品質質量降低[4]。
長期以來,脂質氧化、微生物和酶的作用被認為是導致食品腐敗變質的主要原因,而近幾年關于蛋白質氧化所引起的食品品質劣變也被人們關注。蛋白質氧化不僅可以降低肉的食用品質,如嫩度、多汁性、風味和色澤等,還會影響肉的功能性,如凝膠性、乳化性[5]。李銀等[6]分析了羥自由基氧化體系中H2O2濃度對蛋白氧化程度及肌原纖維蛋白凝膠白度、持水力、質構特性與彈性模量等特征指標的影響。結果表明,隨H2O2濃度的增加,肌原纖維蛋白中羰基值上升,蛋白氧化程度加劇,凝膠白度、保水性、硬度、咀嚼性及彈性模量則與H2O2濃度呈顯著負相關。朱文慧等[7]對秘魯魷魚進行氧化,同樣發現在羥自由基氧化體系中,氧化劑濃度越高,氧化程度就越高,肌原纖維結構破壞越嚴重,保水性越低。
因此,本實驗采用羥自由基氧化體系對中華管鞭蝦蛋白進行氧化,通過測定其基本理化性質、蛋白性質及組織結構等,闡明蛋白質氧化對中華管鞭蝦肌肉品質特性的影響規律,進一步揭示蛋白氧化對中華管鞭蝦肉品質的影響機制,旨在為其在貯藏加工過程中控制蛋白氧化、提高品質特性提供理論參考。
1 材料與方法
1.1 材料與試劑
冰鮮中華管鞭蝦,平均質量(13±2)g,購于浙江舟山水產交易市場,1 h內運至實驗室。
氯化鐵、過氧化氫、抗壞血酸、氧化鎂、硼酸、甲基紅-乙醇指示劑(均為分析純) 國藥化學試劑有限公司。
1.2 儀器與設備
CR-10型便攜式色差儀 日本柯尼卡美能達公司;HD-3A型水分活度測定儀 常州德杜精密儀器有限公司;MS-Pro型物性測試儀 美國FTC公司;751UVGD型紫外-可見分光光度計 上海第三分析儀器廠;CF-16RN高速冷凍多用途離心機 日本日立公司;MDF-U53V型超低溫冰箱 日本Sanyo公司。
1.3 方法
1.3.1 樣品處理
將冰鮮中華管鞭蝦去除頭、殼,不去蝦線,保持蝦仁整體完整;將不同濃度羥自由基氧化溶液(固定0.01 mmol/L FeCl3,0.1 mmol/L抗壞血酸,共設置4 個H2O2濃度,分別為0.5、1.0、2.0 mmol/L和4.0 mmol/L)置于4 ℃冰箱中預冷后,將制備蝦仁完全浸沒于氧化溶液中,在4 ℃保持1、3、5 h和7 h進行氧化處理,然后用1 mmol/L乙二胺四乙酸溶液終止氧化反應;取出處理后蝦仁,采用蒸餾水進行淋洗,紗布輕輕拭去表面水分,進行品質特性指標測定。同時,采用蒸餾水溶液作為空白對照處理。
1.3.2 pH值測定
按GB/T 5009.237—2016《食品pH值的測定》[8]方法進行測定。稱取約2 g蝦仁樣品于燒杯中,高速均質30 s后,加入25 mL蒸餾水,靜置30 min,過濾,PHS-3C型pH計測定濾液pH值。
1.3.3 水分活度和水分含量測定
采用水分活度儀測定水分活度。取約2 g蝦仁切碎后,均勻平鋪于樣品盒中,將樣品盒放入HD-3A型水分活度測定儀感應器中,分析蝦仁肌肉中水分活度。
水分含量測定參考GB 5009.3—2016《食品中水分的測定》[9]直接干燥法。將約2 g蝦仁至于101~105 ℃進行干燥處理,通過干燥前后質量變化計算蝦仁中水分含量。
1.3.4 質構特性分析
采用TPA模型進行測定。選取蝦仁背部第2節肌肉,測試探頭為P/50,測試速率為1.0 mm/s,樣品變形為30%,保持時間為3 s。采用FTC-PRO軟件從每個樣品產生的力-時間曲線中,計算蝦仁肌肉組織彈性和咀嚼性。
1.3.5 色差測定
采用CR-10型色差儀,以蝦仁肌肉第2節為測試點,測定蝦仁表面的L*值和a*值。L*為正值表示偏白,a*為正值表示偏紅。
1.3.6 揮發性鹽基氮(total volatile basic nitrogen,TVB-N)值測定
參考GB 5009.228—2016《食品中揮發性鹽基氮的測定》[10]方法進行。
1.3.7 掃描電鏡觀察分析
參考崔宏博等[11]方法。選取蝦仁背部第2節肌肉,將樣品切成5 mm×5 mm×5 mm塊狀,置于2.5%戊二醛溶液中,4 ℃固定過夜后,浸泡于0.1 mol/L磷酸鹽緩沖液(pH 7.2)中30 min;依次用30%、50%、70%、80%、90%和100%乙醇溶液進行梯度脫水后,再用叔丁醇置換脫水30 min;將脫水后樣品進行冷凍干燥,離子濺射儀噴金后,用掃描電鏡觀察肌肉組織結構。
1.3.8 蘇木精-伊紅染色觀察分析
參考榮建華等[12]方法,采用蘇木精-伊紅染色觀察蝦仁肌肉組織。選取蝦仁背部第2節肌肉,取1 cm×1 cm×0.5 cm肌肉塊,浸泡于4%多聚甲醛固定液中,室溫下過夜固定,然后用蘇木精-伊紅進行染色,顯微鏡觀察蝦仁肌肉組織結構。
1.3.9 肌原纖維蛋白十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
參照Laemmli[13]的不連續電泳方法,選用分離膠10%,濃縮膠5%,電極緩沖液含0.05 mol/L Tris、0.384 mol/L甘氨酸、0.1% SDS(pH 8.3)。電泳采用1 mm凝膠板;上樣量為12 μL;開始電泳時電壓為80 V,待樣品進入分離膠后改為120 V;電泳結束后,取出膠片用考馬斯亮藍染色30 min,再用固定液固定30 min,然后用甲醇-冰醋酸脫色液脫至透明。電泳膠片置于天能凝膠成像儀攝像,結合Tanon軟件進行分析和處理。
1.4 數據分析
采用Origin 8.5、SPSS 13.0軟件進行作圖及數據分析,結果表示為±s(采用SNK法分析差異顯著性,P<0.05,差異顯著)。
2 結果與分析
2.1 羥自由基氧化對中華管鞭蝦肌肉pH值的影響
肌肉pH值是水產品鮮度的重要評價指標[14]。如圖1所示,隨著體系中H2O2濃度和氧化處理時間的不斷延長,處理后蝦仁肌肉組織pH值不斷升高,并且氧化組的pH值明顯高于蒸餾水組(P<0.05)。在4.0 mmol/L H2O2濃度下,1 h氧化時間的pH值最低為7.01,3~5 h氧化時間的pH值分別為7.22和7.25,7 h氧化時間的pH值最高,為7.37,未高于2.0 mmol/L H2O2濃度組可能是因為樣品存在一定差異。氧化時間不變(7 h)時,隨著H2O2濃度的增加,pH值整體呈上升趨勢。可能的原因是蝦仁中蛋白質和非蛋白質的含氮物質在羥自由基體系下發生氧化分解,產生氨與胺類等大量堿性物質,蝦仁進入腐敗階段,積累大量的氨與胺類化合物,進而導致pH值逐漸上升[15]。
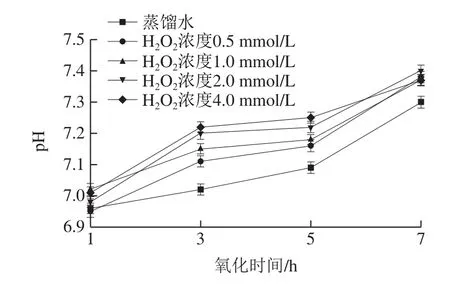
圖1 羥自由基氧化對中華管鞭蝦肌肉pH值的影響Fig.1 Effect of hydroxyl radical oxidation on pH of S.crassicornis muscle
2.2 羥自由基氧化對中華管鞭蝦肌肉水分含量和水分活度的影響
由圖2A可知,在相同的氧化時間下,水分含量隨著H2O2濃度的增加而減少。在4.0 mmol/L H2O2濃度下,氧化過程中,水分質量分數從80.64%上升至85.29%,在5 h達到最大值。這可能是因為氧化導致肌原纖維橫向收縮,肌細胞徑向減小、肌細胞間隙加大,濃度差使較多的水分向肌肉內部擴散,肌肉吸水能力增強,導致水分在肌肉組織內的擴散通道增加[16-17]。氧化7 h,水分質量分數又降至83.05%,其原因可能是由于細胞膜的蛋白質氧化后嚴重變性,對其產生了輕微的破壞作用,內部水分在滲透壓的作用下流出,導致水分含量降低[18]。
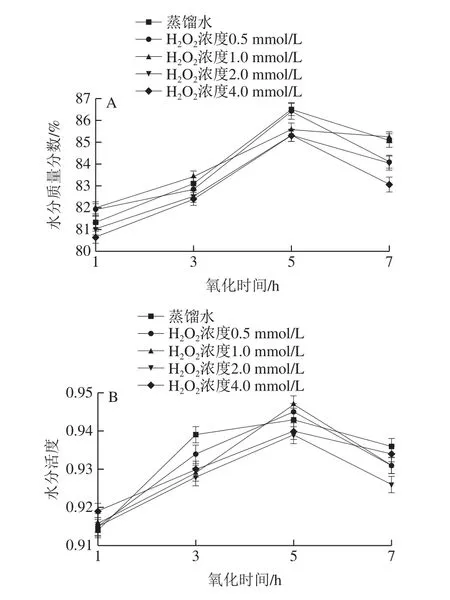
圖2 羥自由基氧化對中華管鞭蝦肌肉水分含量(A)和水分活度(B)的影響Fig.2 Effect of hydroxyl radical oxidation on water content (A) and water activity (B) in S.crassicornis muscle
水分活度不僅可表征食品中水分被微生物所利用的程度,也可反映食品品質特性[19-20]。由圖2B可知,氧化組的水分活度顯著低于蒸餾水組(P<0.05)。在相同的氧化時間下,水分活度基本上是隨著H2O2濃度的增加而降低,且各測定點間變化差異顯著(P<0.05),表明H2O2濃度對蛋白質的氧化程度有較大影響。在相同的氧化濃度下,氧化時間在0~3 h內,水分活度呈增加趨勢,氧化時間在3~7 h時,水分活度呈現先增加后降低趨勢。氧化期間,蝦仁水分活度出現波動,可能是由于肌肉組織中的水分含量增加,在氫鍵作用下,蝦仁中的水分與其他成分的結合程度上升,導致水分活度發生變化。隨后水分活度持續快速下降,則可能是因為蝦仁中水分含量降低所致[21]。由上可推測,隨著氧化程度的增加,蝦仁中的水分含量和水分活度會逐漸降低,導致其感官性狀和口感變差。
2.3 羥自由基氧化對中華管鞭蝦肌肉質構特性的影響
不同程度的氧化會造成蛋白質變性和肌纖維損傷,致使肌肉組織口感變差、彈性和咀嚼性等下降[22]。羥自由基氧化體系處理對中華管鞭蝦肌肉質構特性的影響如圖3A所示。總體來看,彈性和咀嚼性均因氧化程度的增加而降低。其中肌肉彈性與肌肉間的結合力大小密切相關,肌肉間結合力越大,肌肉組織破壞程度越小、彈性越大[23]。隨著氧化時間的延長和氧化劑濃度的增加,經羥自由基氧化系統氧化和未經氧化蝦仁的彈性均呈下降趨勢,且經氧化處理的蝦仁彈性下降速度較快,同一時間不同濃度間變化差異顯著(P<0.05)。低濃度(0.5 mmol/L)氧化初期的彈性值為0.66 mm,氧化7 h后,彈性值顯著降低至0.43 mm。高濃度(4.0 mmol/L)氧化初期的彈性值為0.64 mm,氧化7 h后,彈性值降為0.33 mm,與蒸餾水組(0.43 mm)相比降低了23.26%。這可能是氧化處理使肌球蛋白和肌動蛋白發生一定程度的變性,時間延長后,蝦仁明顯變軟,肌纖維破裂,組織結構遭到嚴重破壞,肌肉發生自溶,同時部分肌肉內源酶活性的作用使肌球蛋白和肌動蛋白等的分解程度增大,肌肉間細胞結合力降低,導致彈性降低[24]。
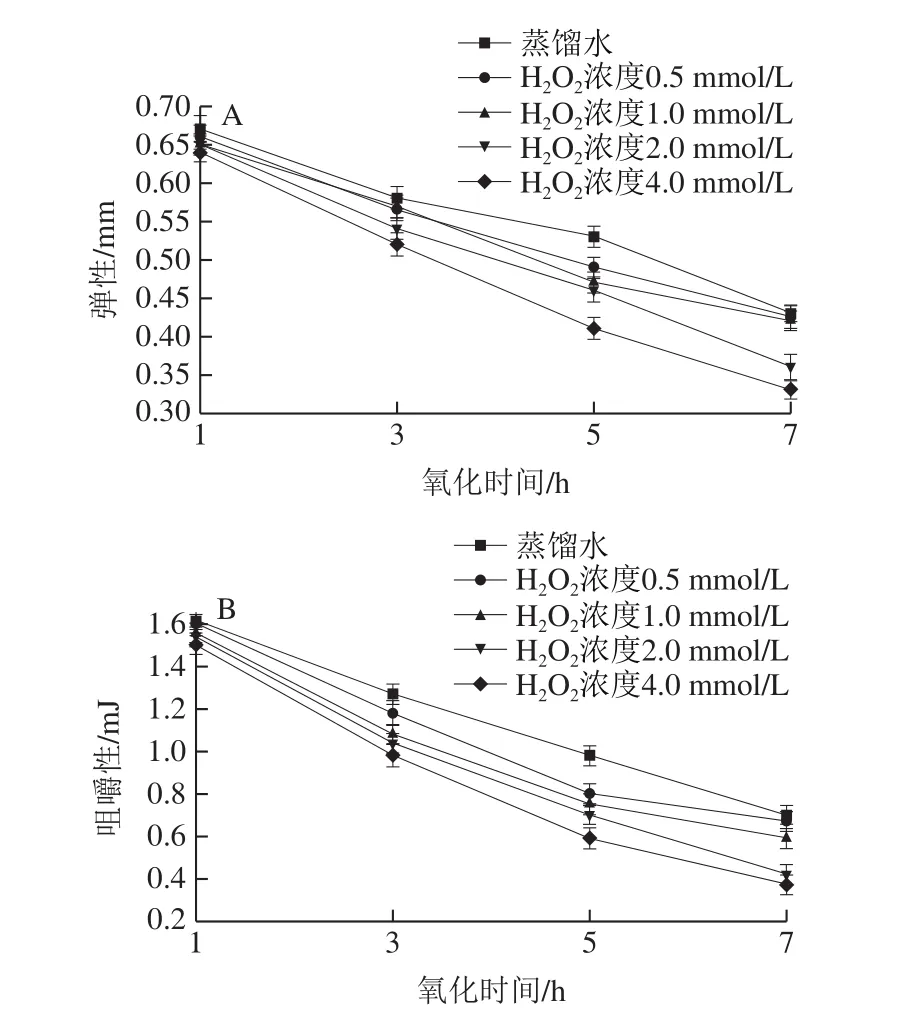
圖3 羥自由基氧化對中華管鞭蝦肌肉彈性(A)和咀嚼性(B)的影響Fig.3 Effect of hydroxyl radical oxidation on muscle elasticity (A) and chewiness (B) of S.crassicornis
咀嚼性也是一項質地綜合評價參數,它是肌肉硬度降低、肌肉細胞間凝聚力降低、肌肉彈性減小等綜合作用的結果,其數值越高,則反映的口感越好[14,25]。不同H2O2濃度的氧化溶液體系對蝦仁咀嚼性的影響如圖3B所示。結果顯示,隨著H2O2濃度和氧化時間的增加,蝦仁的咀嚼性均呈現下降趨勢,且氧化組蝦仁的咀嚼性均低于蒸餾水組,差異顯著(P<0.05)。低濃度(0.5 mmol/L)氧化初期的咀嚼性值為1.60 mJ,氧化7 h后,咀嚼性值顯著降低至0.67 mJ(P<0.05)。高濃度(4.0 mmol/L)氧化初期的彈性值為1.50 mJ,氧化7 h后,咀嚼性值為0.37 mJ,與蒸餾水組(0.70 mJ)相比降低了47.14%。這可能是因為氧化作用導致蛋白質變性、發生降解,肌肉細胞間結合力減小,進而使得蝦仁組織結構崩解、汁液流失及口感降低[26]。
2.4 羥自由基氧化對中華管鞭蝦肌肉色差值的影響
色差值是評價魚類等水產品品質的重要指標,可以通過利用色差計測定樣品顏色的偏差值,對其新鮮度進行評價[27-28]。本實驗選擇測定中華管鞭蝦的L*值,即明暗程度。如圖4A所示,在相同的氧化時間下,中華管鞭蝦的L*值隨著H2O2濃度的升高而呈上升趨勢,氧化時間1 h時,蒸餾水組的L*值最低,為37.21,4.0 mmol/L H2O2濃度的L*值最高,為38.05。另外,在相同H2O2濃度下,L*值隨著氧化時間的延長也呈上升趨勢,在4.0 mmol/LH2O2濃度下,經過1~7 h的氧化L*值分別為38.05、40.04、42.57、43.05。分析原因可能是長時間高濃度的氧化使肌原纖維蛋白質發生了一定程度的變性,進而增加了蝦肉的汁液流失,導致一部分游離水在肌肉表面流動,增強了光的反射效果[29]。a*值反映蝦仁的紅綠度,如圖4B所示,在相同的氧化時間下,中華管鞭蝦的a*值隨著H2O2濃度的升高而呈下降趨勢。氧化時間1 h時,蒸餾水組的a*值高,為5.17,4.0 mmol/L H2O2濃度的a*值最低,為4.40。另外,在相同H2O2濃度下,a*值隨著氧化時間的延長也呈下降趨勢,在4.0 mmol/L H2O2濃度下,經過1~7 h的氧化a*值分別為4.40、2.50、2.38、1.73。各測定點間變化差異顯著(P<0.05),表明蝦仁顏色變化波動較大。分析原因可能與氧化產物和蛋白質的氨基酸側鏈之間發生非酶褐變等的反應相關[30]。
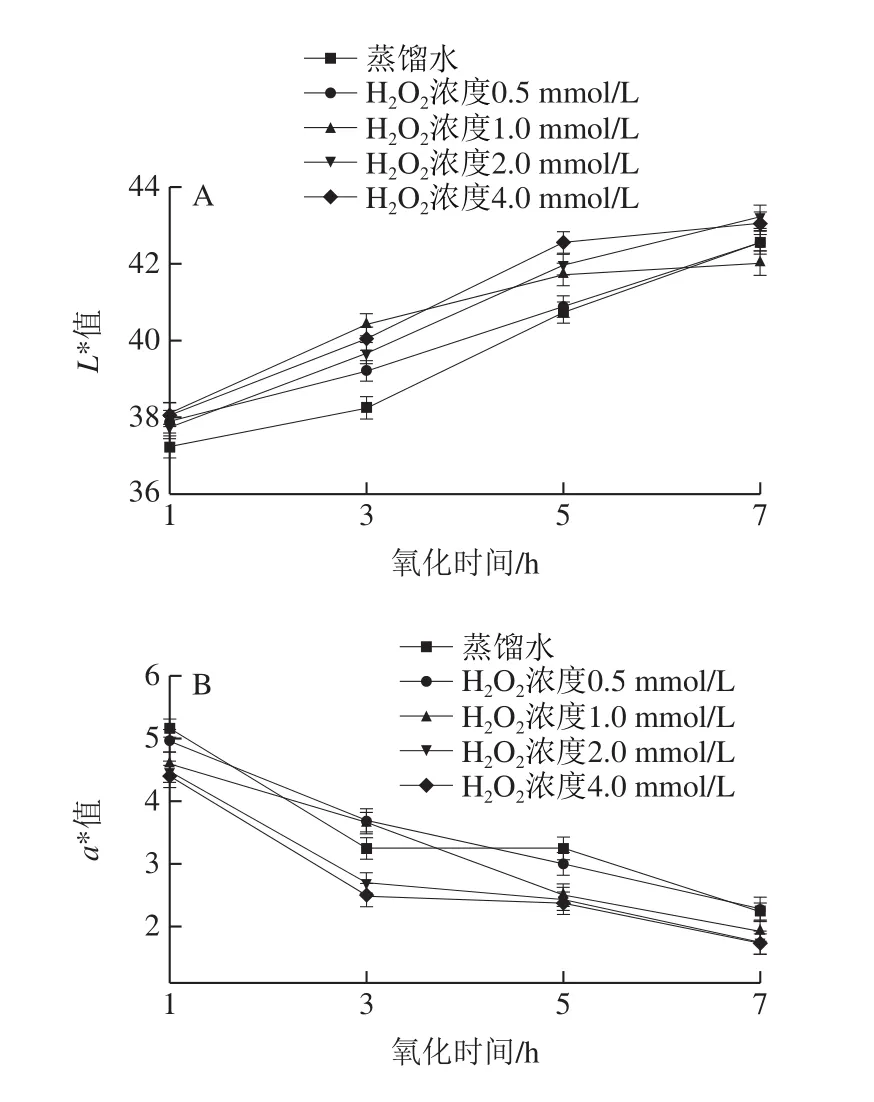
圖4 羥自由基氧化體系對中華管鞭蝦L*值(A)和a*值(B)的影響Fig.4 Effect of hydroxyl radical oxidation on L* value (A) and a* value (B) of S.crassicornis muscle
2.5 羥自由基氧化對中華管鞭蝦肌肉中TVB-N值影響
TVB-N是評定魚、貝、蝦類等動物性食品新鮮度的重要化學指標[31-32]。TVB-N值一般隨著鮮度的下降而增加,含量越低,水產品越新鮮[33-34]。由圖5可知,在氧化期間,中華管鞭蝦的TVB-N值均呈上升趨勢,且蒸餾水組與氧化組的TVB-N值差異顯著(P<0.05)。氧化1 h后,蒸餾水組和不同氧化組的TVB-N值分別為9.85、10.06、10.25、10.30、10.55 mg/100 g;氧化7 h后,分別增加了21.32%、21.77%、26.54%、24.76%、26.06%。TVB-N值與pH值結果基本一致,分析原因可能是蝦仁蛋白質易在氧化作用下發生水解,降解成為多肽片段甚至氨基酸、醛酮類等小分子堿性物質[35]。由此可見,蛋白質過度氧化會使TVB-N值上升,導致蝦仁的新鮮度下降。
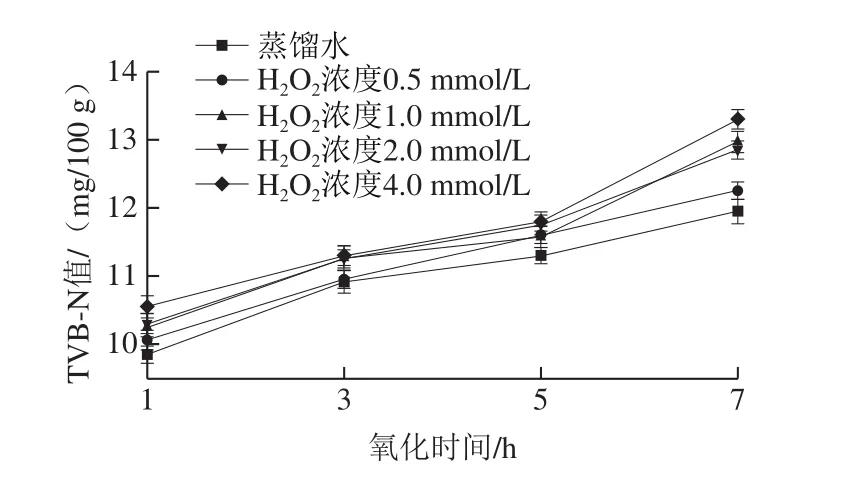
圖5 羥自由基氧化體系對中華管鞭蝦TVB-N值的影響Fig.5 Effect of hydroxyl radical oxidation on TVB-N content of S.crassicornis
2.6 HE染色觀察氧化蝦仁肌肉組織結構的變化
新鮮蝦仁肌肉組織結構整體比較完整,肌纖維排列緊致、規整,肌絲均勻密集,組織結構間僅出現少量較小空隙(圖6A)。不同濃度H2O2處理組的蝦肉經過氧化后呈現出不同程度的劣變,低濃度0.5 mmol/L和1.0 mmol/L H2O2氧化時肌纖維的變化主要表現胞間距增大,肌絲變細,甚至出現變形斷裂的現象(圖6B、C),這可能是氧化增加了肌原纖維蛋白間的疏水作用和共價作用,導致肌絲間接觸增強[36]。隨著氧化濃度的增加,2.0 mmol/L和4.0 mmol/L H2O2組肌纖維排列混亂,肌原纖維蛋白細胞間距逐漸增大,結構趨于松散,肌絲變細程度加深、斷裂嚴重,卷曲明顯(圖6D、E),這可能是由于蝦仁在羥自由基氧化條件下,肌內膜分裂,肌肉組織的完整性被損壞,細胞汁液流失嚴重,導致肌肉微觀結構遭到嚴重破壞。這與前面水分含量結果相符,纖維間隙變大并產生小片化,破壞了肌肉組織的網狀結構,從而使大量儲存于肌肉組織間隙的自由水難以被束縛而被排出,最終導致蝦仁水分含量下降,肌肉失去了新鮮蝦肉具有的微觀結構[37]。
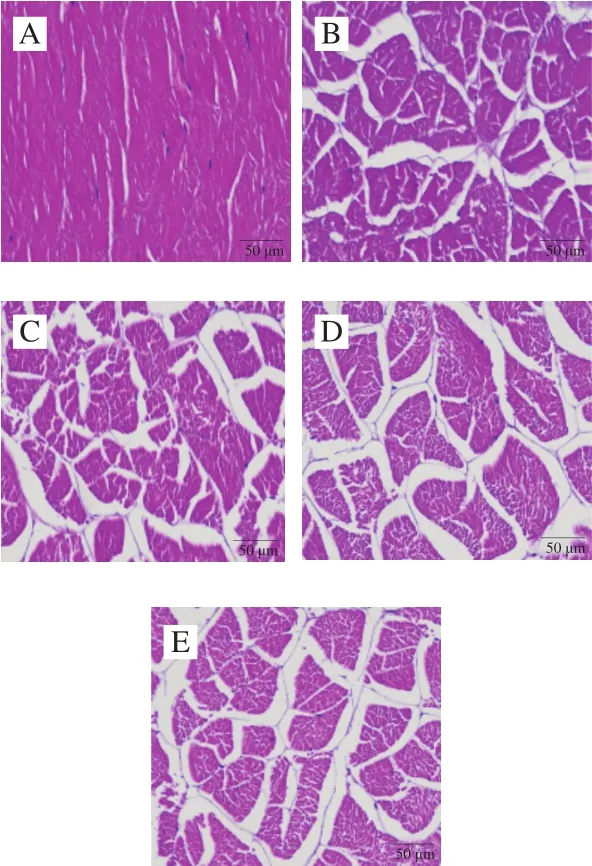
圖6 HE染色觀察氧化蝦仁肌肉組織結構的變化Fig.6 Histological examination of oxidized shrimps after HE staining
2.7 掃描電鏡觀察氧化蝦仁肌肉組織結構的變化
如圖7A所示,新鮮蝦仁組織微觀結構,橫切面稍有凸起,肌纖維直挺、排列整齊,肌內膜和肌束膜結構較完整。氧化7 h后(圖7B~E),隨著氧化濃度的增加,其組織結構破壞的程度也增加,結締組織排列順序被打亂;當濃度最大時,組織與組織之間存在大量較大的空隙,且絕大多數組織發生斷裂。可能是由于肌肉蛋白發生了一定程度的氧化變性,使得原來存在于肌原纖維蛋白內部的水分溢出,和部分肌漿蛋白填充于間隙中。在氧化過程中,肌肉的肌節可能會發生聚合或收縮,從而加速間隙增大,同時在體內蛋白酶的作用下,結締組織的不斷降解,導致肌纖維與肌內膜發生了脫離,使間隙增大[38]。可見,中華管鞭蝦在羥自由基的氧化條件下,肌肉組織結構會受到不同程度的破壞,導致肌肉質地軟化和品質下降。
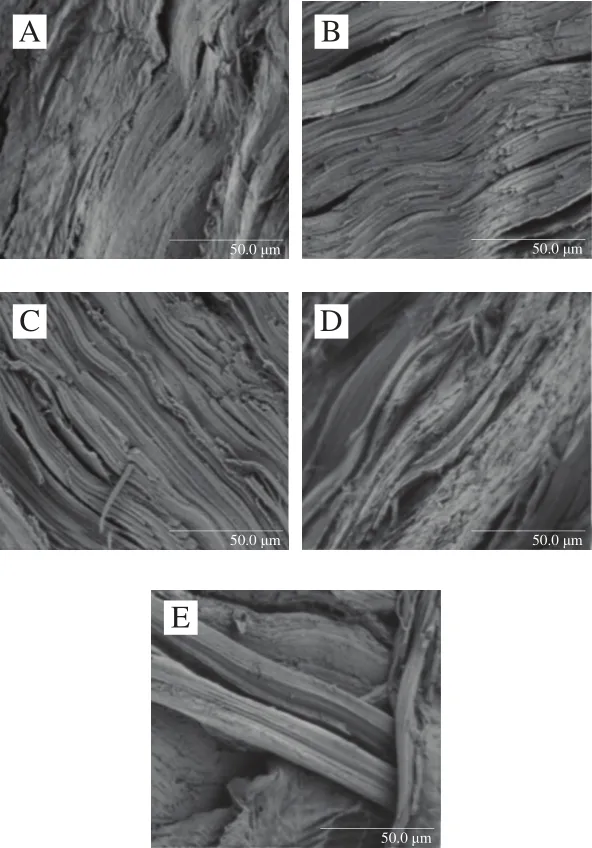
圖7 掃描電鏡觀察氧化蝦仁肌肉組織結構變化Fig.7 SEM micrographs of microstructure of oxidized shrimps
2.8 SDS-PAGE分析
SDS-PAGE能夠顯示肌原纖維蛋白在不同濃度H2O2氧化后不同分子質量蛋白的交聯和降解情況[39-40]。在不同H2O2濃度的溶液體系下氧化7 h,中華管鞭蝦肌原纖維蛋白SDS-PAGE如圖8所示。可以看出,隨著H2O2濃度的增加,180 kDa左右的蛋白條帶濃度增大。通過對比條帶顏色可以發現過氧化組的蛋白質聚集情況均高于新鮮蝦仁,說明中華管鞭蝦在氧化過程中,蛋白質發生交聯和聚集形成了分子質量較大的蛋白質聚合體。這可能是因為,在氧化條件下,蛋白分子共價發生交聯或是一些亞基片斷的重新連接,導致蛋白結構發生較大改變,產生了分子質量較大的聚集體。這與李艷青等[41]對鯉魚肌原纖維蛋白進行氧化所得的研究結果基本一致。同時,隨著氧化濃度的繼續增大,蛋白質遭到進一步破壞,發生降解。其中H2O2濃度越高,蛋白條帶的變化越大。35~25 kDa之間2 條濃度較小的條帶隨著氧化濃度的增加發生降解,條帶幾乎消失。可能是經過氧化后,使肌纖維發生收縮或斷裂,引發肌原纖維蛋白變性、肌細胞組織結構破裂,誘使肌原纖維蛋白質中主要蛋白發生降解,從而電泳條帶變淡[42]。電泳分析結果表明,中華管鞭蝦在氧化過程中,蛋白質會發生不同程度的聚集和降解,不同氧化濃度之間存在差異,且氧化濃度越高,蛋白質的降解速度越快,肌蛋白含量越低。
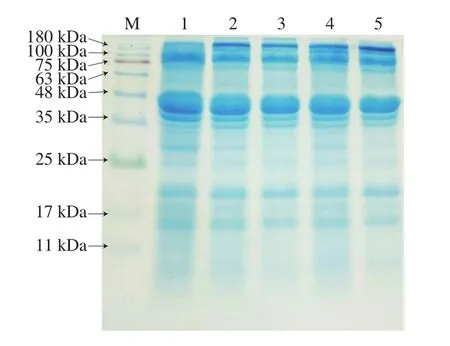
圖8 SDS-PAGE圖譜Fig.8 SDS-PAGE patterns of fresh and oxidized shrimps
3 結 論
在羥自由基氧化體系中,不同H2O2濃度條件氧化下,隨著時間的延長,中華管鞭蝦品質特性發生顯著變化。即隨著氧化程度的增加,中華管鞭蝦的表現為肌肉pH值不斷升高,水分活度和水分含量呈先上升后下降趨勢,咀嚼性、彈性和a*值不斷降低;L*值和TVB-N值呈不斷上升趨勢。觀察其微觀結構發現,氧化后的蝦仁纖維組織之間的空隙擴大,甚至發生斷裂,肌纖維排列也變得松散。不同濃度氧化劑處理后,高分子質量蛋白發生交聯形成聚集體,同時,一些低分子質量蛋白條帶發生降解。由此可以得出,自由基氧化可顯著影響中華管鞭蝦品質特性以及肌肉蛋白質的降解程度。

