醬香型白酒機械化制曲發酵細菌群落的演替
左乾程,黃永光,*,郭 敏,胡 峰,尤小龍,程平言
(1.貴州大學釀酒與食品工程學院,貴州省發酵工程與生物制藥重點實驗室,貴州 貴陽 550025;2.貴州茅臺酒廠(集團)習酒有限責任公司,貴州 習水 564600)
白酒是華夏民族上千年傳承的傳統民族特色飲料酒,其釀造工藝別具一格,酒體風味豐富而獨特,在國際上美譽度高,與白蘭地、威士忌、伏特加、朗姆酒、金酒并列為世界六大蒸餾酒[1]。中國白酒種類繁多,依據口感及風格差異可分為醬香型、濃香型、清香型、米香型、兼香型、芝麻香型、鳳香型、特香型、豉香型、藥香型、老白干香型[1]。其中以茅臺為代表的醬香型白酒是中國白酒中釀造工藝最為復雜、最具特色以及最受消費者喜愛的白酒,其復雜的釀造工藝可概括為“高溫制曲、高溫堆積發酵、高溫餾酒、長期貯存”等[2],高溫制曲是醬香型白酒釀造工藝中最關鍵的環節,高溫大曲的質量直接決定著醬香型白酒的產量及質量。
高溫大曲是醬香型白酒釀造中的唯一糖化發酵劑,是利用純小麥作為原料,添加母曲自然接種、培養而成,制曲過程曲胚發酵溫度高達60~65 ℃,通過高溫發酵、培菌實現制曲過程微生物的演替和酶的有效積累。傳統的高溫大曲制作主要采用人工操作,存在生產環境差、勞動強度大、生產成本高、生產效率低等缺點,加之由于人工踩曲的開放性,必然會受到操作因素的影響,使得大曲質量難以穩定。近年來,隨著傳統釀造技術的不斷發展,高溫大曲機械化制曲進程也在不斷推進。高溫大曲機械化制曲工藝如圖1所示,通過模仿人工腳掌踩曲動作,采用獨創氣缸兩階段多次踩曲技術(仿生踩曲),代替了傳統人工腳掌踩曲的操作,大大提高了高溫大曲質量穩定性及生產效率,降低了勞動強度及生產成本。機械化制曲過程除采用仿生壓曲機代替傳統人工腳掌踩曲操作外,其他條件(如用曲及其比例、制曲原料、工藝操作及發酵參數控制等)皆與傳統制曲一致,雖然機械化與傳統人工踩出的曲在外觀形狀及松緊程度上并無明顯差異,但機械化壓制的曲塊與傳統人工踩制曲塊在發酵過程是否在微生物的生長、微生物菌群結構的差異,以及機械化制曲與傳統制曲發酵過程微生物群落演替有無差異,均成為機械化制曲能否代替傳統人工制曲的關鍵問題。

圖1 機械化制曲工藝操作流程Fig.1 Flow chart for the mechanized production of high-temperature Daqu
眾所周知,醬香型高溫大曲與其他香型白酒釀造大曲的區別不只是制曲溫度更高,更是曲塊中微生物群落結構的獨特性、酶類的豐富性及風味物質的復雜性。高溫大曲的這些特性直接決定醬香白酒的產量和質量,而這些特性是由制曲過程的微生物群落結構及其演替所決定的。高溫大曲發酵過程的微生物菌群結構包括酵母菌、細菌、霉菌及放線菌,其中細菌在白酒發酵過程中具有產酶及產香等功能,其代謝產生豐富的風味物質決定醬香型白酒的風格及品質[3-5],因此,系統解析高溫大曲機械化制曲發酵過程細菌群落結構,對了解制曲過程發酵機理、調控大曲生產及提高大曲和白酒質量具有重要意義。目前已經對清香大曲[6]、兼香型大曲[7]發酵過程細菌群落結構進行了研究。對醬香型大曲傳統制曲發酵過程細菌群落結構也進行了研究[8],但其機械化制曲發酵過程細菌群落結構以及其與傳統制曲發酵過程細菌群落結構有何差別尚不清晰,在一定程度上制約了醬香型白酒機械化制曲的發展,因此,本研究采用高通量測序技術及數理統計分析,對高溫大曲機械化制曲發酵過程細菌群落結構及其演替進行解析,并分析環境因子對大曲發酵過程細菌群落結構的調控作用,對了解機械化制曲過程發酵機理、調控機械化大曲生產具有重要意義,以期推動醬香型白酒機械化制曲產業的創新發展。
1 材料與方法
1.1 材料與試劑
樣品采自貴州茅臺集團XJ公司醬香機械化制曲車間,根據生產經驗表明,大曲入房、第1次翻曲、第2次翻曲及大曲出房為發酵關鍵時間點及關鍵工藝控制點,因此,選取曲塊入房(發酵0 d)、第1次翻曲(發酵7 d)、第2次翻曲(發酵14 d)、曲塊出房(發酵40 d)為采樣時間點;每個采樣時間點采集曲房靠門、中間、靠窗的上、中、下三層大曲樣品各500 g,進行粉碎后再充分混勻以消除取樣誤差,得到一個取樣時間點的樣品,采集完成后立即進行DNA提取及相關理化指標的測定。
DNA Marker 寶生物工程有限公司;磷酸鹽緩沖液、引物合成 生工生物工程(上海)股份有限公司;E.Z.N.A.Soil DNA Kit 美國Omega BioTek公司;異丙醇(分析純)、TAE緩沖液 北京索萊寶科技有限公司;瓊脂糖 南京生興生物技術有限公司;Goldview染料 上海賽百盛有限公司;rTaqDNA聚合酶試劑盒北京全式金生物技術有限公司。
1.2 儀器與設備
臺式高速冷凍離心機、紫外分光光度計 美國Thermo Fisher Scientific公司;高壓蒸汽滅菌鍋 致徽(廈門)儀器有限公司;旋渦混合器 北京北方同正生物技術發展有限公司;數顯恒溫水浴鍋 國華電器有限公司;電子天平 奧豪斯儀器(上海)有限公司;pH計德國Sartorius公司;聚合酶鏈式反應(polymerase chain reaction,PCR)儀 美國ABI公司;電泳儀 北京六一儀器廠;凝膠成像儀 上海培清科技有限公司。
1.3 方法
1.3.1 樣品預處理及DNA提取[9-12]
分別稱取1.1節各取樣時間點采取的混合曲粉15 g于無菌離心管中,加入30 mL 0.1 mol/L無菌磷酸鹽緩沖液及5 顆玻璃珠,渦旋振蕩8 min,400 r/min離心6 min,收集上清液,用磷酸鹽緩沖液洗滌沉淀,渦旋振蕩6 min,400 r/min離心6 min,吸取上清液,繼續用磷酸鹽緩沖液洗滌沉淀,渦旋振蕩4 min,400 r/min離心6 min,收集上清液。將3 次收集的上清液充分混勻后12 000 r/min離心5 min,棄去上清液,收集細胞沉淀。預處理完成后,參照E.Z.N.A.?Soil DNA Kit的操作說明書進行樣品總DNA的提取。
1.3.2 PCR擴增及Illumina MiSeq測序
應用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)擴增V3和V4高變區,引物兩端帶有12 個隨機核苷酸堿基(Barcode)作為樣品標簽。PCR體系及反應條件參考黃蘊利等[13]的方法,并適當修改。PCR體系:10×Buffer 4 μL,dNTPs 2 μL,正反應物各0.8 mL,rTaqDNA聚合酶0.2 μL,ddH2O 12.2μL,共計20 μL反應體系。PCR條件:95 ℃預變性3 min;95 ℃變性30 s,53 ℃退火30 s,72 ℃延伸60 s,27 個循環;72 ℃再延伸10 min。凝膠電泳:1%瓊脂糖凝膠,核酸染料(Gengreen),電壓90 V,電泳時間40 min。高通量測序在上海美吉生物醫藥科技有限公司進行。
1.3.3 理化指標測定
大曲樣品溫度的測定:采樣的同時將溫度計插入取樣點附近,保持1 min左右,待讀數穩定后,記錄溫度計溫度數據。水分、酸度的測定參照QB/T 4257—2011《釀酒大曲通用分析方法》[14]。
1.4 數據及圖像處理
采用Microsoft Office Excel 2016進行數據計算,IBM SPSS Statistics進行顯著性分析,R語言繪制群落柱形圖及相關性熱圖。
2 結果與分析
2.1 α多樣性分析
單個樣品的微生物α多樣性通常用Shannon指數和Chao1指數表征,Shannon指數一般代表微生物群落中物種的多少[15-16],Chao1指數一般用來估計微生物群落的豐富度[17]。如表1所示,機械化大曲發酵過程中細菌物種多樣性與豐富度呈波動式變化,在大曲進入曲房至第1次翻曲階段呈上升趨勢,第1次翻曲至第2次翻曲階段呈下降趨勢,第2次翻曲到出曲房時出現緩慢上升。這種變化趨勢主要與曲胚中的理化因子有關,在發酵前期(大曲入房到第1次翻曲階段),曲培溫度及水分適宜細菌生長,所以該階段細菌物種多樣性與豐富度增加,發酵中期(第1次翻曲至第2次翻曲之間),曲胚的平均溫度較高,高溫淘汰了部分不耐熱細菌,致使細菌物種多樣性與豐富度降低;第2次翻曲過后,曲胚溫度較之前有所降低,部分細菌又重新在大曲上生長,使得細菌物種多樣性與豐富度出現部分回升。
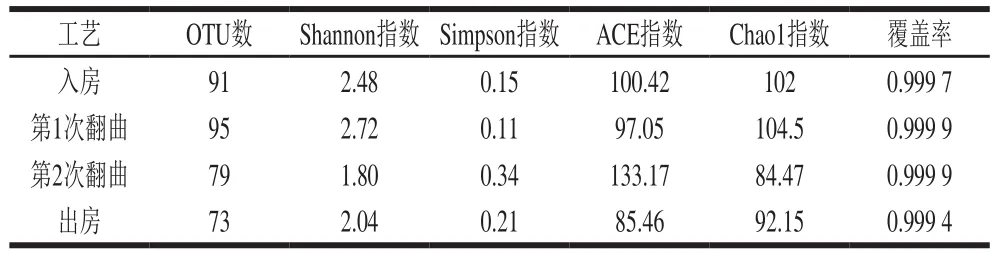
表1 樣本細菌群落多樣性指數Table 1 α-Diversity of bacterial community
2.2 機械化制曲發酵過程細菌群落結構分析
機械化制曲發酵過程中共檢出9 個菌門,其中平均相對豐度大于1%的僅有Firmicutes、Proteobacteria、Actinobacteria及Cyanobacteria(圖2)。大曲入房時,Firmicutes和Proteobacteria菌門在機械化大曲中占主導地位,平均相對豐度>20%。這與醬香高溫大曲傳統制曲發酵過程細菌群落結構一致[8],張雙燕等[6]通過高通量測序分析北京清香大曲發酵過程也發現這2 個門為其主要細菌種群,李申奧[7]通過高通量測序分析北京清香兼香型大曲發酵過程同樣發現這2 個門是主要細菌種群;同時,Firmicutes及Proteobacteria也是芝麻香型高溫大曲[18]以及濃香型大曲[19]中的主要細菌種群,說明這些細菌是中國白酒大曲中的關鍵微生物。此外,圖2表明,第1次翻曲之后,Firmicutes及Proteobacteria在機械化大曲中占主導地位(平均相對豐度>20%),且Firmicutes占有絕對優勢,平均相對豐度為75.35%。第1次翻曲之后,機械化大曲中變成了Firmicutes占主導地位,相對豐度高達95.66%~97.79%。該結果與清香型大曲[6]、兼香型大曲[7]發酵過程微生物的研究結論一致,表明大曲發酵過程中,細菌門水平群落多樣性降低,微生態結構由多菌系演替為單一的厚壁菌門為主導的發酵模式,是大曲發酵門水平微生態變化的規律性模式。
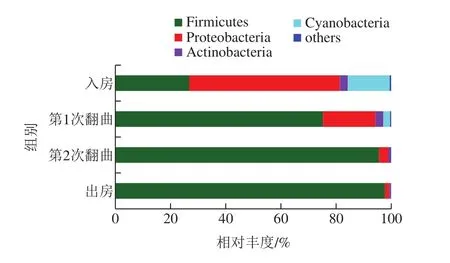
圖2 大曲樣品中的細菌群落結構(門水平)Fig.2 Bacterial community structure in Daqu samples at phylum level
機械化制曲發酵過程中共檢出84 個細菌屬,其中優勢細菌屬(至少在一個樣品中相對豐度大于1%) 為14 個(圖3),包括Pantoea、Rhizobium、Lactobacillus、Weissella、Bacillus、Oceanobacillus、Lentibacillus、Kroppenstedtia、Thermoactinomyces、Staphylococcus、Enterobacter、Saccharopolyspora、Pediococcus和Tepidimicrobium。大曲進入曲房(發酵0 d)時,大曲中Pantoea相對豐度最高(27.16%),其次是Rhizobium(21.66%)、Bacillus(10.33%)、Thermoactinomyces(4.78%)、Lentibacillus(4.25%)、Kroppenstedtia(3.27%)、Enterobacter(1.71%)及Staphylococcus(1.71%)。Pantoea、Lentibacillus及Kroppenstedtia均被檢出于多種大曲中[3,5,7-8],但其在釀酒中的功能尚不清晰;Rhizobium被發現于小麥中,對小麥的生長具有促進作用[20],推測該菌屬來源于制曲原料小麥,但其在釀酒中的功能尚未見報道。Bacillus是醬香型白酒發酵過程中主要的功能細菌種群,除了可以代謝淀粉酶、蛋白酶等多種水解酶外,還可代謝產乙偶姻、4-甲基吡嗪等風味物質[21-23],對醬香型白酒的風味品質具有重要貢獻[24-25]。Staphylococcus常被發現于香腸、火腿等發酵食品中,可產生獨特的風味[26]。第1次翻曲(發酵7 d)時,Pantoea、Lentibacillus及Kroppenstedtia平均相對豐度均下降至1%以下,推測該部分菌屬不耐熱或不耐酸,曲溫及酸度升高導致這部分菌屬相對豐度下降。而Bacillus、Lactobacillus、Weissella平均相對豐度上升,其中Bacillus平均相對豐度最高(40.76%),Lactobacillus、Weissella可代謝產生乳酸、乙酸等有機酸類物質,是造成大曲發酵前7 d酸度顯著升高的主要原因。大曲中酸度升高一方面可以抑制不耐酸雜菌的生長繁殖,另一方面乳酸、乙酸等物質也為白酒中風味物質的合成提供前體[27-28]。此外,大曲在高溫階段維持一段時間,一方面可以淘汰不耐高溫、不耐酸的雜菌,另一方面也為醬香型白酒高溫發酵篩選功能微生物。隨著發酵的進行,到第2次翻曲(發酵14 d)時,Lactobacillus和Weissella平均相對豐度下降至低于1%,是造成發酵后期酸度下降的主要原因。Bacillus平均豐度也降低至11.07%,而Lentibacillus、Pediococcus及Oceanobacillus平均相對豐度顯著升高,均超過或接近10%。大曲出房(發酵40 d)時,Lentibacillus平均相對豐度最高(39.53%),其次為Staphylococcus(18.24%)、Kroppenstedtia(15.58%)、Bacillus(15.53%)、Oceanobacillus(4.70%)及Rhizobium(1.19%)。

圖3 大曲樣品中的細菌群落結構(屬水平)Fig.3 Bacterial community structure in Daqu samples at genus level
大曲入房(0 d)時,大曲塊中Pantoea、Rhizobium及Bacillus為主要優勢菌屬(平均相對豐度>10%)。第1次翻曲(7 d)時,大曲塊中主要優勢菌屬為Bacillus、Rhizobium及Lactobacillus,平均相對豐度>10%。第2次翻曲(14 d)時,大曲塊中Lentibacillus、Oceanobacillus及Bacillus為主要優勢菌屬,平均相對豐度>10%。大曲塊出房(40 d)時,大曲塊中Lentibacillus、Staphylococcus、Kroppenstedtia及Bacillus菌屬平均相對豐度大于10%,是主要優勢菌屬。其中,Bacillus在整個發酵過程中平均相對豐度都大于10%,是機械化制曲整個發酵過程中的主要優勢菌。同時,Pantoea、Rhizobium、Bacillus、Rhizobium、Lactobacillus、Lentibacillus、Oceanobacillus、Staphylococcus、Kroppenstedtia也是醬香型白酒發酵過程中的主要優勢菌[29-31],表明這些菌屬在制曲與制酒過程存在明顯的菌群遷徙,生態結構演替。
2.3 機械化制曲與傳統制曲發酵過程細菌群落結構對比分析
郭敏[8]采用高通量測序對醬香型白酒傳統制曲發酵過程細菌群落結構進行研究,共檢出82 個細菌屬,稍低于機械化制曲發酵過程的84 個細菌屬,如圖4a所示,其中有75 個細菌屬為傳統制曲和機械化制曲發酵過程共有細菌屬,占傳統制曲發酵過程總細菌屬數的91.46%,表明機械化制曲與傳統制曲發酵過程細菌群落結構差別不大。此外,傳統制曲發酵過程的優勢細菌屬(至少在一個樣品中相對豐度大于1%)也是14 個,包括Pantoea、Rhizobium、Lactobacillus、Weissella、Bacillus、Oceanobacillus、Lentibacillus、Kroppenstedtia、Thermoactinomyces、Staphylococcus、Enterobacter、Saccharopolyspora、Leuconostoc和Pseudomonas,其中Pantoea(機械化制曲中平均相對豐度為6.92%,傳統曲為7.04%,下述皆為平均相對豐度)、Rhizobium(機械化制曲為10.14%,傳統曲為10.02%)、Lactobacillus(機械化制曲為1.76%,傳統曲為1.59%)、Weissella(機械化制曲為3.94%,傳統曲為3.76%)、Bacillus(機械化制曲為19.10%,傳統曲為17.67%)、Oceanobacillus(機械化制曲為3.78%,傳統曲為2.74%)、Lentibacillus(機械化制曲為25.14%,傳統曲為27.25%)、Kroppenstedtia(機械化制曲為5.69%,傳統曲為5.31%)、Thermoactinomyces(機械化制曲為3.94%,傳統曲為3.76%)、Staphylococcus(機械化制曲為7.36%,傳統曲為6.91%)、Enterobacter(機械化制曲為0.43%,傳統曲為0.56%)、Saccharopolyspora(機械化制曲為1.01%,傳統曲為1.28%)12 個細菌屬為機械化制曲與傳統制曲發酵過程共有優勢菌(圖4b),占傳統制曲與機械化制曲發酵過程優勢細菌屬的85.71%,且這些優勢菌屬在兩種曲醅發酵過程中平均相對豐度較為接近,相差不大;表明機械化制曲與傳統制曲過程優勢菌具有較高的相似性。與傳統制曲發酵過程相比,Pediococcus和Tepidimicrobium是機械制曲發酵過程特有的優勢細菌屬,但其在釀酒過程中的功能尚不清晰(本課題組正在開展相關研究);而Leuconostoc及Pseudomonas是傳統制曲過程特有的優勢細菌屬,這兩種菌屬在釀酒中的功能尚不清晰(本課題組正在開展相關研究)。因此,目前的研究結果表明醬香型白酒高溫大曲機械化制曲發酵過程細菌群落結構與傳統制曲過程具有很高的相似性,表明從發酵細菌群落結構上來說高溫大曲機械化制曲可以代替人工制曲,且與傳統制曲相比,機械化制曲不僅在很大程度上提高了大曲質量穩定性及生產效率,大幅降低勞動強度及生產成本,還能避免工人在為惡劣的環境下操作,對推動醬香型白酒行業的機械化與現代化發展具有促進作用。
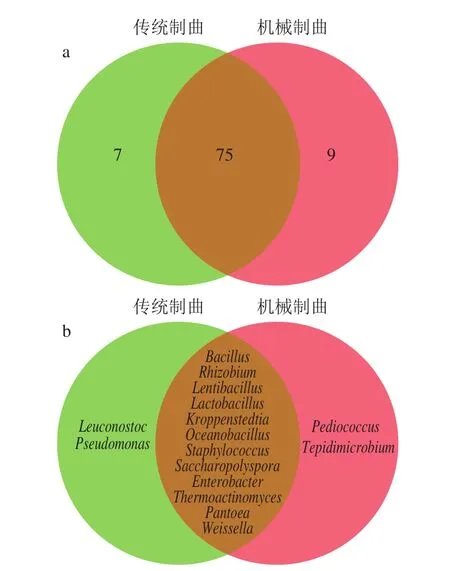
圖4 機械制曲與傳統制曲發酵細菌群落結構對比Fig.4 Comparison of the structure of bacterial community between mechanical and traditional Daqu-making processes
2.4 環境因子對機械化曲胚中細菌生態結構多樣性的影響
環境因子對微生物的生命及其行為具有較強的影響,進而調控微生物在大曲發酵過程中的群落結構及演替。如圖5a所示,冗余分析(redundancy analysis,RDA)結果顯示大曲溫度、水分及酸度對微生物細菌群落結構有重要影響,第1次翻曲時,細菌群落結構主要受溫度及水分影響,呈正相關,表明此時的曲醅溫度及水分比較適合大曲中細菌生長,第2次翻曲至出房時,大曲中細菌群落結構基本不受溫度、水分及酸度等環境因子的影響,推測由于第2次翻曲過后曲醅水分、溫度及酸度變化不大,對細菌群落結構影響不大,且經過前期的條件淘汰了部分不能耐受高溫制曲條件的細菌,剩下的細菌能夠耐受高溫大曲的環境,這也是高溫制曲的目的,為后期高溫發酵篩選微生物。為揭示環境因子對優勢細菌群落的影響,將14 個優勢細菌屬(平均相對豐度>1%)與發酵過程環境因子進行關聯分析,結果如圖5b所示,大曲優勢細菌屬(平均相對豐度>1%)受環境因子影響較大,Bacillus、Lactobacillus、Weissella、Pediococcus、Saccharopolyspora、Thermoactinomyces、Rhizobium、Oceanobacillus8 種優勢菌群與大曲溫度呈正相關,其中Bacillus、Lactobacillus、Weissella等菌屬是醬香型白酒發酵過程中的主要功能微生物[29-33],從該層面也論證了醬香型白酒高溫制曲的合理性。Thermoactinomyces、Tepidimicrobium、Pantoea、Rhizobium、Saccharopolyspora5 種菌屬與大曲水分呈正相關,而Bacillus、Lactobacillus、Weissella等主要功能菌屬則與大曲水分呈負相關,該結果表明機械化制曲發酵過程需控制水分不要太高,水分過高導致“燒曲”等異常情況發生,一方面又對Bacillus、Lactobacillus、Weissella等主要功能菌屬生長造成不利影響。此外,Bacillus、Lactobacillus、Weissella等主要功能菌屬與大曲酸度呈正相關,且Lactobacillus、Weissella等菌屬也是大曲發酵過程產酸的主要細菌。以上結果表明,高溫大曲發酵過程保持一個相對較高的溫度及酸度,既有利于Bacillus、Lactobacillus、Weissella等主要功能菌屬的生長,又能抑制不耐熱、不耐酸雜菌的生長。
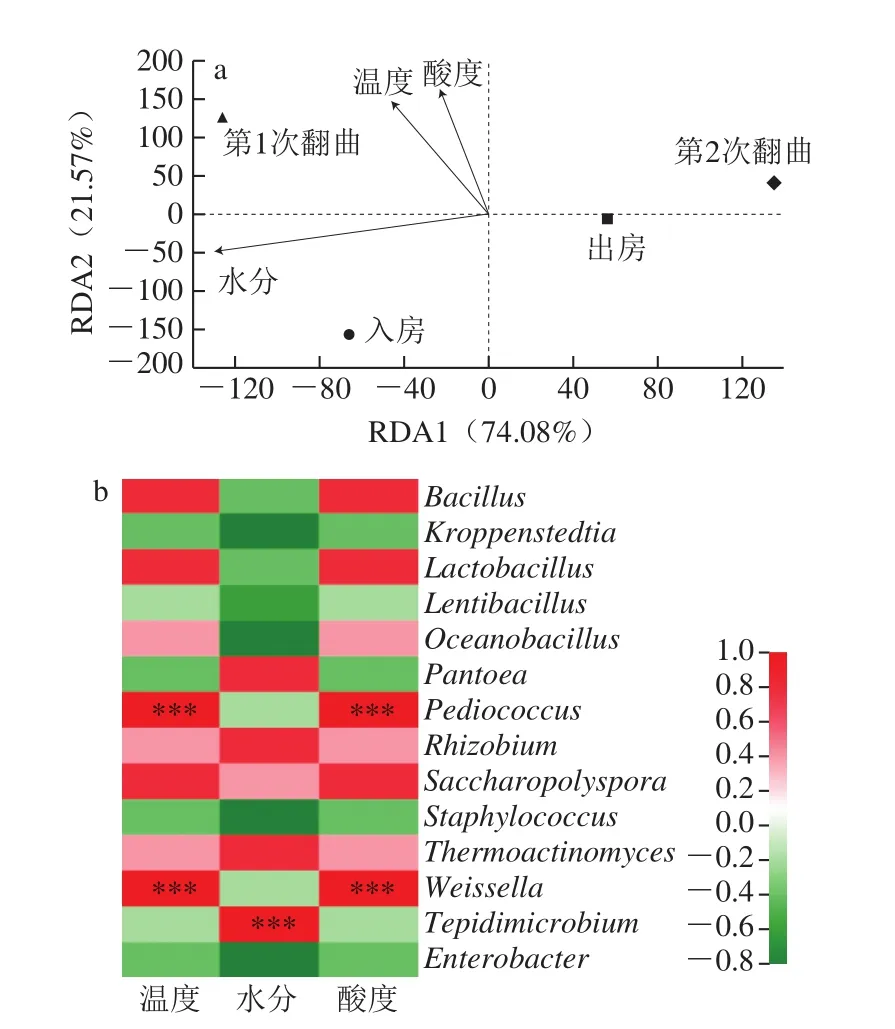
圖5 發酵過程中細菌群落結構與大曲理化因子相關性分析Fig.5 Correlation between bacterial community structure and physicochemical properties of Daqu samples during fermentation
3 結 論
本研究應用高通量測序及數理分析方法對醬香型白酒機械化制曲發酵過程中的細菌菌群結構進行解析,從機械化制曲發酵過程中共檢出9 個菌門,優勢菌門為Firmicutes、Proteobacteria、Actinobacteria及Cyanobacteria,且隨著發酵的進行,細菌門水平群落多樣性降低,由多菌系生態結構演替為單一的厚壁菌門為主導的發酵模式。機械化制曲發酵過程中共檢出84 個細菌屬,稍高于傳統制曲的82 個細菌屬;機械化制曲發酵過程優勢細菌屬(至少在一個樣品中相對豐度大于1%)共14 個,包括Pantoea、Rhizobium、Lactobacillus、Weissella、Bacillus、Oceanobacillus、Lentibacillus、Kroppenstedtia、Thermoactinomyces、Staphylococcus、Enterobacter、Saccharopolyspora、Pediococcus和Tepidimicrobium,其中Pediococcus和Tepidimicrobium是機械制曲發酵過程特有的優勢細菌屬,Leuconostoc及Pseudomonas是傳統制曲過程特有的優勢細菌屬,表明機械化制曲與傳統制曲過程優勢菌具有較高的相似性。通過優勢菌與環境因子相關性分析發現,主要功能細菌屬Bacillus、Lactobacillus及Weissella都與大曲制曲溫度呈正相關,與大曲酸度呈正相關,表明在機械化制曲過程中要合理科學控制相對較高的溫度酸度,這樣既有利于主要功能微生物的生長,又能抑制不耐熱、不耐酸雜菌的繁殖。本研究為推進醬香型白酒機械化制曲發展提供了基礎理論和學科依據。
本研究從發酵細菌群落結構上說明醬香型白酒的機械化制曲可以代替人工制曲,且與傳統制曲相比,機械化制曲不僅在很大程度上提高了大曲質量穩定性及生產效率,大幅降低勞動強度及生產成本,還能避免工人在惡劣的環境下操作,有利于白酒行業的機械化與現代化發展。

