以肺部感染為主的惠普爾病1例
曾灝瑜, 佘德宇
1 臨床資料
患者男,28歲,以“活動后氣促1個月,反復腹瀉半個月,氣促加重2 d”為主訴于2020年10月14日就診我院。患者于入院前1個月開始出現活動后氣促,上樓梯1~2層即氣促明顯。入院前半個月患者無明顯誘因出現腹瀉,每日大便3~5次,解稀水樣便,無黏液膿血,患者自行口服抗生素治療(具體不詳)后腹瀉逐漸好轉,但氣促癥狀仍進行性加重,夜間不能平臥,伴有咳嗽、咯痰、全身乏力。入院當天患者出現呼吸困難加重,由家屬送至我院就診。入院時患者精神極差,呼吸急促,應答不利,當天解稀便1次,尿量少,近半個月體重下降約2 kg。
既往史: 近5年有嗜酒史,每日飲5~8瓶啤酒,發病期間仍間斷飲酒。否認發病前有不潔飲食史;否認“高血壓”“糖尿病”“冠心病”等病史;否認“結核”“乙肝”等傳染病史。
入院查體:體溫36.8℃,脈搏124次/min,呼吸32次/min,血壓103/55 mmHg。急性面容,神清,精神極差難以應答及配合查體。雙側瞳孔等大等圓,對光反射靈敏。口唇蒼白,咽充血,雙側扁桃體未見腫大,可聞及咽部有痰鳴音。雙肺呼吸音粗,雙側肺底可聞及廣泛細濕啰音。心、腹查體未見明顯異常。余神經系統查體患者不能配合。
輔助檢查:入院行實驗室檢查,PaO268 mmHg,PaCO211.8 mmHg,乳酸 8.5 mmol/L,pH 7.44,白細胞 11.72×109/L,降鈣素原 0.796 μg/L,天冬氨酸轉氨酶 76 U/L,γ-GT 262 U/L,白蛋白36.7 g/L,肌酐 121.0 μmol/L,血鈉 113.6 mmol/L,血氯 79.9 mmol/L,血糖 9.2 mmol/L,前腦利鈉肽(pro-BNP) 21 031 ng/L,肌紅蛋白 178.8 μg/L,超敏肌鈣蛋白I 445.8 μg/L。糞便霍亂弧菌、沙門菌、志賀菌等培養均為陰性。
腹部超聲示:①肝實質彌漫性病變(酒精肝?);②膽、脾、胰、雙腎、膀胱未見明顯異常。心臟超聲:①心包少量積液;②心內結構未見明顯異常;③心功能正常;左室射血分數(LVEF)66%,左心室縮短率(FS) 36%。胸部CT提示:①雙肺實變病灶,以雙下肺為主;②心包少量積液;③雙側胸腔少量積液。入院診斷:①中毒性心肌炎;②急性心功能不全 NYHA Ⅲ級;③肺部感染;④電解質紊亂(低鈉低氯血癥);⑤代謝性酸中毒并呼吸性堿中毒;⑥急性腎功能不全(腎前性);⑦酒精性肝病;⑧急性腸炎?⑨多漿膜腔積液。
入院后心電監護,行氣管插管有創呼吸機輔助通氣,予護胃護肝、平喘化痰、糾正電解質紊亂、利尿減輕心臟負荷等對癥支持治療,經驗性給予“頭孢噻肟-舒巴坦+莫西沙星+利巴韋林”抗感染、抗病毒治療,患者腹瀉好轉,但仍可吸出大量黃白膿痰,間有發熱,體溫多波動于37.0~38.5℃,行纖維支氣管鏡吸痰,取肺泡灌洗液送檢病原學高通量DNA基因測序。于入院第3日檢出惠普爾養障體,余細菌、真菌、病毒、寄生蟲及非典型病原體均未檢出。當天調整抗感染治療方案為:“頭孢曲松+甲氧芐啶-磺胺甲唑”后,患者熱峰即明顯下降,入院后1周起未再出現發熱,精神明顯好轉,痰量減少,肺部啰音消退,復查血象、降鈣素原恢復正常,復查胸部CT示雙肺感染灶較前明顯吸收;雙側胸腔少量積液;心包少量積液同前無明顯變化(圖1)。病情平穩好轉,于入院后第8天轉出重癥醫學病房,繼續抗感染、糾正水電解質紊亂等對癥支持治療后于入院第10天好轉出院。
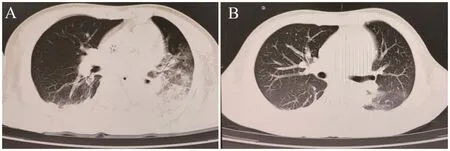
圖1 患者入院時和住院1周后肺部CTFigure 1 Pulmonary CT scans of the patient at admission and after one-week treatment
出院診斷:①惠普爾病;②中毒性心肌炎;③急性心功能不全 NYHA Ⅲ級;④肺部感染;⑤電解質紊亂:低鈉低氯血癥;⑥代謝性酸中毒并呼吸性堿中毒;⑦急性腎功能不全(腎前性);⑧酒精性肝病;⑨急性腸炎;⑩多漿膜腔積液;低蛋白血癥。
2 討論
該患者為青年男性,近5年有大量酗酒史,既往無特殊病史,以腹瀉伴氣促癥狀起病,伴有營養不良,腹瀉逐漸好轉同時肺部癥狀卻逐漸加重,入院時有明顯呼吸困難,需呼吸機持續輔助通氣改善低氧血癥,伴嚴重電解質紊亂。入院后行經驗性抗感染治療后,肺部感染仍進一步加重,肺泡灌洗液病原學高通量DNA基因檢測檢出惠普爾養障體后針對性調整抗感染治療,患者體溫逐漸下降,結合實驗室及影像學檢查均支持感染明顯好轉,病情持續平穩好轉后出院。
惠普爾病是由一種革蘭陽性菌——惠普爾養障體引起罕見的全身性感染疾病,多見于有污水、污土接觸史及免疫缺陷的人群[1-2],據報道歐洲地區年發病率僅有百萬分之三[3-4],以慢性感染為主,偶見急性感染起病,一旦起病多器官均可受累及,因此臨床表現多樣而不易被及時診斷,未及時治療有致死性[4]。
惠普爾病可累及胃腸道、心血管系統、呼吸系統、中樞神經系統、骨骼系統及皮膚等全身多系統。典型惠普爾病最常見的癥狀為體重下降,多伴有腹瀉,其他較常見的癥狀有游走性關節炎、心包炎、心內膜炎、葡萄膜炎及多種神經系統受累癥狀[5]。據報道,在典型的惠普爾病中,有30%~40%患者發生肺部受累,出現胸腔積液、肺浸潤或縱隔肉芽腫性腺病[6]。惠普爾病累及胃腸道的最常見的臨床表現為腸道脂肪代謝障礙,胃鏡下多可見十二指腸及空腸黏膜組織學上的損傷,小腸絨毛增粗變形,活檢組織內巨噬細胞PAS染色陽性或可在電鏡下發現惠普爾養障體。診斷主要依賴于十二指腸活檢標本PAS染色、惠普爾養障體PCR檢測及相關臨床表現,此外若胸膜、肺、肝等活檢或闌尾病理顯示有本病典型的組織學改變者,結合有陽性病原學發現,亦可確立診斷[7]。
迄今惠普爾病的治療仍未有廣泛的共識,主要的治療原則為針對惠普爾養障體的抗感染治療、營養支持、糾正水電解質紊亂。由于病例罕見,缺乏大量病例的臨床治療經驗,抗感染治療方案均為經驗性治療,缺乏足夠的依據支持。在過去四環素一度被列為一線治療藥物,但卻被發現治療后復發率很高(平均28%)。隨后還先后提出了包括氯霉素、青霉素G、鏈霉素等抗感染方案。但即使有上述特定的抗感染治療方案,平均5年后仍有2%~33%的病例出現臨床復發,且復發通常以神經系統受累為特征[2,8]。目前抗菌藥物治療的標準傾向于選擇能夠跨越血腦屏障的抗菌藥物,如甲氧芐啶-磺胺甲唑。
在一項包括40例的隨機對照試驗中使用了靜脈注射美羅培南1 g, 3次/d或頭孢曲松2 g,1次/d,持續14 d,然后口服甲氧芐啶-磺胺甲唑160~800 mg,2次/d,口服1年的方案,治療過程中僅有2例死于其他病因,且其余患者在隨后10年隨訪均未出現復發,達到臨床治愈[9]。而在另一項前瞻性非隨機對照研究中對此方案進行了改良,予以靜脈注射頭孢曲松2 g,1次/d,連續14 d,口服同等劑量甲氧芐啶-磺胺甲唑,療程縮短至3個月,但治療效果與前無明顯差異[10]。而在另一項29例惠普爾病的隊列研究中則提出了聯用多西環素及羥基氯喹治療1年,然后使用多西環素終生治療的治療方案,并在體外實驗中也同樣取得良好的療效[11]。回顧本病例,患者有長期大量飲酒史,存在潛在的免疫功能低下狀態導致機會性感染可能,以腹瀉癥狀起病,伴有低蛋白血癥、嚴重低鈉低氯血癥等營養不良表現,在入院時患者以嚴重的肺部感染為主要表現,結合患者上述癥狀及肺泡灌洗液中檢出惠普爾養障體,從而作出惠普爾病診斷。診斷后迅速調整抗菌藥物,應用了目前推薦的頭孢曲松及甲氧芐啶-磺胺甲唑。由于考慮患者同時存在嚴重肺部及消化道感染,導致了嚴重內環境紊亂,單用頭孢曲松抗感染力度不足的可能性大,因此同時使用頭孢曲松及甲氧芐啶-磺胺甲唑抗感染治療。經治療后患者消化道癥狀迅速消退,1周后復查胸部CT提示雙肺感染灶較前明顯吸收,證實了調整方案后抗感染治療效果顯著,也進一步支持了惠普爾病的診斷。遺憾的是,患者出于經濟原因而未完善內鏡檢查及獲得進一步的病理學證據。
多數文獻報道此病主要集中于消化道癥狀及關節炎、葡萄膜炎、心內膜炎等表現,肺部病變的相關報道十分稀少,報道病例中患者多表現為氣短、咳嗽,伴或不伴有胸痛,胸部CT可見雙肺基底部病灶,肺內結節影及縱隔病變[12-16]。與報道病例相仿的是,本病例肺部癥狀主要為咯痰、呼吸困難、發熱,伴有低氧血癥,且影像學同樣提示雙肺實變病灶主要位于基底段。而與報道不符的是本病例并無關節炎表現,且消化道、肺部癥狀呈序貫性發展,肺部CT未見結節及縱隔病灶,整個病情轉歸過程持續1個月余。在治療選擇上,不同于推薦的頭孢曲松、甲氧芐啶-磺胺甲唑序貫抗感染方案,本例選擇了兩種抗菌藥物同時聯用,并取得了顯著的治療效果,提示了現存的推薦抗感染治療方案或仍存在較大的調整空間,但由于這種疾病病例數少,需要很長時間的隨訪,因此有必要通過其他研究來進一步調整治療方案。本報道這一病例并提供影像學表現以供參考,提示當遇到相似臨床表現病例時應疑診這一罕見病,積極尋找活檢及病原學證據,及時明確診斷以調整抗感染治療方案。

