甲狀腺癌患者術后外周血NGAL、TG及TGAb水平的預后評估價值
王曉陽,謝愛敏,郎少磊,田春桃
(河南省三門峽市中心醫院醫學檢驗科,河南 三門峽 472000)
甲狀腺癌系內分泌常見惡性腫瘤,女性居多,進展緩慢,預后較好[1],但患者復發、轉移仍高達30%,且復發合并遠處轉移者預后通常較差[2]。故盡早預測其病情變化,以改善預后。中性粒細胞明膠酶相關脂質運載蛋白(NGAL)系由中性粒細胞激活后釋放的分泌性蛋白,早期被認為系急性腎損傷相關標志物[3]。近年來文獻報道,NGAL 不僅介導內皮功能受損、代謝異常,同時對血管生成、組織修復、機體免疫及細胞凋亡增殖產生重要影響[4]。已被證實NGAL 過表達可增加癌細胞鐵利用率,促進腫瘤細胞新生血管生成,可促成癌細胞增殖、浸潤及轉移[5]。甲狀腺球蛋白(TG)系由甲狀腺濾泡上皮細胞合成且存儲于濾泡內的大分子糖蛋白,為合成甲狀腺激素的重要前體蛋白甲狀腺炎癥、功能亢進及甲狀腺腫等病理改變皆可引起血TG濃度改變[6]。理論上,甲狀腺癌患者經甲狀腺切除及131Ⅰ清甲治療后殘留甲狀腺組織已去除,血清無法檢出TG表達或TG 濃度極低,故認為血TG濃度改變可預測甲狀腺癌復發、轉移[7]。抗甲狀腺球蛋白抗體(TGAb)已被證實系影響TG 含量的相關因素,TGAb 存在可能導致TG 檢測值高估或低估,影響TG 預測的準確性,一般認為TG 測量僅在TGAb 陰性時具有實際評估價值[8]。但TGAb 系針對TG 所產生的特異性抗體,或可能反映甲狀腺癌病灶組織的存在。基于此背景,本研究檢測甲狀腺癌術后患者血清NGAL、TG、TGAb,分析其與甲狀腺癌不良預后的關系,旨在探討三者用于預測甲狀腺癌手術預后的價值。
1 對象與方法
1.1 研究對象 收集2013年9 月-2017年2 月醫院收治的甲狀腺癌患者73例。入選標準:年齡>18歲;完成甲狀腺切除術或次全切;已完成131I 治療,甲狀腺攝碘率<1%;經病理證實為分化型甲狀腺癌,滿足分化型甲狀腺癌診治指南中標準[9];術后1 周內完成血清NGAL、TG、TGAb 檢測;完成術后3年隨訪調查;臨床、隨訪資料完善。排除標準:已發生遠處轉移甲狀腺癌;合并全身其他惡性腫瘤;凝血功能異常;直徑超過4 cm 頸部占位性病變;既往有頸部手術史;術中無法切除腫瘤組織或術中已發現腫瘤淋巴結或血管侵犯;全身131I 顯像檢查見異常放射性攝取≥1%;臨床資料不全。其中男27例,女46例;年齡18~72 歲,平均(46.2±10.2)歲;其中濾泡狀甲狀腺癌3例,乳頭狀甲狀腺癌70例;手術方式:全切54例,次全切19例;合并橋本氏甲狀腺炎14例。
1.2 方法 所有患者均完成甲狀腺全切或次全切術。術后4 周內停服左旋甲狀腺素片,至131I 治療完畢或131I 治療前停藥3~4 周,確保內源性促甲狀腺激素(TSH)水平≥30 μIU/ml。131I 治療前1日(高TSH 刺激狀態下)采集空腹外周血標本3~4 ml,室溫下離心,分離血清,采用德國西門子公司Immulite 2000型全自動電化學發光免疫分析儀及原裝配套試劑測定TG、TGAb水平;NGAL 檢測應用酶聯免疫吸附試驗,試劑盒購自美國R&D 公司;以上各指標檢測均嚴格按儀器及試劑使用說明操作。TGAb≥60 IU/ml 視為陽性;TG≥10 μg/L視為陽性。
1.3 隨訪 所有患者術后均至少隨訪3年。甲狀腺癌復發或轉移依據131I 全身單光子發射型計算機斷層顯像(見異常放射性濃聚灶)、TG 結果(TG≥10 μg/L,持續性增高)、超聲檢查(頸部超聲提示淋巴結增大)、胸部CT(肺內見異常高密度影,排除炎癥、間質、結核等病變)或病理隨訪證實[10]。并根據術后3年隨訪結果將患者分為預后良好組(n=31)與預后不良組(n=42)。
1.4 統計學方法 數據分析選擇SPSS 20.0 軟件,定性資料采用例數(%)描述,用χ2檢驗或Fisher確切概率分析,定量資料采用()描述,組間比較用t 檢驗,多因素Logistic 回歸分析篩查甲狀腺癌手術預后影響因子,各指標相關性分析應用Pearson相關分析,受試者工作曲線(ROC)分析NGAL、TG、TGAb 預測甲狀腺癌不良預后的價值,P<0.05 為差異有統計學意義。
2 結果
2.1 隨訪復發、轉移情況 73例甲狀腺癌患者術后隨訪3年發生復發/轉移31例(42.47%),分為不良預后組(n=31)與預后良好組(n=42),預后不良組合并毒性彌漫性甲狀腺腫所占比例高于預后良好組(P<0.05),其余各資料對比差異無統計學意義(P>0.05),見表1。
表1 甲狀腺癌手術不同預后患者基本情況對比()

表1 甲狀腺癌手術不同預后患者基本情況對比()
2.2 甲狀腺癌術后不同預后患者血清NGAL、TG、TGAb水平比較 甲狀腺癌術后預后不良組外周血NGAL、TG、TGAb水平均高于預后良好組(P<0.05),見表2。
表2 甲狀腺癌術后不同預后患者血清NGAL、TG、TGAb水平比較()
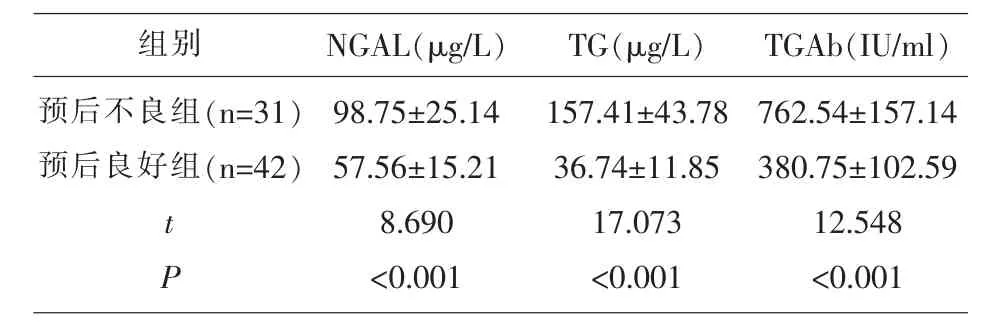
表2 甲狀腺癌術后不同預后患者血清NGAL、TG、TGAb水平比較()
2.3 甲狀腺癌手術患者外周血NGAL、TG、TGAb相關關系分析 甲狀腺癌手術患者外周血NGAL與TG、TGAb 均呈正相關(r=0.683、0.759,P<0.001),TG與TGAb 呈正相關(r=0.705,P<0.001),見圖1~圖3。
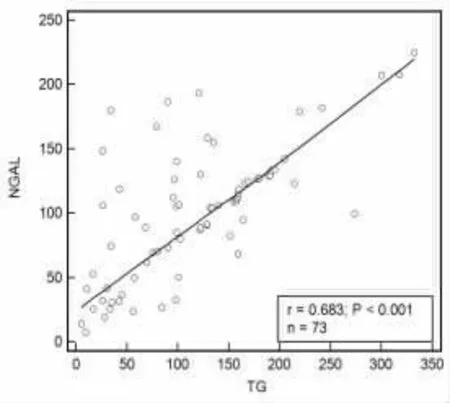
圖1 NGAL與TG 相關性分析散點圖
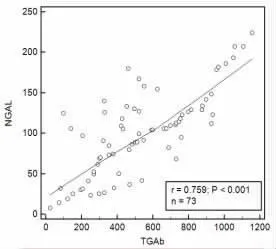
圖2 NGAL與TGAb 相關性分析散點圖
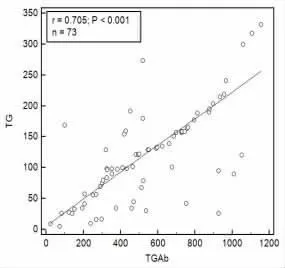
圖3 TGAb與TG 相關性分析散點圖
2.4 外周血NGAL、TG、TGAb 預測甲狀腺癌手術不良預后的價值 外周血NGAL、TG、TGAb對甲狀腺癌手術不良預后均有較好的預測價值,其中TGAb 價值最高,約登指數最大時,cut-off 值為679.96,曲線下面積(AUC)為0.892,敏感度、特異性分別為87.10%、90.48%;其次為TG,約登指數最大時,cut-off 值為137.01,AUC 為0.825,敏感度、特異性分別為64.52%、95.24%;NGAL 約登指數最大時,cut-off 值為89.79,AUC 為0.808,敏感度、特異性分別為64.52%、92.86%,見表3與圖4。
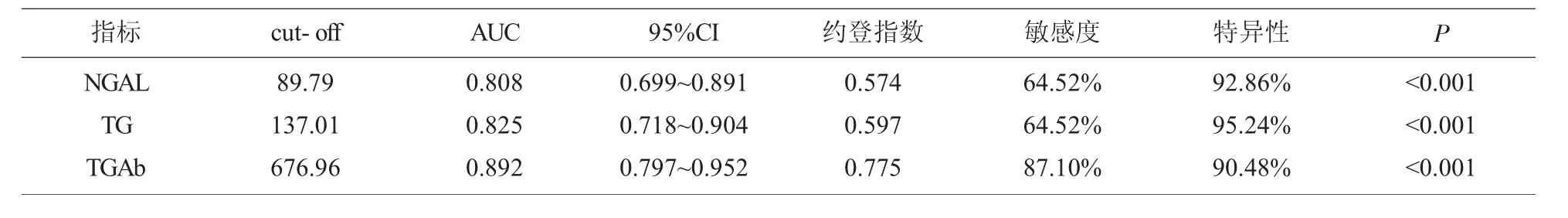
表3 外周血NGAL、TG、TGAb 預測甲狀腺癌手術不良預后的價值
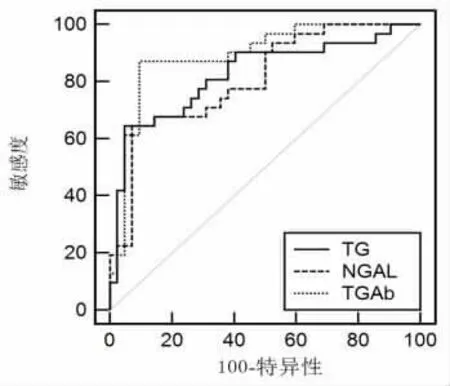
圖4 外周血NGAL、TG、TGAb 預測甲狀腺手術不良預后的價值
2.5 甲狀腺癌手術預后影響因素分析 納入單因素分析中有統計學意義數據毒性彌漫性甲狀腺腫(否=0,是=1)、NGAL(≤cut-off 值=0,>cut-off 值=1)、TG(≤cut-off 值=0,>cut-off 值=1)、TGAb(≤cut-off 值=0,>cut-off 值=1)賦值,進入多因素分析,結果顯示:合并毒性彌漫性甲狀腺腫及NGAL、TG、TGAb 異常上調均為影響甲狀腺癌手術預后的危險因素(P<0.05),見表4。
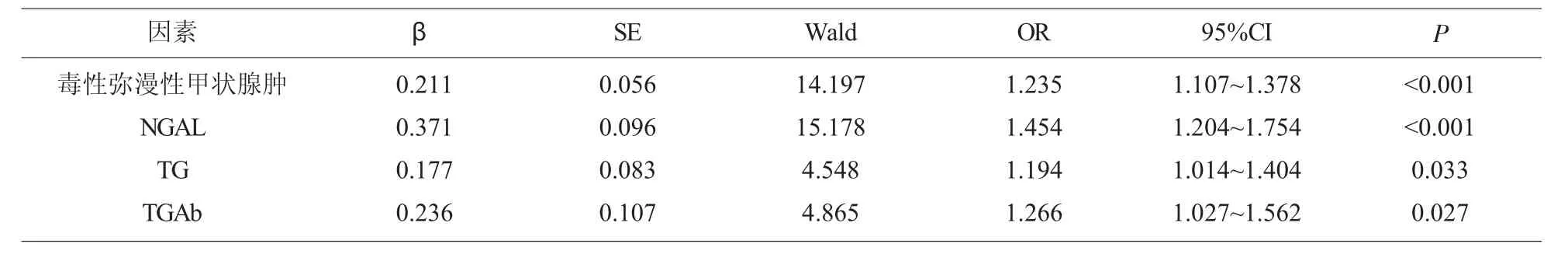
表4 甲狀腺癌手術預后影響因素分析
3 討論
分化型甲狀腺癌雖惡性程度低,但手術后仍有部分患者出現腫瘤復發或轉移[11]。前期報道認為,TSH水平、手術方式是甲狀腺癌預后影響因子[12,13]。也有學者認為,年齡與甲狀腺癌患者不良預后有關[14]。本研究進行單因素及多因素分析均未顯示年齡、TSH、手術方式與甲狀腺癌不良手術預后的關聯,推測以上因素對甲狀腺癌手術預后影響不大或無明顯影響或并非獨立影響因子,可能與其他因素協同共同影響甲狀腺癌手術預后。考慮原因為:本組納入大多數均為中年群體,基礎狀況較好,故年齡對手術預后影響較小;且大部分患者均應用甲狀腺全切術,手術方式無明顯區別,對預后無獨立影響。有學者表示,甲狀腺癌術后與131I“清甲前”TG水平對病灶緩解率及治療效果產生影響[15]。鄭款恒等[16]表示,術后伴TG 異常上升可能提示甲狀腺癌不良預后。本研究按甲狀腺癌患者隨訪3年預后情況進行分組,結果發現,預后不良組外周血TG水平明顯高于預后良好組,且進行多因素分析發現,高TG水平為影響甲狀腺癌術后預后的獨立危險因子,這與Maisel 等[17]研究結果相似,故推測TG在甲狀腺癌術后隨訪監測腫瘤復發或轉移中有重要作用,分析原因為:分化型甲狀腺癌患者術后及徹底完成“清甲”后外周血TG水平完全取決于轉移灶或復發灶的形成,無甲狀腺病理組織或殘余甲狀腺組織徹底根除后一般血清TG水平極低或無法檢測,體內無TG 來源,僅當出現轉移或復發時,甲狀腺病理組織存在,導致血清TG濃度異常上調。基于此結果,在“清甲”前TG水平較高的分化型甲狀腺患者我們建議適當增加131Ⅰ用藥劑量,確保術后殘存甲狀腺組織徹底清除,以預防甲狀腺癌復發、轉移。
TGAb 系機體針對TG 所釋放的自身一致性抗體,可反映甲狀腺組織或分化型甲狀腺病灶情況,異常增高常見于甲狀腺炎癥性疾病或甲狀腺良惡性腫瘤中[18]。雖TG水平已成為檢測分化型甲狀腺癌病灶殘留、腫瘤復發及轉移的依據[19]。但研究發現,TG 檢測受TSH、TGAb 等水平影響[20]。故有學者提出TGAb 有望替代TG 成為甲狀腺癌術后復發、轉移評估的依據[21]。在本研究中,采用同一種方法檢測TG、TGAb水平,以減少以上因素對TG水平的干擾,結果發現預后不良組TGAb 明顯高于預后良好組,且TGAb 上升趨勢與TG基本一致。同時我們發現,TGAb 為甲狀腺癌手術預后的影響因子,這與黃青清等[22]結論相符,我們考慮TGAb 異常高表達患者常可能合并腺體外侵犯、腫瘤直徑較大,危險度分層高,更易出現復發、轉移[23];且TG為TGAb的靶抗原,在致病因素作用小,TG 自甲狀腺濾泡內釋放進入血液,導致TGAb 生成,兩者結合后通過激活自然殺傷細胞,導致甲狀腺細胞受損,造成腫瘤復發、轉移。此外,我們還發現合并毒性彌漫性甲狀腺腫系影響甲狀腺癌手術預后的危險因素,我們分析可能與合并毒性彌漫性甲狀腺腫患者大多伴高代謝癥及甲狀腺腫大,自身免疫功能紊亂,惡性程度更高,更易出現復發、轉移。
NGAL 則為中性粒細胞活化后產生的分泌性蛋白,在胚胎發育、炎癥、免疫應答及趨化過程中均有關鍵作用[24]。且已被證實與多種腫瘤發生及進展有關[25,26]。安江宏等[27]研究發現,NGAL 有與鐵轉運蛋白相似的作用,NGAL 過表達可導致癌細胞內部鐵含量增加。而DNA 轉錄及氧化呼吸鏈能量傳遞等活動均由鐵離子參與,腫瘤細胞增殖及代謝旺盛皆可引起NGAL 濃度上升[28]。本研究發現,甲狀腺癌術后預后不良組外周血NGAL水平明顯高于預后良好組,且多因素分析證實NGAL 異常高表達為影響甲狀腺癌手術預后的獨立因子,得出NGAL對甲狀腺癌術后復發、轉移評估有重要價值。進行ROC 曲線分析發現,TG、TGAb、NGAL對預測甲狀腺癌手術不良預后均有較高的效能,提示NGAL 可作為甲狀腺癌不良預后預測的有效補充。且進行相關性分析發現,三者表達均存在明顯正相關關系,我們分析原因為:TG 作為甲狀腺癌關鍵腫瘤標志物,其特異性上升可能提示甲狀腺病灶存在,預示較高的甲狀腺癌復發、轉移風險,而其作為TGAb靶蛋白,特異性表達上調可引起TGAb 釋放增多,兩者共同作用可能進一步加重甲狀腺細胞受損,促成腫瘤復發、轉移,在此過程中NGAL 同樣發揮一定的驅動作用,促進癌細胞新生血管形成,導致甲狀腺癌復發、轉移,故三者表達可能存在一定的協同影響。但對其確切機制尚待進一步研究證實。
但本研究觀察時間短,病例數少,且為回顧性研究,可能存在一定的局限性。后續需進一步擴充樣本數量、延長隨訪時間,展開多中心研究進一步論證NGAL、TG、TGAb對甲狀腺癌術后復發、轉移的預測價值。

