基于盆腔基線MRI的直腸癌治療前生存風險預測
趙青 張紅梅
新輔助放化療(neoadjuvant chemoradiotherapy,NCRT)聯合根治性手術切除的多學科序貫綜合治療模式是目前針對局部進展期直腸癌(locally advanced rectal cancer,LARC:T3~4和/或N1~2期,M0)的標準治療方法。然而,不同患者的放化療敏感性不同[1],致使NCRT療效及遠期預后差別顯著,尤其對于LARC患者群體中占比最大的T3期患者[2],部分達到完全緩解(cCR)者可實現“等待觀察(wait-and-watch)”或局部切除,獲得良好預后;而部分療效差者則可能延誤手術時機或增加手術并發癥風險[3]。若能在治療前精準評估上述患者的生存風險,將有利于臨床醫師制定個體化治療及隨訪方案,改善預后。目前,磁共振成像(MRI)是直腸癌的最佳無創檢查方法[4]。既往本研究團隊已證實MRI可預測直腸癌患者的NCRT療效[5-7],MRI結合臨床及病理信息可預測患者生存情況[8],但NCRT的療效并不能完全反映患者遠期預后,且結合病理的生存預測只能在NCRT及手術之后進行,具有滯后性。
本研究將通過回顧T3期LARC患者基線盆腔MRI特征并進行生存分析,旨在探索影響該患者群體無進展生存(progress free survival,PFS)的治療前影像學獨立危險因素,為精準診療提供有效參考。
資料與方法
一、研究對象
本研究經所屬機構倫理委員會審核批準并免除知情同意。回顧2008年1月至2012年12月于中國醫學科學院腫瘤醫院經病理診斷為直腸癌的連續患者臨床資料,并進行生存隨訪。入組標準:(1)臨床診斷為T3期LARC,既往未接受過相關治療,進行NCRT及根治性手術切除;(2)NCRT前一個月內在影像診斷科進行基線盆腔MRI檢查;(3)臨床資料及隨訪資料可獲取。排除標準:(1)既往接受過直腸癌相關治療;(2)同期遠處轉移(術后6個月內)或合并其他惡性腫瘤;(3)未完成既定的NCRT治療或非根治性治療;(4)失訪。最終共納入符合標準的T3期LARC患者共157例。
二、治療
所有入組患者均接受新輔助放化療,放療總劑量50~55 Gy,分次劑量1.8~2.0 Gy,共25~28次。同步化療方案包括5-FU或卡培他濱。手術治療:患者在新輔助治療結束后6~8周接受根治性手術治療,其中腹腔鏡腹會陰聯合切除術102例,低位前切除術45例,Hartmann's術10例。
三、MR檢查方法
使用美國GE公司(Signa HDxt或Signa Excite HD)3.0 TMR掃描儀和8通道相控陣腹部線圈獲得MR圖像。檢查前2~3小時使用10~20 mL開塞露進行腸道清潔。為了減少腸蠕動或痙攣,對除外有禁忌證的患者在檢查前20~30分鐘行10 mg山莨菪堿肌肉注射。所有患者取俯臥位掃描,常規掃描序列包括(具體參數見表1):斜軸位、矢狀位及冠狀位T2加權快速自旋回波序列、盆腔軸位T1加權序列及T2加權脂肪抑制序列、彌散加權序列。

表1 盆腔MR掃描序列及參數
四 MR圖像分析
將患者的基線盆腔MR圖像從掃描系統傳輸至圖像存儲與傳輸(picture achiving and communication system,PACS)工作站,由兩名經驗豐富的胃腸道腫瘤影像醫師在未知病理及隨訪結果的情況下獨立評估影像特征并達成一致意見[9-12]。評價的MRI征象包括(評價標準見表2):腫瘤位置、最長徑、最大厚度、最大環周占比、T3亞分期、壁外靜脈血管侵犯(extramural venous invasion,EMVI)分級、直腸系膜筋膜(mesorectal fascia,MRF)受累情況、是否為黏液腺癌亞型以及區域/側方淋巴結轉移情況。

表2 MRI征象及評價標準
五、復查隨訪
所有患者常規在術后第一年每3個月、此后每6個月行臨床復查。每次復查包括臨床查體、血清學檢查、胸腹盆CT檢查,若出現可疑轉移病灶再進行針對性的MR/PET-CT檢查或活檢,以明確腫瘤進展(局部復發或遠處轉移)的診斷。記錄患者首次發現腫瘤進展的日期及死亡日期。本研究的隨訪終點為患者出現腫瘤進展或死亡,末次隨訪日期為2018年1月31日。
六、統計學方法
應用SPSS 22.0軟件進行統計學分析。PFS定義為手術至首次發現腫瘤復發或死亡的日期間隔。若患者在末次隨訪日期未出現復發或死亡,則認定為刪失(censored)病例。基于基線盆腔MR影像特征使用Kaplan-Meier(K-M)曲線法和Cox回歸法對患者進行生存分析(P<0.05認定為差異有統計學意義),對于連續變量使用中間值為界將其二分類。使用κ檢驗及組內相關系數(intraclass correlation coefficient,ICC)評價兩位醫師一致性。
結 果
一、患者基本資料
研究共納入符合條件的患者157例,其中男性101例,女性56例,平均年齡(55±12)歲。所有患者均行R0切除。患者的中位隨訪時間為6.6(3.5~9.8)年,5年內35例出現進展,其中23例為遠處轉移,12例為局部復發;隨訪期間共46例出現進展,其中32例為遠處轉移,14例為局部復發。5年及隨訪期間累積PFS率分別為77.7%和70.7%。圖1~2展示典型的MRI征象。
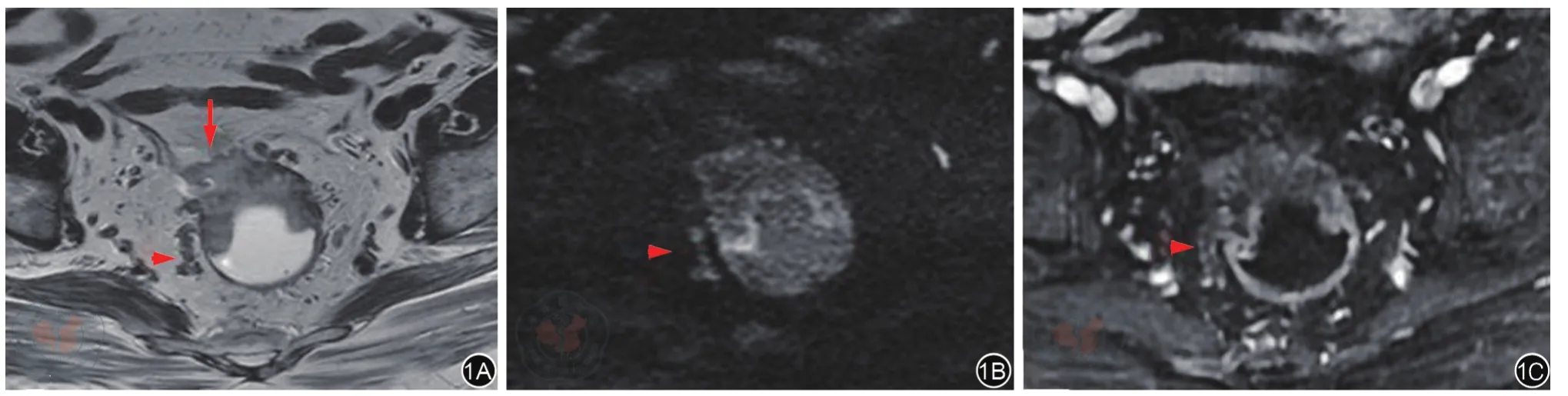
圖1 T3c期黏液腺癌,EMVI 4級,MRF(+)。箭頭指示腸壁外靜脈血管結節狀增粗,分別在斜軸位高分辨T2加權圖像(圖1A)表現為不均勻稍高信號,彌散加權圖像(圖1B)表現為高信號,T1加權增強掃描靜脈期圖像(圖1C)表現血管內充盈缺損,提示腸壁外血管受腫瘤侵犯,EMVI 4級。圖1A箭號提示腫瘤向前外侵累及MRF,表現為MRF凹陷、形態中斷。

圖2 T3b期非黏液腺癌,EMVI 3級,MRF(-)。箭頭指示腸壁外靜脈血管僵硬、光滑增粗,斜軸位高分辨T2加權圖像(圖2A)呈中高信號,T1加權增強掃描靜脈期圖像(圖2B)可見血管內充盈缺損,提示腸壁外血管受腫瘤侵犯,EMVI 3級。EMVI:壁外靜脈血管侵犯,MRF:直腸系膜筋膜
二、Kaplan-Meier生存曲線分析
兩位醫師評價MRI征象具有較高一致性(κ=0.750~0.885,ICC=0.938~0.971)。將患者年齡、性別及MRI征象結合隨訪的PFS信息進行K-M生存曲線分析(表3),結果顯示盆腔基線MRI所反映的腫瘤位置、腫瘤最長徑、最大厚度、最大環周比、T3亞分期、EMVI分級、MRF受累情況、黏液腺癌亞型及區域/側方淋巴結轉移情況等均不同程度影響患者的PFS。T3亞分期、EMVI分級及黏液腺癌亞型對PFS影響的K-M曲線見圖3。患者年齡及性別均對PFS無顯著影響。
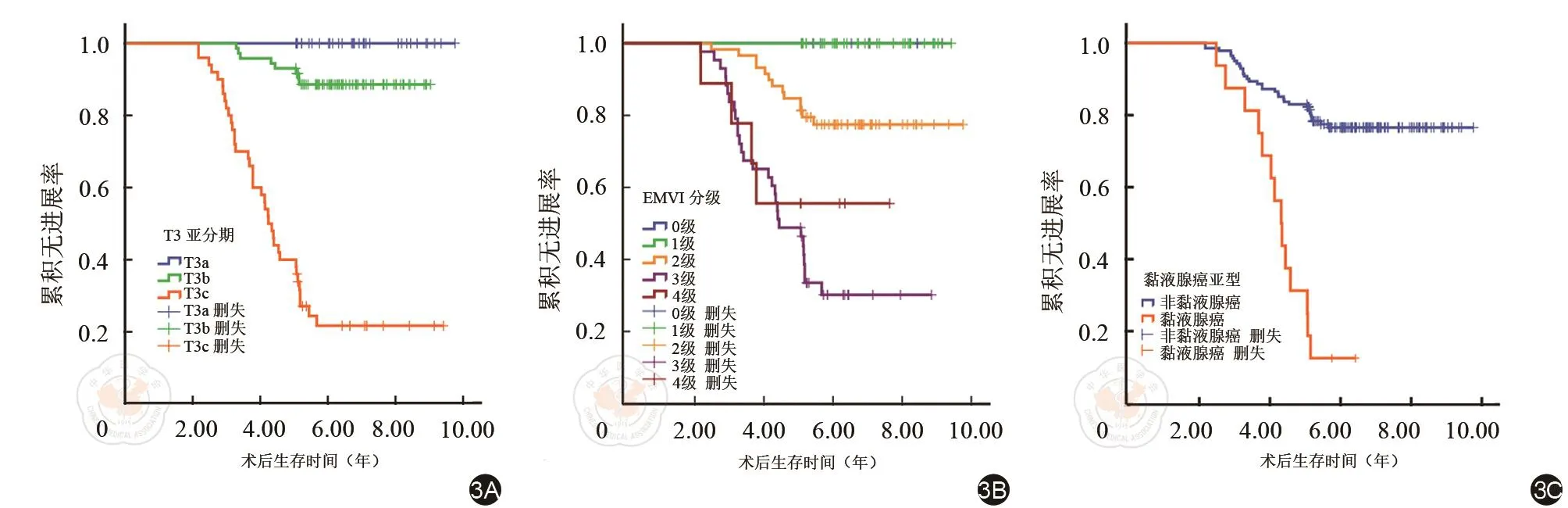
圖3 K-M曲線。T3亞分期(3A)、EMVI分級(3B)及黏液腺癌亞型(3C)對PFS影響的K-M曲線,HR分別為13.06,2.88和6.05,P值均小于0.001。EMVI:壁外靜脈血管侵犯,PFS:無進展生存期

表3 基于臨床信息及MR影像特征的Kaplan-Meier生存分析
三、Cox生存回歸
將K-M生存曲線分析中對PFS有顯著影響的MR特征進一步納入Cox回歸分析(表4),結果顯示在盆腔基線MRI評價的前述征象中,僅T3亞分期(HR=7.36,P<0.001),EMVI分級(HR=2.72,P<0.001)及黏液腺癌亞型(HR=2.36,P=0.024)是影響T3期LARC患者PFS的獨立危險因素。

表4 Cox多元回歸生存分析
討 論
本研究通過回顧157例T3期LARC患者的盆腔基線MRI并基于此進行生存分析,證實基線MRI所反映的腫瘤特征與患者的PFS高度相關,且T3亞分期、EMVI分級以及黏液腺癌亞型是影響患者PFS的獨立危險因素,其中以T3亞分期的相對風險比最高。因此我們認為應對T3期LARC患者進行全面精準的盆腔基線MRI評估報告,將有助于臨床醫師在治療前為患者進行危險分層,制定個體化治療隨訪方案,從而改善患者預后。
直腸癌T3亞分期是基于腫瘤壁外浸潤深度(extramural depth,EMD)定義的危險分層,目前國際上認可度較高的是歐洲腫瘤內科學會(ESMO)和北美放射學會(RSNA)兩種分期方法[9]。由于ESMO分期中將T3a定義為EMD<1 mm,影像評估誤差較大,因此本研究采用的是RSNA分期法(T3a:EMD<5 mm;T3b:EMD=5~10 mm;T3c:EMD>10 mm)[13]。既往多項研究表明MRI或病理診斷的T3亞分期對于直腸癌患者(NCRT或直接手術)的遠期生存均具有顯著影響[13-16],并且將EMD<5 mm視為良好預后的獨立影響因素。在本研究納入Cox多元回歸的10個MRI特征中,T3亞分期顯示出了最大的獨立不良預后效應,其原因可能在于腫瘤外侵范圍越大則代謝活性體積越大,潛在的神經血管侵犯越顯著,淋巴結轉移率及直腸系膜侵犯率越高。K-M曲線顯示T3c期患者的術后中位進展時間約為5年,多數T3b和T3c期患者術后出現腫瘤進展時間小于6年。因此對于T3b/c期的LARC患者,更積極的治療策略以及術后6年內更密切的復查隨訪尤為重要。本研究中T3a期患者5年PFS率為100%,提示這類“低風險”患者預后良好,對于無其他危險因素者可考慮單純手術治療,這也與歐洲MERCURY研究[16]結果相符。
基線MR-EMVI狀態對直腸癌患者生存的影響始終存在著爭議[17-20]。國內孫應實教授團隊[18]通過評價517例接受NCRT的局部進展期直腸癌患者的治療前后盆腔MRI特征并進行生存分析,證實基線MR-EMVI狀態是患者無局部復發、無遠處轉移生存,以及總生存的獨立危險因素。Smith等[17]證實直腸癌患者基線MR-EMVI狀態是其無復發生存的獨立危險因素,并推斷基線MR-EMVI分級可表征患者預后,不論其是否接受NCRT。Lee等[19]的研究中基線MR-EMVI并不影響直腸癌患者預后,但作者提出該回顧性研究結果可能受到其他臨床和病理因素混雜效應以及患者群體的異質性、MR圖像質量差異影響。本研究將EMVI狀態進一步細化為5個評價等級[17],0~2級相當于陰性,3~4級相當于陽性。結果顯示基線MR-EMVI分級是T3期LARC患者PFS的獨立危險因素,這可能與腫瘤微環境缺氧所致的NCRT敏感性下降、血管重構所致的內皮生長因子高表達以及腫瘤細胞早期經循環擴散有關[18]。K-M曲線顯示MR-EMVI陽性患者的中位進展時間約為4~5年,6年內MR-EMVI 2級患者進展率約20%。因此對基線MREMVI陽性及可疑陽性患者(MR-EMVI 2~4級)應予以更積極的治療和更密切的隨訪。
黏液腺癌是直腸癌的一種組織學亞型,腺癌組織中含有大量細胞外黏液,并超過腫瘤成分的50%,MRI診斷準確率高[10],相比于活檢具有便捷無創的優點。既往研究證實該亞型對于NCRT敏感性差,療效不顯著[21-22]。但其對于患者的生存影響,目前結論尚不統一[23-24]。本研究結果支持基線MRI診斷的直腸黏液腺癌亞型是影響T3期LARC患者PFS的獨立危險因素。其原因可能在于黏液腺癌亞型抑癌基因P53表達受抑制,更容易出現微衛星不穩定及KRAS基因突變[23],確診時通常有更高的T/N分期[24],且粘多糖的免疫干擾效應有助于腫瘤細胞擴散,而黏蛋白的分子屏障效應則阻礙化療藥物與腫瘤接觸導致化療不敏感[23]。我們推薦對盆腔基線MRI進行標準化報告,在既往常規的T分期及EMVI狀態描述中進一步細化T3亞分期和EMVI分級,并評估是否為黏液腺癌亞型。
本項研究所涉及的其他基線MR特征均未在多因素分析中顯示出獨立的預后影響,可能與各危險因素之間的混雜效應有關。直腸癌體積是腫瘤負荷的反映,既往研究證實腫瘤代謝體積越大越易發生血行轉移[25]。本研究中表征腫瘤體積的最長徑、最大厚度及環周比例均未在多因素回歸中顯示獨立的生存效應,除了混雜因素影響,可能還與直腸空腔結構形態多變、一維徑線代表性不足有關。此外,NCRT可能削弱MRF受累對腫瘤復發及遠期生存的影響(所有患者均為R0切除);而轉移淋巴結的影像診斷標準不統一且準確率較低[4],可能是本研究中淋巴結轉移評價不具有顯著意義的原因。
本研究的局限性在于,單中心回顧性研究可能對結果造成偏倚,隨訪時長未達到患者的中位進展時間。未來我們將在此基礎上開展多中心前瞻性研究,增加入組樣本,延長隨訪時間,并構建生存預測模型。
綜上所述,本研究證實盆腔基線MRI特征可反映T3期LARC患者的生存預后,其中T3亞分期、EMVI分級以及黏液腺癌亞型是影響患者PFS的獨立危險因素。我們推薦對T3期LARC患者進行高質量的盆腔基線MR檢查及全面精準的分析報告,為臨床醫師療前生存危險分層提供參考,促進個體化診療,改善患者預后。

