葡萄糖酸一步法制備蝦殼葡萄酸鈣
肖 曉,符漢麟,陳蓓蓓,莫玉劍,吳育廉
(廣東海洋大學:1.化學與環境學院/ 2.濱海農業學院,廣東 湛江 524088)
對蝦養殖業作為我國水產養殖的代表產業之一,也是我國出口水產品的第一產業。為便于保鮮運輸,對蝦多以無殼蝦仁供應全球市場,從而產生大量蝦殼廢棄物[1-2]。對蝦蝦殼中含有多種活性成分,目前其利用方式主要包括兩種,一是直接粉碎作為動物飼料添加劑、魚餌、肥料等[3];二是通過精加工獲得一些高附加值產品,如甲殼素、殼聚糖等,被廣泛用于食品、醫學、保健品等領域[4-6]。目前工業上多用酸堿法交替法處理蝦殼制備甲殼素、殼聚糖,使得大量的鈣質以廢水形式排放,對生態環境和民生健康造成嚴重威脅,同時也產生巨大的資源浪費[7-8]。鈣作為動物體內必需礦物元素之一,對動物生長發育具有重要的生理作用,而蝦殼含有約20%的活性鈣,可以作為優良的前驅體來制備鈣營養補充劑[7]。因此,有效利用蝦殼中的鈣質成為蝦殼資源化利用的關鍵。
葡萄糖酸鈣具有高溶解性、良好生物相容性和安全無毒等優點,是國際公認的一種優質鈣源[9],在醫藥、食品等行業具有廣泛應用,如作為鈣營養劑添加在飲料、谷類產品中[10]。同時,葡萄糖酸鈣還是一種臨床常用藥物,多用于治療骨質疏松、皮膚過敏等病癥[11]。目前,葡萄糖酸鈣制備方法包括電解法、溴化法和發酵法、金屬催化合成法、酶法等[12-13],其中工業生產主要以黑曲霉發酵法為主。另外,也有研究者以雞蛋殼或貝殼作為鈣源來制備葡萄糖酸鈣[6]。黑曲霉發酵法工藝比較復雜、操作條件相對苛刻;利用雞蛋殼或被貝殼制備葡萄糖酸鈣則需要進行高溫煅燒,一定程度上造成能源浪費。目前尚未見采用葡萄糖酸與蝦殼反應一步法制備葡萄糖酸鈣的研究報道。因此,開展蝦殼的葡萄糖酸脫鈣工藝研究可為葡萄糖酸鈣的制備提供新思路和一定的理論借鑒,同時也對提高蝦殼的資源化利用具有重要的現實意義。
1 材料與方法
1.1 材料與儀器
新鮮蝦殼取自廣東泰聯海洋食品有限公司對蝦加工生產車間,用水沖洗干凈,70 ℃烘干破碎,后過孔徑0.150 mm 篩,混勻備用。葡萄糖酸、鹽酸、氨水、氯化銨、鈣指示劑、乙二胺四乙酸二鈉(EDTA-2Na)、碳酸鈣等均為分析純。AUY220 型電子分析天平,日本島津;PHSJ-3F 雷磁酸度計,上海儀電科學儀器股份有限公司;SHZ-D(III)鼓風干燥箱,鞏義市瑞德儀器設備有限公司;SHA-B 水浴恒溫振蕩器,杭州旌斐儀器科技有限公司;Thermo Scientific Nicolet iS5 傅立葉變換紅外光譜儀,美國賽默飛世爾科技公司;vario MACRO cube元素分析儀,德國元素分析系統公司。
1.2 實驗方法
1.2.1蝦殼脫鈣實驗 取一定量的蝦殼粉置于錐形瓶中,按照一定料液比加入葡萄糖酸溶液,并將錐形瓶置于水浴恒溫振蕩器內,在預定溫度條件下處理一段時間,過濾,洗滌濾渣,取濾液測定鈣離子含量,計算脫鈣率。
1.2.2單因素實驗設計 以脫鈣率為評價指標,分別研究葡萄糖酸濃度、反應溫度、反應時間、料液比對蝦殼脫鈣效果的影響,具體條件如下。
葡萄糖酸濃度:控制反應溫度為30 ℃,料液比1∶20 (g/mL),反應時間2.0 h,葡萄糖酸的濃度為0.1、0.2、0.3、0.4 和0.5 mol/L;
反應溫度:濃度為0.4 mol/L,料液比1∶20(g/mL),反應時間2.0 h,反應溫度為25 ℃、30 ℃、35 ℃、40 ℃和45 ℃;
反應時間:控制葡萄糖酸濃度為0.4 mol/L,料液比1∶20 (g/mL),反應溫度為30 ℃,反應時間為0.5、1.0、1.5、2.0 和2.5 h;
料液比:控制葡萄糖酸濃度為0.4 mol/L,反應溫度為30 ℃,反應時間為2.0 h,料液比為1∶5、1∶10、1∶15、1∶20 和1∶25 (g/mL)。
1.2.3均勻實驗設計 在單因素實驗基礎上,選取A1(料液比)、A2(反應溫度)、A3(反應時間)、A4(酸濃度)為實驗因子,以脫鈣率為指標,采取擬水平均勻設計U10*(54)進行實驗,實驗結果用DPS 7.05 軟件進行分析處理,得到對應的線性回歸方程,預測最佳反應條件,并對得到最佳反應條件進行實驗驗證。
1.2.4脫鈣率的測定
1.2.4.1蝦殼總鈣含量的測定 參考《GB5009.92-2016 食品安全國家標準 食品中鈣的測定》檢測樣品中的鈣含量[16],具體操作:將一定量預處理的蝦殼粉加入到1.0 mol/L 的鹽酸溶液中,控制料液比為1∶20,在室溫條件下反應24 h 后,過濾、洗滌濾渣,將濾液轉入100 mL 容量瓶定容,取一定體積樣液EDTA-2Na 標準溶液(0.01 mol/L)進行滴定,樣品的總鈣含量按式(1)進行計算。
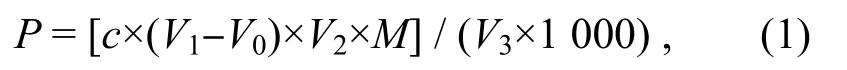
其中P為樣品中的總鈣質量(單位:g);c為EDTA-2Na 摩爾濃度(單位:mol/L);V1為滴定樣液所消耗的EDTA-2Na 的體積(單位:mL);V0為滴定空白樣品所消耗的EDTA-2Na 的體積(單位:mL);V2為樣液總體積(單位:mL);V3為滴定所用樣液體積(單位:mL);M為EDTA-2Na 的摩爾質量(單位:g/mol)。
1.2.4.2鈣離子標準曲線的測定 參考李文風等[17]測試方法:1)稱取經干燥預處理的2.000 g 碳酸鈣置于150 mL 燒杯中,緩慢加入3 mol/L 的鹽酸溶液進行溶解,轉入250 mL 容量瓶定容;2)準確吸取0.00、1.00、2.00、3.00、4.00、5.00 mL 溶液至250 mL 錐形瓶中,用去離子水定容至100 mL,加入10 mL 氨水緩沖液,調節pH 約等于10,后加入少量鉻黑T 指示劑,搖勻后用EDTA-2Na 標準溶液(0.01 mol/L)滴定至溶液變藍色,記錄消耗的EDTA-2Na體積;3)以消耗的EDTA-2Na 體積為橫坐標,鈣離子濃度為縱坐標繪制鈣離子標準曲線,擬合得到線性回歸方程。
1.2.4.3脫鈣率的計算 稱取與1.2.4.1 中相同質量的蝦殼粉,用葡萄糖酸進行處理,取一定體積脫鈣液按照1.2.4.2 的滴定操作得到消耗的EDTA-2Na體積,根據鈣離子標準曲線計算鈣離子濃度,后按公式(2)計算脫鈣率:
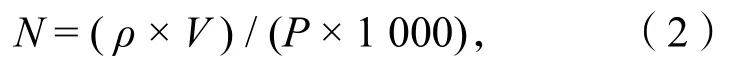
其中,N為脫鈣率(單位:%);ρ為鈣離子質量濃度(單位:g/L);V為脫鈣液總體積(單位:mL);P為樣品的總鈣質量(單位:g)。
1.2.5數據處理 所有實驗至少重復3 次,根據3次實驗結果計算對應的標準偏差,以上所有指標以均值或均值±標準偏差進行表示。
2 結果與討論
2.1 蝦殼的總鈣量
經測定,蝦殼的總鈣含量比例約為20.0%,略高于文獻報道的鈣含量(18.58%)[18]。這可能是由于來源或者生長周期不同的對蝦其蝦殼中鈣含量存在一定的差異。
2.2 鈣離子標準曲線
圖1 為鈣離子標準曲線,其對應線性回歸方程為:?=0.003 6x+0.000 3,其中y為鈣離子質量濃度(單位:g/L);x為消耗的EDTA-2Na 體積(單位:mL)。線性相關數R2=0.999 8,表明消耗的EDTA-2Na 體積與脫鈣液中的鈣離子濃度存在良好的線性關系。
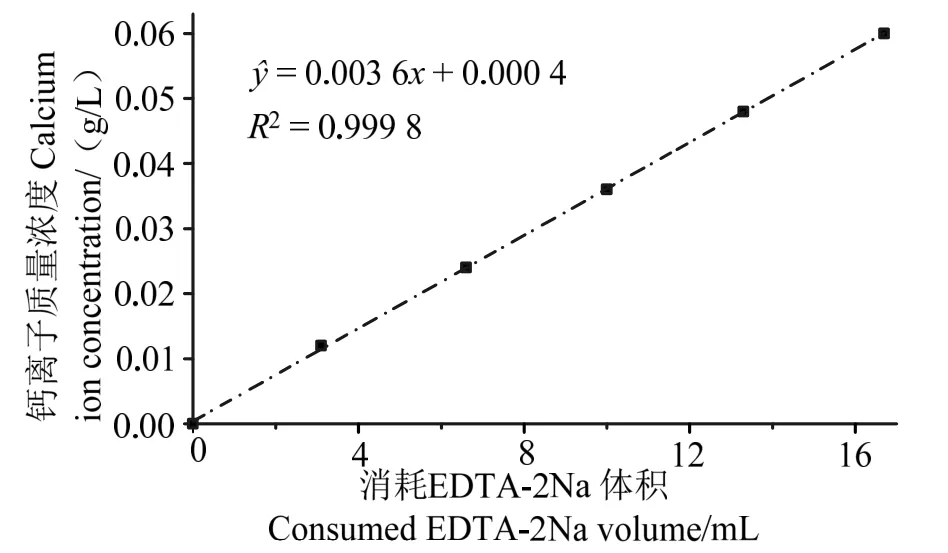
圖1 鈣離子標準曲線Fig.1 Calcium ion standard curve
2.3 單因素實驗的蝦殼脫鈣效果
2.3.1葡萄糖酸濃度對蝦殼脫鈣效果的影響 由圖2 可知,脫鈣率隨著葡萄糖酸濃度的增加迅速上升,當葡萄糖酸濃度為0.4 mol/L 時,脫鈣率達到91.21%,是低濃度(0.1 mol/L)的4.5 倍,表明葡萄糖酸濃度對蝦殼脫鈣具有顯著影響作用。這主要歸因于濃度增加,提高了整個酸浸體系中反應底物的濃度,促進葡萄糖酸鈣的生成,進而提升了脫鈣效率。但當酸濃度增加到0.5 mol/L 時,蝦殼脫鈣率基本不發生變化,反應趨于平衡,因此選取葡萄糖酸濃度為0.4 mol/L 比較適合。
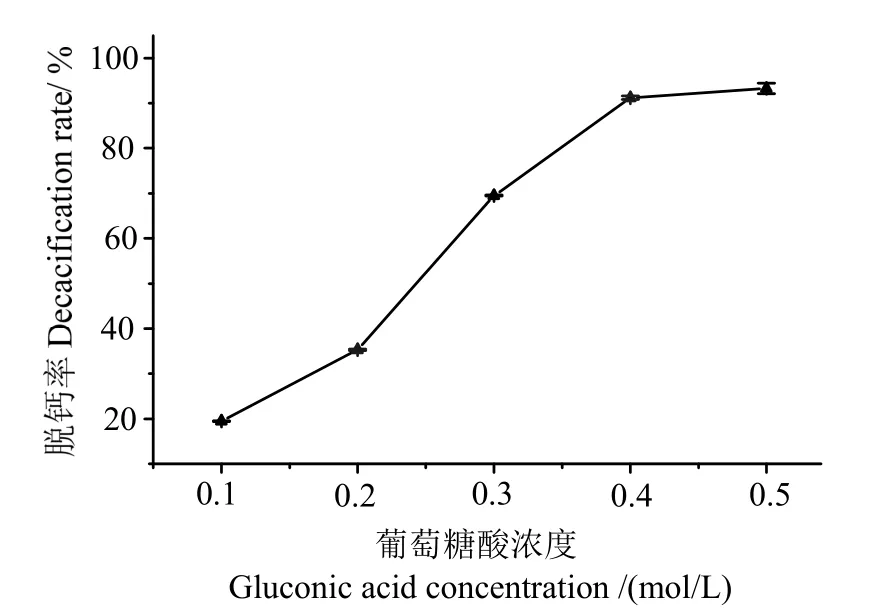
圖2 葡萄糖酸濃度對蝦殼脫鈣效果的影響Fig.2 Effects of gluconic acid concentration on decalcification rate
2.3.2反應溫度對蝦殼脫鈣效果的影響 由圖3 可知,在25~ 30 ℃范圍內,蝦殼脫鈣率隨著溫度上升而增加。在30 ℃時,蝦殼脫鈣率為91.21%;而當溫度超過30 ℃,脫鈣率基本不發生太大變化。這主要由于較高溫度,會降低CO2的溶解度,大量上升氣泡會黏附蝦殼粉顆粒浮到表面,進而影響葡萄糖酸的脫鈣效果。綜合考慮脫鈣率和能耗,確定最佳蝦殼脫鈣反應溫度為30 ℃。
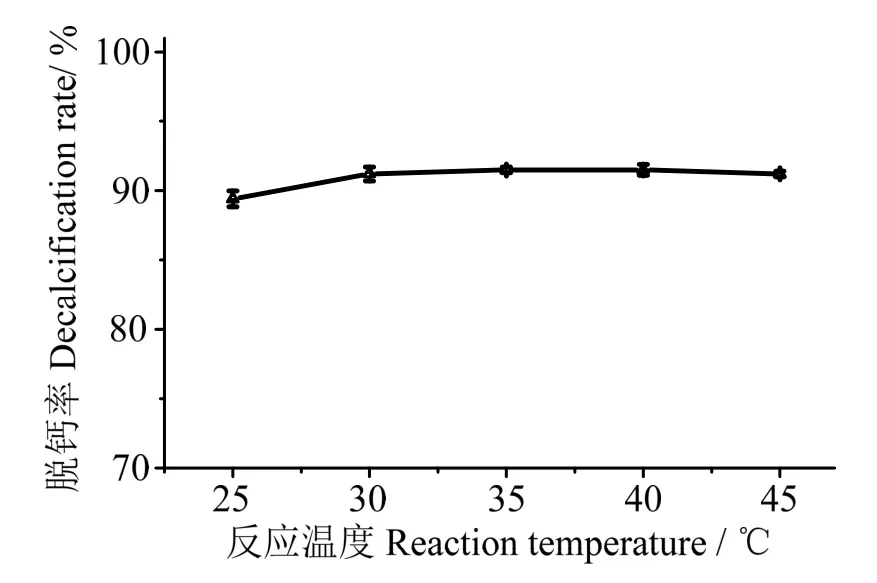
圖3 反應溫度對蝦殼脫鈣效果的影響Fig.3 Effects of reaction temperature on decalcification rate
2.3.3反應時間對蝦殼脫鈣效果的影響 由圖4 可知,在2.0 h 以內,脫鈣率隨著反應時間延長而迅速增大。當反應時間為2.0 h,對應脫鈣率為91.21%;而當反應時間繼續延長至2.5 h,脫鈣率僅增長0.17%。這主要是因為增加反應時間,有利于葡萄糖酸分子與蝦殼中鈣組分進行充分反應,產生葡萄糖酸鈣。但當反應達到一定時間后,蝦殼的鈣組分濃度大大減低,葡萄糖酸鈣的生成效率逐漸減小,最后脫鈣率趨于穩定。因此,選擇2.0 h 作為最佳脫鈣反應時間。
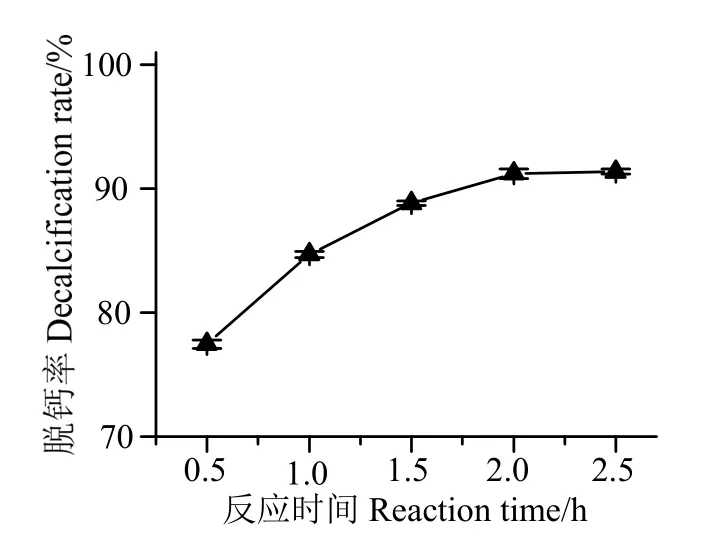
圖4 反應時間對蝦殼脫鈣效果的影響Fig.4 Effects of reaction time on decalcification rate
另外,蝦殼的酸浸脫鈣反應是典型的固液反應,其中碳酸鈣組分與葡萄糖酸的反應較迅速,鈣的溶出動力學主要受擴散傳質的控制,擴散傳質是產生的Ca2+通過液膜層或固膜層。如果酸浸脫鈣反應受固膜擴散控制,蝦殼脫鈣率和反應時間的關系可以用浸出動力學公式:1 -(2/3)N–(1–N)2/3=kt來表示[19],其中N為蝦殼脫鈣率,k為反應速率常數,t為反應時間。而鈣的溶出動力學可以用收縮核模型理論進行描述,即在酸浸脫鈣過程中,由于葡萄糖酸作用,使得固體鈣組分以Ca2+形式從濃相(固相)擴散到淡相(液相)中,該擴散過程發生在固液兩相界面。
以1-(2/3)N-(1-N)2/3對反應時間t作圖,鈣的固膜擴散收縮核動力學模型如圖5 所示。動力學數據表明,葡萄糖酸的蝦殼脫鈣過程符合固膜擴散收縮核動力學模型,對應的擬合方程線性相關性高,相關系數R2=0.942。
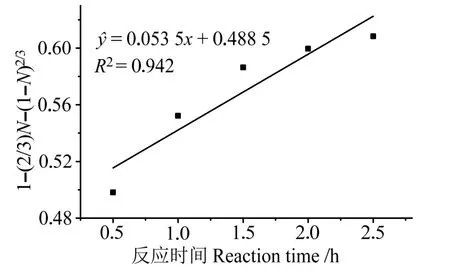
圖5 蝦殼脫鈣的固膜擴散收縮核動力學模型Fig.5 Solid film diffusion shrinkage core dynamics model for decalcification of shrimp shells
2.3.4料液比對蝦殼脫鈣效果的影響 由圖6 可知,當料液比小于1∶20 時,脫鈣率隨著料液葡萄糖酸與蝦殼粉的接觸面積,從而改善了脫鈣效果。當料液比超過1∶20 時,脫鈣率反而有所減低,可能是蝦殼中鈣組分已對葡萄糖酸達到飽和狀態,過高的料液比無法有效提升蝦殼脫鈣效果[20]。因此確定最佳料液比為1∶20。
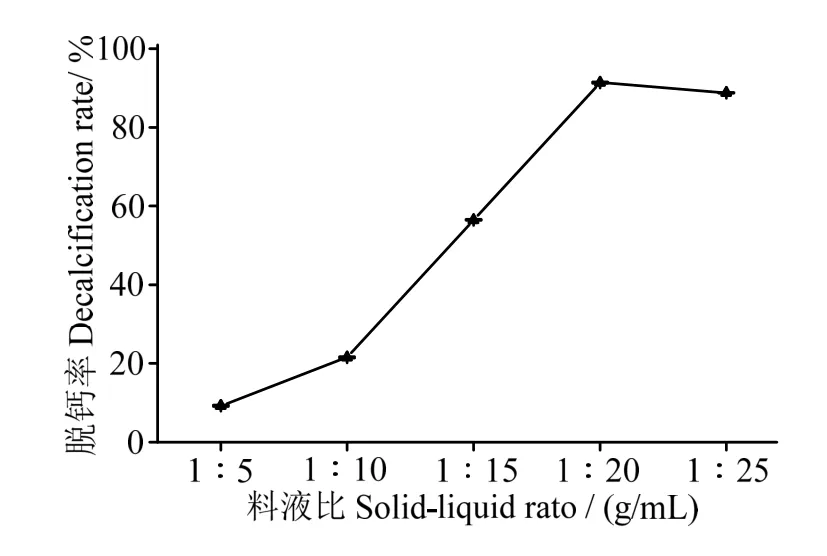
圖6 料液比對蝦殼脫鈣效果的影響Fig.6 Effects of solid-liquid ratio on decalcification rate
2.4 均勻設計實驗的蝦殼脫鈣效果
均勻設計實驗是一種集數論原理和多元統計的多因素多水平的實驗設計方法,與全面實驗和正交實驗設計相比,其最大優點是通過少數實驗次數完成整個實驗周期[21-22]。本實驗涉及4 個因素,每個因素有5 個水平,選用均勻設計實驗U10*(54),僅需要10 組實驗;若采用正交實驗,則需要用L25(54)表,做25 組實驗。通過DPS 7.05 軟件對均勻設計實驗數據進行線性回歸分析,依據回歸方程對脫鈣率進行預測,確定最佳理論反應條件。
為綜合考慮各因素對蝦殼脫鈣效果的影響,在單因素實驗的基礎上進行均勻實驗設計。選取推薦用表選擇第1、3、4、5 列,形成擬水平設計表,為方便擬合,對料液比進行換算,如表1 所示。從均勻實驗結果可知,實驗4(A1=0.05 g/mL,A2=25 ℃,A3=1.5 h,A4=0.5 mol/L)的脫鈣率最高,為92.1%。通過DPS 7.05 軟件分析,得到多元一次線性回歸方程:
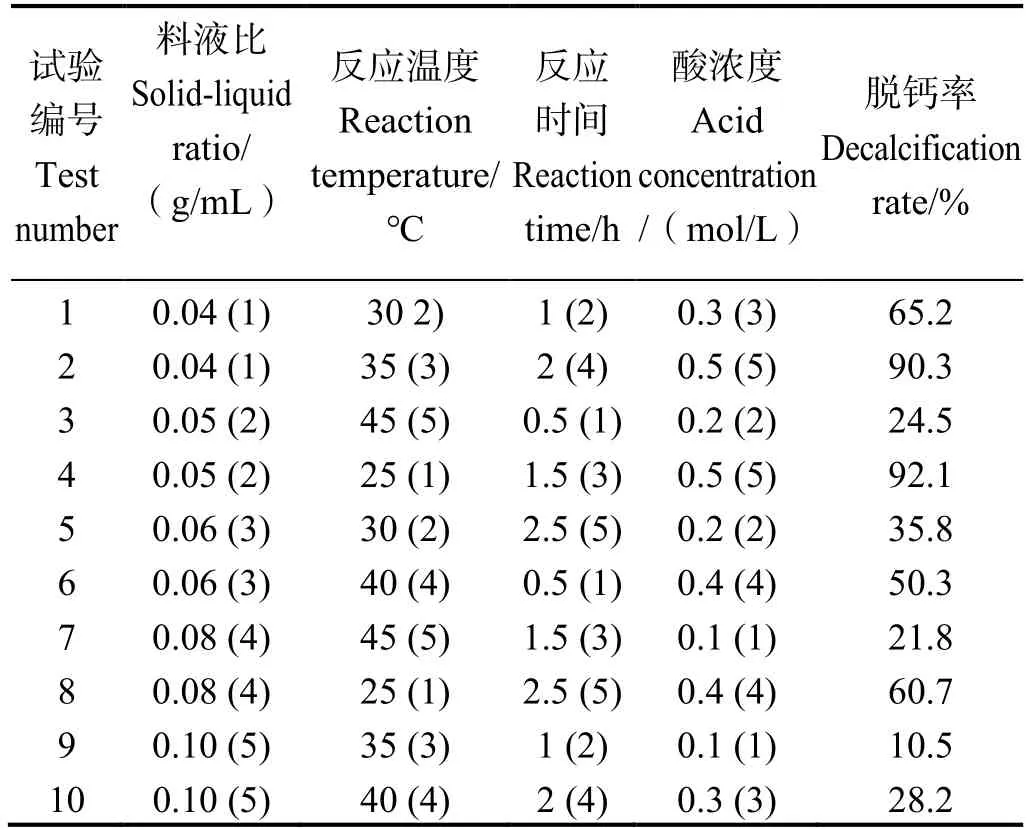
表1 均勻設計試驗結果Table 1 Uniform design tests results
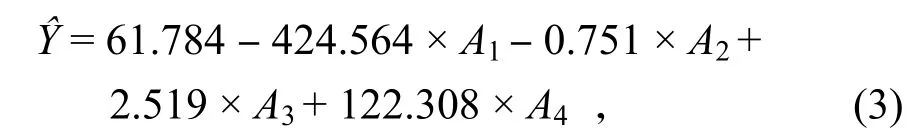
經方差分析得知,F=20.80、P=0.003 1 < 0.01、復相關系數R為0.966 4,回歸關系極顯著,表明A1(料液比)、A2(反應溫度)、A3(反應時間)、A4(酸濃度)與蝦殼脫鈣率呈極顯著的回歸關系。
從回歸方程可知,A1、A2的系數為負,表明實驗指標隨著因素A1、A2的增加而減小;而A3、A4的系數為正,表明實驗指標隨著因素A3、A4的增加而增大。因此,在確定最佳理論工藝參數時,因素A1、A2應取偏下限,即料液比為0.04(1∶25)g/mL,反應溫度為25 ℃;因素A3、A4應取偏上限,即反應時間為2.5 h、酸濃度為0.5 mol/L,將以上各值帶入式(3),得到Y=93.45%,這一結果要優于表1 中10 個實驗結果。另外,從公式(3)可知,A1、A2、A3、A4的系數分別為-424.564、-0.751、2.519和122.308,其中A1、A3、A4具有較大系數,表明A1、A3、A4的變化對Y值影響較大,為主要影響因素,這與2.3 的單因素實驗結果是一致的;A2的系數較小,表明A2的變化對Y值影響較小,為次要影響因素,與圖3 的結果一致,進一步驗證了多元一次線性回歸方程的可靠性。
2.5 不同反應條件對蝦殼脫鈣效果影響對比
根據式(3)得到的最佳反應條件,與單因素確定的最佳條件和均勻設計實驗的最佳條件進行驗證實驗對比,結果如圖7 所示。可以看出,單因素最佳條件1(0.05 g/mL、30 ℃、2.0 h、0.4 mol/L)下的蝦殼脫鈣率為(91.21 ± 0.40)%,均勻設計實驗最佳條件2(A1=0.05 g/mL,A2=25 ℃,A3=1.5 h,A4=0.5 mol/L)下的蝦殼脫鈣率為(92.1 ± 0.21)%,而由回歸方程預測到的最佳反應條件3 的脫鈣率則高達(93.78 ± 0.36)%,其結果優于單因素考察最佳條件和均勻設計實驗最佳條件,同時該實驗結果也優于已有文獻報道。如于會國等[23]利用乳酸桿菌發酵對蝦殼脫鈣,選取發酵溫度37 ℃,反應時間72 h,蝦殼的脫鈣率僅為80.35%;李明華等[18]在超聲波輔助條件下優化了檸檬酸脫鈣工藝,選定溫度50 ℃,反應時間 1.5 h,對應的蝦殼脫鈣率為93.85%。通過對比反應條件可知,本研究采用該線性回歸模型優化的工藝條件相對溫和,反應時間適中,操作簡單,更具有實用價值。
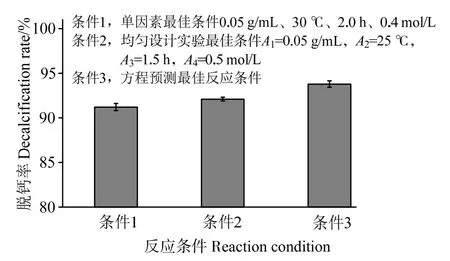
圖7 不同反應條件對蝦殼脫鈣效果的影響Fig.7 Effects of different reaction condition on decalcification rate
2.6 葡萄糖酸鈣的紅外光譜圖
為進一步驗證葡萄糖酸直接蝦殼脫鈣一步法制備葡萄糖酸鈣可行性,將制得脫鈣液經冷凍干燥后,與溴化鉀混勻壓片進行紅外光譜分析,結果如圖8(a)所示。其中3 200~ 3 400 cm-1處較寬的吸收峰對應—OH 的伸縮振動吸收;2 938 cm-1為—CH2—的伸縮振動吸收峰;1 596 cm-1、1 437 cm-1為羧酸鹽的—COO-的伸縮振動吸收峰;1 140 cm-1、1 051 cm-1為C—OH 的伸縮振動吸收峰。通過圖譜對比,制得樣品的譜圖與葡萄糖酸鈣標準紅外譜圖[10](圖8(b))是一致的。此外,通過元素分析結果(表2)可知,葡萄糖酸鈣的各元素比例與理論值基本一致,表明制備的葡萄糖酸鈣具有較好的純度,這也側面證明了通過葡萄糖酸直接蝦殼脫鈣一步法制備葡萄糖酸鈣是可行的。
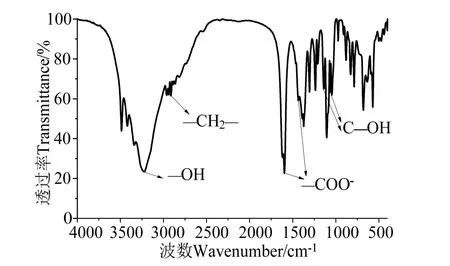
圖8 樣品和葡萄糖酸鈣的紅外光譜Fig.8 The infrared spectrum of as-made sample and calcium gluconate
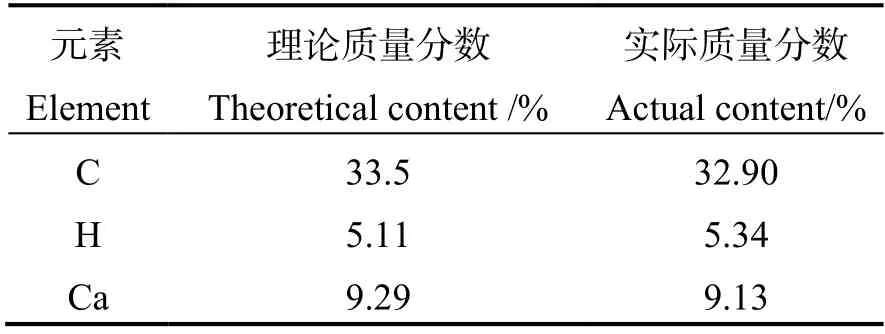
表2 樣品與葡萄糖酸鈣樣品的理論元素含量對比Table 2 Elemental analysis of as-made sample and calcium gluconate
3 結論
葡萄糖酸對蝦殼具有良好的脫鈣效果,通過單因素實驗及均勻設計實驗,獲得蝦殼脫鈣的最佳反應條件,即料液比為1∶25 (g/mL),葡萄糖酸濃度為0.5 mol/L,在25 ℃反應2.5 h,蝦殼的脫鈣率高達(93.78 ± 0.36)%,該脫鈣過程符合固膜擴散收縮核動力學模型。此外紅外結果和元素分析結果也表明,利用葡萄糖酸一步法制備的葡萄糖酸鈣具有較好的純度。該工藝反應條件溫和、操作簡便、節能低耗,比較符合綠色環保的理念,可為開展蝦殼的資源化利用提供新思路和理論借鑒。

