胃癌術后營養不良風險預測模型的構建及驗證
楊眉 余家密 林雅 焦永娟 青菁
胃癌是世界第五大常見惡性腫瘤,第三大癌癥相關性死亡原因[1]。根治性切除手術是治療胃癌的主要方式。胃癌術后患者平均體重較術前下降10%~20%,營養不良的狀況甚至需要長達1年才恢復[2]。術中消化道重建引起機體儲存食物功能下降,進而影響消化吸收功能,導致進食量減少、體重減輕和營養狀況惡化[3]。有研究表明,營養不良引起胃癌患者抵抗力減弱、組織愈合能力下降,并且增加腫瘤復發、降低患者3年無病生存率和總生存 率[4,5]。本研究探討胃癌術后3 個月出現營養不良的危險因素并建立預測模型,以輔助醫護人員盡早識別高危患者,并制定相應的強化營養措施。
1 材料與方法
1.1 一般資料選取2017年7月~2019年3月在我院手術治療的胃癌患者263 例。納入標準:①病理明確為胃腺癌;②施行根治性手術;③配合良好、溝通正常、可完成調查問卷表;④臨床病理資料完整,定期復查,隨訪可靠。排除標準:①因梗阻、出血等原因急診手術者;②合并其他部位惡性腫瘤者;③術后3 個月內死亡者。
1.2 評價標準營養不良的診斷標準尚未統一,患者主觀整體評估(Patient-generated subjective globe assessment,PG-SGA)是美國營養師協會和中國抗癌協會腫瘤營養專業委員會推薦用于評估腫瘤患者營養狀況的量表,該量表分成三個等級:SGA-A 級(營養良好)評分為0~3 分;SGA-B 級(中度營養不良)評分為4~8 分;SGA-C 級(嚴重營養不良)評分>8 分。得分≥4 分為營養不良,<4 分為非營養不良[6]。由于胃癌術后3 個月是患者發生營養不良的高峰期,且患者常在此期間進行常規術后腫瘤復查[4],因此,本研究選擇該時間段評估患者的營養狀況。
1.3 統計學方法采用SPSS 22.0 統計學軟件進行數據分析,計數資料以例數表示,單因素分析采用卡方檢驗,并將有統計學意義的參數采用二元Logistic 回歸進行多因素分析,建立風險預測模型,采用ROC 曲線下面積檢驗模型預測效果。以P<0.05 表示差異具有統計學意義。
2 結果
2.1 胃癌術后患者營養不良發生情況胃癌術后3個月共有60 例(22.8%)患者發生營養不良,作為營養不良組;203 例(77.2%)營養狀況良好,作為非營養不良組。其中SGA-A 級203 例,SGA-B 級37 例,SGA-C 級23 例。
2.2 胃癌術后患者營養不良的單因素和多因素分析單因素分析表明性別、文化程度、婚姻狀況、手術方式、吸煙、糖尿病、高血壓、腫瘤大小、病理分期與術后3 個月營養不良無關(P>0.05)。年齡、術前營養不良、手術切除范圍、術后并發癥以及術后輔助化療與術后3 個月營養不良的發生相關(P<0.05),見表1。多因素分析表明年齡、術前營養不良、全胃切除、術后并發癥以及術后輔助化療是術后營養不良的獨立危險因素(P<0.05),見表2。模型公式為Z=0.728×年齡+1.071×術前營養不良+1.308×全胃切除+1.240×術后并發癥+1.403×術后輔助化療-3.887。

表1 胃癌患者術后發生營養不良的單因素分析(n)

續表1
2.3 ROC 曲線對胃癌術后營養不良風險預測模型的驗證繪制 ROC 曲線驗證胃癌術后營養不良風險預測模型的效果,以約登指數最大值為最佳臨界值。ROC 曲線下面積為0.849[95%CI(0.790,0.907)],約登指數為0.881,靈敏度為81.3%,特異度為80.0%,見圖1。
2.4 胃癌術后營養不良風險預測模型的應用效果選取2019年5月~2020年1月我院治療的58 例胃癌患者作為研究對象,驗證營養不良風險預測模型。當Z值≥0.881 時表明可能出現營養不良。本模型預測13例患者出現營養不良,45例未出現營養不良。實際結果為10 例發生營養不良,48 例未發生營養不良。預測結果與實際結果比較,本預測模型靈敏度為80.0%(8/10),特異度為89.6%(43/48)。

表2 胃癌患者術后發生營養不良的多因素分析
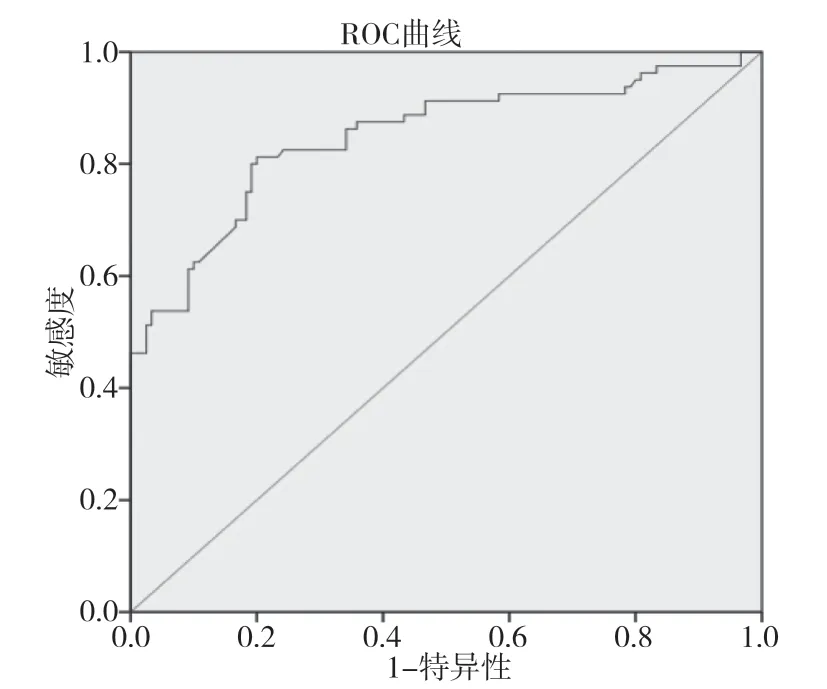
圖1 預測胃癌術后發生營養不良的ROC 曲線
3 討論
本研究中術后3 個月營養不良的發生率高達22.8%。Fujiya 等[7]對760 例胃癌根治性手術患者進行回顧性研究,發現術后營養不良對總生存率有顯著影響。Eo 等[8]將314 例根治性手術切除胃癌患者納入研究,發現與營養不良反應風險低的患者相比,營養不良反應風險高的患者5年無病生存率和5年生存率均較低。原因考慮為:非自主性體重下降導致T 細胞活性降低和腸道內環境惡化,導致全身免疫功能減弱。同時,營養不良增加術后輔助治療的副作用,導致化療劑量減少甚至中止化療,進而影響患者的生存時間[9]。因此,加強術后營養管理,保持良好的營養狀態,對促進患者盡早恢復非常重要。
預測模型對預測疾病發展、篩查未確診患者、指導臨床決策以及判斷治療效果至關重要。當ROC 曲線下面積<0.7 時表示預測效能低;0.7≤ROC曲線下面積≤0.9 時表示預測效能中等;ROC 曲線下面積>0.9 時表示預測效能高。本預測模型ROC曲線下面積為0.849,表示預測效果較為理想。對預測模型進行驗證,結果顯示靈敏度為80.0%,特異度為89.6%,表明預測效果較好。有研究表明,口服營養補充可改善進展期胃癌患者全胃切除術后輔助化療期間的營養狀況,降低營養不良的發生率[10]。因此,利用該模型有利于醫護人員早期識別營養不良的患者,提前采取全面的營養支持。干預措施包括:強化營養教育和膳食指導、口服營養補充;存在進食障礙的患者可考慮鼻飼喂養;經口進食+腸內營養仍無法滿足機體需要者建議腸外 營養。
胃癌患者由于消化吸收功能受損、上腹部疼痛不適,幽門梗阻導致食物攝入量減少,腫瘤分解代謝增多引起機體慢性消耗、失血,大約20.0%的患者在術前出現營養不良[11]。本研究中,術前營養不良是術后營養不良的重要原因。一方面,術前營養不良造成術后恢復延遲、并發癥增多和住院時間延長。另一方面,術前營養不良表明腫瘤消耗更多且臨床分期較晚,需要清掃淋巴結的范圍更大,對患者 的創傷更嚴重。我國《胃癌胃切除手術加速康復外科專家共識(2016 版)》指出,具有術前營養不良的患者需要進行≥1 周的術前營養支持治療[12]。
術后輔助化療可以消滅微小腫瘤病灶、抑制腫瘤細胞生長、延長患者生存時間。然而,術后輔助化療是發生術后營養不良的獨立危險因素。化療常伴隨惡心、嘔吐、腹瀉、口腔粘膜炎、味覺改變,導致患者食欲下降、攝入量減少,從而導致體重下降、營養不良。因此,需要積極處理化療的不良反應,并加強飲食指導。
胃癌血供豐富、淋巴結清掃難度大,術后并發癥總發生率為20%[13]。并發癥延長患者的住院時間、增加心理負擔以及加重全身炎癥反應,使機體處于負氮平衡。本研究中,術后并發癥是營養不良的獨立危險因素。對出現術后并發癥的患者需要強化營養支持,促進術后康復。
患者年齡越大,術后越容易出現營養不良。老年人由于生理機能減退、新陳代謝減慢,從而導致術后恢復延遲。同時,老年患者常合并糖尿病等基礎疾病,術后容易出現切口感染、肺炎等并發癥。
相對于遠端胃大部切除患者,全胃切除更容易出現營養不良。全胃切除的手術范圍更大、手術及麻醉時間更長、術中出血量更多,從而延長術后恢復時間。胃具有儲存食物、分泌消化液、消化和吸收的功能。全胃切除引起消化液分泌減少、腸道動力和體液分泌失調,導致患者營養狀況不佳。因此,專家建議在保證手術治療效果的前提下,盡可能保留殘胃功能,減少對患者術后生活質量的影響[14]。
總之,術后營養不良對患者的預后產生不利影響,本研究構建胃癌術后營養不良的風險預測模型,可有效預測營養不良的發生風險,有助于臨床上早期識別營養不良高危人群并及時進行干預,以改善患者的預后。

